La enfermedad hepática metabólica grasa (MAFLD, por sus siglas del inglés “Metabolic Associated Fatty Liver Disease”) es una complicación emergente de la diabetes mellitus (DM)1.
La MAFLD afecta a una cuarta parte de la población2 y su prevalencia está aumentando asociada al incremento de la DM tipo 2 (DM2) y la obesidad3. Por lo tanto, se puede considerar como una pandemia, al igual que la DM y la obesidad4.
En pacientes con DM2, la prevalencia global de MAFLD es del 55,5%, mientras que la de esteatohepatitis no alcohólica es del 37,3%1.
El cambio de nomenclatura de NAFLD (enfermedad del hígado graso no alcohólico) a MAFLD devuelve esta enfermedad a la realidad y la acerca no solo a su fisiopatología, sino también a la DM22. Hoy en día se considera a la MAFLD como una enfermedad metabólica y multifactorial que representa la manifestación hepática de un trastorno metabólico sistémico3.
La MAFLD requiere un abordaje holístico y centrado en el paciente. Se debe evaluar a estos pacientes en el marco de equipos multidisciplinares, en los que el papel del endocrino es muy importante, al tratarse de una enfermedad multisistémica. Esta patología tiene una relación muy directa con complicaciones como DM2, enfermedad cardiovascular, enfermedad renal y cáncer de colon5.
Dado que no existen terapias farmacológicas específicas aprobadas para la MAFLD, un manejo óptimo de los factores de riesgo metabólico es fundamental para reducir el riesgo cardiovascular asociado a través de: programas de cambios de estilo de vida (medidas higiénico-dietéticas)6,7, vitamina E/Pioglitazona7, antidiabéticos orales6, hipolipemiantes6 o antihipertensivos6. No obstante, en los próximos años, se va a producir un gran desarrollo de ensayos clínicos sobre esta patología, por lo que vendrán muchas moléculas nuevas sobre las que se debe estar atento4.
Los endocrinos tienen un papel fundamental en aquellos pacientes con esteatosis, que todavía no han desarrollado esteatohepatitis, o que ya la tienen, para identificarlos en la consulta y evitar así que progrese la enfermedad o conseguir que incluso se reduzca. Por ello, el paso importante para que no se escape ningún paciente consiste en un cribado adecuado para un diagnóstico preciso. Para este abordaje, es importante la coordinación entre endocrinología, atención primaria, digestivo y laboratorio4.
En mayo de 2021, la Asociación Española para el Estudio del Hígado (AEEH) propuso un algoritmo sencillo para conocer qué pacientes podían estar en riesgo de desarrollar MAFLD, y en el que se proponían el uso de índices no invasivos para descartar fibrosis avanzada. Tras aplicar índices serológicos como el Hepamet Fibrosis Socore (HFS) o el FIB-4, en los pacientes con riesgo elevado, el algoritmo recomienda, entre otras pruebas, realizar el panel completo OWLiver® (ver Figura 1)8.
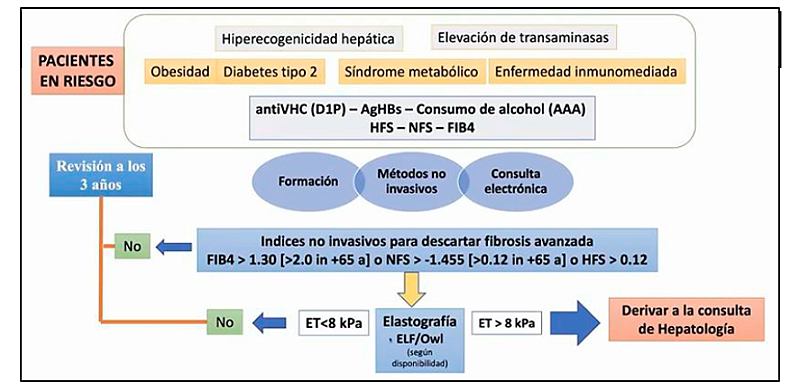
Figura 1
Extraída de 8
El test OWLiver® es un método de diagnóstico no invasivo que mediante un análisis de sangre permite la determinación de un panel de biomarcadores (39 metabolitos) aportando información sobre la actividad del hígado mediante metabolómica9-13.
OWLiver® realiza un informe que indica si un paciente tiene un hígado sano, o si tiene esteatosis, esteatohepatitis o bien ya esteatohepatitis con fibra F2-F39-15.
En un reciente estudio español firmado por la Dra. Virginia Bellido, se evaluó la utilidad del test no invasivo OWLiver® para la detección del hígado graso no alcohólico y esteatohepatitis en pacientes con DM2 con sobrepeso u obesidad16.
Según los resultados obtenidos en este estudio, los algoritmos del panel OWLiver® pueden ser buenas herramientas para la detección precoz del hígado graso no alcohólico y de la esteatohepatitis, respectivamente, en la práctica clínica habitual. OWLiver® puede reemplazar eficazmente la ecografía (ver Tablas 1 y 2)16.
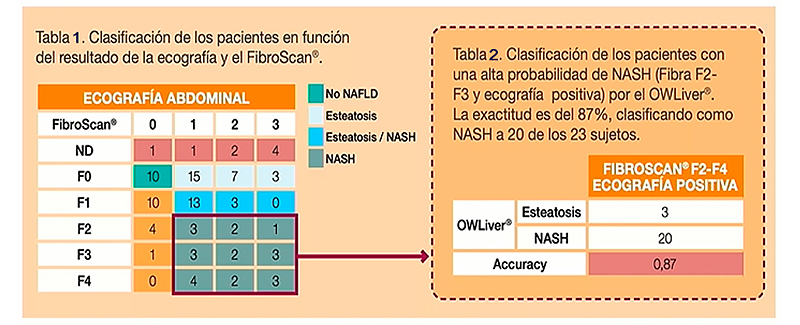
Tablas 1 y 2. Clasificación de los pacientes
Extraída de 16
OWLiver® hace una buena discriminación para el diagnóstico y seguimiento del paciente con MAFLD9-13,16.
En pacientes con el marcador serológico NFS o FIB-4 elevado, con riesgo intermedio-alto, OWliver® puede ayudar de manera complementaria a la elastografía para hacer una correcta estratificación del paciente8,16,17.
Bibliografía
1. Younossi ZM, Golabi P, de Avila L, Paik JM, Srishord M, Fukui N, et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and meta-analysis. J Hepatol. 2019 Oct;71(4):793-801.
2. Eslam M, Sanyal AJ, George J; International Consensus Panel. MAFLD: A Consensus-Driven Proposed Nomenclature for Metabolic Associated Fatty Liver Disease. Gastroenterology. 2020 May;158(7):1999-2014.e1.
3. Tilg H, Effenberger M. From NAFLD to MAFLD: when pathophysiology succeeds. Nat Rev Gastroenterol Hepatol. 2020 Jul;17(7):387-388.
4. Morales C. Puesta al Día. Manejo de lípidos y MAFLD en pacientes con diabetes. Importancia del cribado y manejo de la Enfermedad Hepática Metabólica o MAFLD en DM2. 62 Congreso de la Sociedad Española de Endocrinología y Nutrición (SEEN). Sevilla. 13-15 octubre. 2021.
5. Targher G, Tilg H, Byrne CD. Non-alcoholic fatty liver disease: a multisystem disease requiring a multidisciplinary and holistic approach. Lancet Gastroenterol Hepatol. 2021 Jul;6(7):578-588.
6. Kasper P, Martin A, Lang S, Kütting F, Goeser T, Demir M, et al. NAFLD and cardiovascular diseases: a clinical review. Clin Res Cardiol. 2021 Jul;110(7):921-937.
7. Aller R, Fernández-Rodríguez C, Lo Iacono O, Bañares R, Abad J, Carrión JA, et al. Consensus document. Management of non-alcoholic fatty liver disease (NAFLD). Clinical practice guideline. Gastroenterol Hepatol. 2018 May;41(5):328-349. English, Spanish.
8. Jornada de Consenso de la AEEH: “Consenso sobre Métodos de Detección y Derivación de Enfermedades Hepáticas Prevalentes Ocultas”, 27 mayo 2021.
9. Barr J, Vázquez-Chantada M, Alonso C, Pérez-Cormenzana M, Mayo R, Galán A, et al. Liquid chromatography-mass spectrometry-based parallel metabolic profiling of human and mouse model serum reveals putative biomarkers associated with the progression of nonalcoholic fatty liver disease. J Proteome Res. 2010 Sep 3;9(9):4501-12.
10. Barr J, Caballería J, Martínez-Arranz I, Domínguez-Díez A, Alonso C, Muntané J, et al. Obesity-dependent metabolic signatures associated with nonalcoholic fatty liver disease progression. J Proteome Res. 2012;11(4):2521 -32.2.
11. Mayo R, Crespo J, Martínez‐Arranz I, Banales JM, Arias M, Mincholé I, et al. Metabolomic‐based noninvasive serum test to diagnose nonalcoholic steatohepatitis: Results from discovery and validation cohorts. Hepatol Commun. 2018;2(7):807 -20.
12. Noureddin M, Mayo R, Martínez-Arranz I, Mincholé I, Cusi K, Bril F, et al. Serum-based Metabolomics Advanced StEatohepatitis Fibrosis Score (MASEF) for the non- invasive identification of patients with non-alcoholic steatohepatitis with significant fibrosis. J Hepatol. 2020; 73(1): S136.
13. Ortiz P, et al. J Hepatol. 2021;75 Suppl. 2.
14. Bril F, Millán L, Kalavalapalli S, McPhaul MJ, Caulfield MP, Martinez-Arranz I, et al. Use of a metabolomic approach to non-invasively diagnose non-alcoholic fatty liver disease in patients with type 2 diabetes mellitus. Diabetes Obes Metab. 2018;20(7):1702 -9.
15. Martínez‐Arranz I, Mayo R, Banales J, Mincholé I, Ortiz P, Bril F, et al. Non‐invasive serum lipidomic approach to discriminate non‐alcoholic steatohepatitis in multiethnic patients with type 2 diabetes mellitus. Hepatol. 2019; 70(1):1030A.
16. Bellido V, Martínez-Arraz I, Amor AJ, Pi JJ, Gil P, González O, et al. “Utilidad clínica de un método no invasivo para el diagnóstico de hígado graso no alcohólico y esteatohepatitis en diabetes tipo 2”. Endocrinol Diabetes Nutr. 2020;67(Espec Cong 1):69.
17. Guerra-Ruiz A, Casals G, Iruzubieta P, Lalana M, Leis A, López RM, et al. "Valoración bioquímica en la enfermedad hepática grasa asociada a la disfunción metabólica”. Advances in Laboratory Medicine/Avances en Medicina de Laboratorio, vol. 2, no. 2, 2021, pp. 209-219.




