Introducción
El consumo de probióticos puede ser útil para mantener y restaurar el equilibrio entre el sistema digestivo y la microbiota intestinal. Los probióticos están destinados a mejorar la población de bacterias beneficiosas que se encuentran en el intestino, ya que promueven su desarrollo. Al crecer en este órgano y adherirse a la mucosa intestinal, evitan que otras bacterias dañinas se implanten y ejerzan sus funciones negativas para la salud de las personas.
HOWARU® Restore es un producto probiótico destinado a aliviar los síntomas digestivos y estabilizar la microbiota intestinal. Se compone de 4 cepas bacterianas: Bifidobacterium lactis Bi-07, Bifidobacterium lactis Bl-04, Lactobacillus paracasei Lpc-37 y Lactobacillus acidophilus NCFM®, en cantidades equivalentes. Cada una de estas cepas puede ejercer diferentes funciones como la regulación de la microbiota, la exclusión de patógenos, el desarrollo de funciones antiinflamatorias y el alivio de los síntomas digestivos (distensión abdominal, estreñimiento y dolor abdominal).
Bifidobacterium lactis Bi-07
En varios estudios se ha demostrado el potencial de B. lactis Bi-07, especialmente en combinación con L. acidophilus NCFM®, en la mejora de la salud digestiva. De forma aislada[1] o combinada[2] puede aliviar los síntomas del estreñimiento, y en una formulación con otras cuatro cepas demostró tener capacidad para estabilizar la microbiota intestinal durante y después de la terapia con antibiótico[3]. En combinación con L. acidophilus NCFM reduce el dolor abdominal[4,5] y la distensión abdominal en pacientes con alteraciones intestinales funcionales[6].
Además, disminuye los episodios de diarrea y mejora la sintomatología en niños con diarrea y pacientes con alteraciones del tránsito o con síndrome de intestino irritable[2,7,8]. Se han llevado a cabo dos estudios para analizar los efectos de B. lactis Bi-07 en una simbiosis con otras cepas de probióticos y fibra soluble en los síntomas digestivos de niños preescolares, y se ha comprobado que promueve el aumento de peso y la reducción de las enfermedades bacterianas[9,10]. B. lactis Bi-07 presenta también importantes acciones reguladoras de la función inmunitaria[11-13]. Un estudio en 326 niños chinos evaluó el impacto de una combinación de B. lactis Bi-07 y otra cepa probiótica en la salud respiratoria. La formulación redujo significativamente la incidencia y la duración de los síntomas respiratorios y la necesidad de antibióticos[12,13].
Bifidobacterium lactis BI-04

Fuente: Archivo
B. lactis BI-04 tiene capacidad para estabilizar la microbiota intestinal durante y después de la terapia con antibiótico. La formulación de cinco cepas con B. lactis BI-04 reduce la alteración inducida por el antibiótico en la población microbiota total[2,14]. Una formulación de dos cepas con B. lactis BI-04 en combinación con un probiótico demostró una modulación de la microbiota beneficiosa en ancianos[15]. La cepa puede inhibir el crecimiento de patógenos, puesto que produce una sustancia inhibitoria del tipo de las bacteriocinas, que es eficaz al menos frente a Listeria monocytogenes[16]. Asimismo, presenta funciones analgésicas[17], de ahí que tenga capacidad para modular el dolor intestinal.
En un ensayo clínico en el que se estudió el efecto de los probióticos en la funcionalidad de la vacunación contra el cólera humano se detectó que B. lactis Bl-04 indujo una respuesta rápida a la vacunación, como lo demuestran los valores séricos de inmunoglobulina, lo que indica un efecto de mejora inmunitaria de la cepa[18]. Además, la cepa mejora la respuesta inmune en las superficies mucosas[19,20] y ejerce influencia sobre la regulación del sistema inmunitario, como lo avala la inducción de IL-10[21].
B. lactis Bl-04 en combinación con L. acidophilus NCFM® alivió los síntomas de rinitis alérgica en niños durante la temporada del polen de abedul[22]. También actúa como agente antiinfeccioso, ya que promueve una reducción del riesgo de infecciones de las vías respiratorias altas en adultos sanos[23,24] y de las infecciones bacterianas en pacientes con trasplante hepático cuando se utilizó en combinación con otras cepas[25].
Lactobacillus paracasei Lpc-37
L. paracasei Lpc-37 tiene capacidad para estabilizar la microbiota intestinal durante y después de la terapia con antibiótico. En niños indios preescolares, el consumo de la cepa redujo significativamente la incidencia de diarrea y fiebre durante la estación húmeda[26]. Una combinación de fructooligosacáridos (FOS) prebióticos, L. paracasei Lpc-37, Lactobacillus rhamnosus HN001, L. acidophilus NCFM® y B. lactis HN019 mejoró la intensidad del estreñimiento[27].
Por otro lado, el consumo de una combinación de L. paracasei Lpc-37 con otras dos cepas de probióticos, Lactobacillus acidophilus 74-2 y Bifidobacterium animalis spp. lactis 420, demostró la capacidad para disminuir el potencial genotóxico del agua fecal de los pacientes con dermatitis atópica (DA)[28]. La administración oral de la cepa presenta funciones analgésicas[17]. L. paracasei Lpc-37 mejora la respuesta inmunitaria en pacientes con DA, evita la formación de tumores, disminuye el colesterol en humanos[29] e induce la expresión de la ciclooxigenasa[30].
Lactobacillus acidophilus NCFM®
L. acidophilus NCFM® regula la microbiota en poblaciones susceptibles como niños con dermatitis atópica[31], y ancianos o pacientes que consumen antibióticos[14] o AINE[32,33]. La combinación B. lactis Bi-07, L. acidophilus NCFM® y fructooligosacáridos reduce los días de enfermedad en niños de 3-5 años[6]. Preparados probióticos que incluyen este microorganismo han demostrado disminuir la incidencia y la frecuencia de episodios diarreicos en niños[7].

Autor/a: Paweł Czerwiński
Fuente: unsplash.com (free photo)
Una combinación de L. acidophilus NCFM®, B. lactis Bi-07 y fibra soluble ha demostrado reducir la frecuencia de deposiciones y el uso de loperamida en pacientes VIH positivos con diarrea[8]. La cepa reduce la intensidad de los síntomas de distensión abdominal en pacientes con síndrome intestinal sin estreñimiento, diarrea funcional o distensión abdominal después de 4 y 8 semanas de consumo de L. acidophilus NCFM® y B. lactis Bi-07 en combinación[5]. L. acidophilus NCFM® reduce el tiempo de tránsito en pacientes con estreñimiento[34] y disminuye el dolor abdominal. La administración oral presenta funciones analgésicas en el intestino similares a los efectos de la morfina[17].
L. acidophilus NCFM® también mejora los síntomas de la intolerancia a la lactosa, dado que disminuye el nivel de hidrógeno en la respiración[35], lo que indica una mejor digestión. La administración de 10E9-10E10 cfu de L. acidophilus NCFM® al día disminuye la actividad de las enzimas azorreductasa, nitrorreductasa y la β-glucuronidasa, que favorecen la conversión de procarcinógenos en sustancias cancerígenas[36-38]. En pacientes con SBID e insuficiencia renal terminal ha demostrado que mejora los parámetros nutricionales como la ganancia de peso corporal y la ingesta calórica, y disminuye los niveles de compuestos carcinógenos como la dimetilamina (DMA) y nitrosodimetilamina (NDMA)[39].
L. acidophilus NCFM® aporta beneficios en el funcionamiento de la mucosa intestinal, activa respuestas inmunes importantes para la protección contra infecciones[40,41] y parece ser útil para prevenir las infecciones del tracto urinario y vaginal[41]. Reduce de forma significativa la incidencia y la duración de la fiebre, de los síntomas de infección respiratoria superior y del uso de antibióticos en comparación con placebo en niños[13], mejora la rinitis asociada a la alergia al polen[42], disminuye la obesidad[43] y puede ser beneficiosa en las personas que sufren trastornos asociados con el oxalato[44,45].
El análisis del genoma de L. acidophilus NCFM® ha confirmado la ausencia de elementos genéticos transferibles conocidos relacionados con la resistencia a los antibióticos.
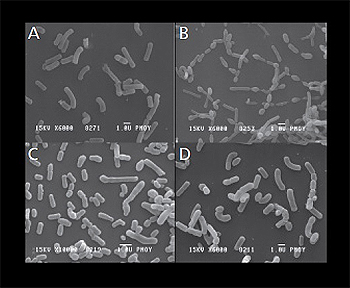
Microscopía electrónica de barrido de
todas las cepas bacterianas de HOWARU® Restore:
A) Lactobacillus acidophilus NCFM®; B) Lactobacillus
paracasei Lpc-37; C) Bifidobacterium
lactis Bl-04; D) Bifidobacterium lactis Bi-07
Fuente: STADA
Combinación de las cuatro cepas en un solo producto
La eficacia y seguridad de la combinación de las cuatro cepas (HOWARU® Restore) ha quedado demostrada en un estudio que valoró el efecto dosis-respuesta de la combinación probiótica de cuatro cepas (HOWARU® Restore) sobre la incidencia de diarrea asociada a los antibióticos (DAA) y diarrea asociada a Clostridium difficile (CDAD), y sobre la gravedad de los síntomas gastrointestinales (heces por día, heces con sangre, fiebre, calambres abdominales e hinchazón) en pacientes adultos hospitalizados que requerían terapia antibiótica[46]. Se observó un efecto dosis-respuesta significativo sobre la DAA con incidencias de 12,5, 19,6 y 24,6% a dosis altas, bajas y placebo, respectivamente (p = 0,02). La CDAD fue igual en ambos grupos probióticos (1,8%), pero superior en el grupo placebo (4,8%, p = 0,04). La duración de la diarrea se redujo significativamente; la duración pasó de 5,4 días en el grupo placebo a 3,5 días en el grupo de dosis baja y hasta 2,6 días en el grupo de dosis alta.
La dosis alta también redujo significativamente la CDAD hasta un nivel comparable al notificado para otros probióticos[47]. Si bien no todos los sujetos experimentaron DAA, muchos sufrieron otros síntomas relacionados con el uso de antibióticos. En concreto, se observó que la dosis alta redujo significativamente la incidencia de fiebre, dolor abdominal y distensión abdominal frente al grupo placebo[46]. El número de las deposiciones líquidas diarias y la duración media de la diarrea disminuyeron con mayor dosificación de probióticos. La combinación de las cuatro cepas de probióticos reduce el riesgo de DAA, CDAD y los síntomas gastrointestinales de forma dosis-dependiente en pacientes adultos hospitalizados.
Hay indicios de que combinar cepas probióticas puede conferir un beneficio. Los beneficios de las cepas combinadas pueden ser aditivos o incluso sinérgicos. Algunas evidencias sugieren que puede haber un efecto beneficioso potencialmente superior para algunos objetivos con la combinación de probióticos frente al producto con una sola cepa[48]. Además, las interacciones antagonistas entre las cepas en una combinación son muy raras. Se ha demostrado que las cepas incluidas en la combinación de probióticos de cuatro cepas presentada aquí tienen cada una beneficios para la salud digestiva solas o en combinación con otras cepas, como la reducción del dolor o las molestias intestinales, la disminución del riesgo de diarrea extrahospitalaria y la reducción de la distensión.
Puesto que se ha demostrado que la combinación de probióticos de cuatro cepas tiene un efecto beneficioso similar en los síntomas relacionados con el uso de antibióticos, se sugiere que puede haber una sinergia con la combinación de las cuatro cepas en un producto. Además, B. lactis Bl-04 y la combinación de B. lactis Bi-07 y L. acidophilus NCFM® han demostrado una mejora de la resistencia a infecciones de las vías respiratorias altas y una modulación de los marcadores de la función inmunitaria. Esto sugiere que la combinación de las cuatro cepas podría tener más beneficios que los que aquí se presentan para la combinación.

Productos derivados de HOWARU® RESTORE
Fuente: STADA
Referencias
1. Favretto DC, Pontin B, Moreira TR. Effect of the consumption of a cheese enriched with probiotic organisms (Bifidobacterium lactis bi-07) in improving symptoms of constipation. Arq Gastroenterol 2013;50(3):196-201.
2. Fisberg M, Maulén-Radován IE, Tormo R, et al. Effect of oral nutritional supplementation with or without synbiotics on sickness and catchup growth in preschool children. International Pediatrics 2002;17(4):216-22.
3. Engelbrektson AL, Korzenik JR, Sanders ME, Clement BG, Leyer G, Klaenhammer TR, et al. Analysis of treatment effects on the microbial ecology of the human intestine. FEMS Microbiol Ecol 2006;57:239-50.
4. Ringel-Kulka T, Palsson OS, Maier D, Carroll I, Galanko JA, Leyer G, et al. probiotic bacteria: probiotic bacteria Lactobacillus acidophilus NCFM and bifidobacterium lactis bi-07 versus placebo for the symptoms of bloating in patients with functional bowel disorders-a double-blind study. J Clin Gastroenterol 2001;45(6):518-25.
5. Ringel‐Kulka T, Goldsmith J, Carrol IM, Barros SP, Palsson O, Jobin C, et al. Lactobacillus acidophilus NCFM affects colonic mucosal opioid receptor expression in patients with functional abdominal pain‐a randomised clinical study. Aliment Pharmacol Ther 2014;40(2):200-7.
6. D’Souza B, Slack T, Wong SW, Lam F, Muhlmann M, Koestenbauer J, et al. Randomized controlled trial of probiotics after colonoscopy. ANZ J Surg 2017;87(9):E65-E69.
7. Ruiz-Palacios GF, Guerrero M, Hilty M, et al. Feeding of a probiotic for the prevention of community acquired diarrhoea in young Mexican children. Pediatr Res 1999;39(2):104 (abstr).
8. Heiser CR, Ernst JA, Barrett JT, French N, Schutz M, Dube MP. Probiotics, soluble fiber, and L-Glutamine (GLN) reduce nelfinavir (NFV)- or lopinavir/ritonavir (LPV/r)- related diarrhea. J Int Assoc Physicians AIDS Care (Chic Ill ) 2004;3(4):121-9.
9. Schrezenmeir J, Heller K, McCue M, Llamas C, Lam W, Burow H, et al. Benefits of oral supplementation with and without synbiotics in young children with acute bacterial infections. Clinical Pediatrics 2004;43:239-49.
10. Fisberg M, Maulen-Radovan IE, et al. Effect of oral nutritional supplementation with or without synbiotics on sickness and catch-up growth in preschool children. International Pediatrics 2002;17(4):216-22.
11. Paineau D, Carcano D, Leyer G, Darquy S, Alyanakian MA, Simoneau G, et al. Effects of seven potential probiotic strains on specific immune responses in healthy adults: a double-blind, randomized, controlled trial. FEMS Immunology & Medical Microbiology 2008;53(1):107-13.
12. Ouwehand A, Leyer G, Carcano D. Probiotics reduce incidence and duration of respiratory tract infection symptoms in 3-to 5- year-old children. Pediatrics 2008;121;S115 (abstr.)
13. Leyer GJ, Li S, Mubasher ME, Reifer C, Ouwehand AC. Probiotic effects on cold and influenza-like symptom incidence and duration in children. Pediatrics 2009;124:e172-e179.
14. Engelbrektson AL, Korzenik JR, Pittler A, Sanders ME, Klaenhammer TR, Leyer G, et al. Probiotics to minimize the disruption of faecal microbiota in healthy subjects undergoing antibiotic therapy. J Med Microbiol 2009;58:663-70.
15. Bartosch S, Woodmansey EJ, Paterson JC, McMurdo ME, Macfarlane GT. Microbiological effects of consuming a synbiotic containing Bifidobacterium bifidum, Bifidobacterium lactis and oligofructose in elderly persons, determined by real time polymerase chain reaction and counting of viable bacteria. Clin Infect Dis 2005;40:28-37. [Strain BL01™ = Bl-04™]
16. Martinez FAC, Domínguez JM, Converti A, Oliveira RP. Production of bacteriocin-like inhibitory substance by Bifidobacterium lactis in skim milk supplemented with additives. J Dairy Research 2015;82(03):350-5.
17. Rousseaux C, Thuru X, Gelot A, Barnich N, Neut C, Dubuquoy L, et al. Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nat Med 2007;13:35-7.
18. Paineau D, Carcano D, Leyer G, Darquy S, Alyanakian MA, Simoneau G, et al. Effects of seven potential probiotic strains on specific immune responses in healthy adults: a double-blind, randomized, controlled trial. FEMS Immunology and Medical Microbiology 2008; 53(1):107-13.
19. Turner R, Woodfolk JA, Borish L, Steinke JW, Patrie JT, Muehling LM, et al. Effect of probiotic on innate inflammatory response and viral shedding in experimental rhinovirus infection–a randomised controlled trial. Beneficial Microbes 2017;7:1-10.
20. West NP, Horn PL, et al. Supplementation with a single and double strain probiotic on the innate immune system for respiratory illness. e-SPEN J 2014;9(5):e178-e184.
21. Lammers KM, Brigidi P, Vitali B, Gionchetti P, Rizzello F, Caramelli E, et al. Immunomodulatory effects of probiotic bacteria DNA: IL-1 and IL-10 response in human peripheral blood mononuclear cells. FEMS Immunology and Medical Microbiology 2003;38:165-72.
22. Ouwehand AC, Nermes M, Collado MC, Rautonen N, Salminen S, Isolauri E. Specific probiotics alleviate allergic rhinitis during the birch pollen season. World J Gastroenterol 2009;15(26):3261-8.
23. West NP, Horn PL, Pyne DB, Gebski VJ, Lahtinen SJ, Fricker PA, et al. Probiotic supplementation for respiratory and gastrointestinal illness symptoms in healthy physically active individuals. Clin Nutr 2014;33(4):581-7.
24. Turner R, Woodfolk JA, Borish L, Steinke JW, Patrie JT, Muehling LM, et al. Effect of probiotic on innate inflammatory response and viral shedding in experimental rhinovirus infection–a randomised controlled trial. Beneficial Microbes 2017;7:1-10.
25. Zhang Y, Chen J, Wu J, Chalson H, Merigan L, Mitchell A. Probiotic use in preventing postoperative infection in liver transplant patients. Hepatobiliary Surg Nutr 2013;2(3):142.
26. Hemalatha R, Ouwehand AC, Saarinen MT, Prasad UV, Swetha K, Bhaskar V. A community-based randomized double blind controlled trial of Lactobacillus paracasei and Bifidobacterium lactis on reducing risk for diarrhea and fever in preschool children in an urban slum in India. Eur J Food Research & Review 2014;4(4):325.
27. Waitzberg DL, Logullo LC, Bittencourt AF, Torrinhas RS, Shiroma GM, Paulino NP, et al. (2013). Effect of synbiotic in constipated adult women–a randomized, double-blind, placebo-controlled study of clinical response. Clinical Nutrition 2013;32(1):27-33.
28. Roessler A, Forssten S, Glei M, Ouwehand AC, Jahreis G. The effect of probiotics on faecal microbiota and genotoxic activity of faecal water in patients with atopic dermatitis: a randomized, placebo-controlled study. Clinical Nutrition 2011;31(1):22-9.
29. Trautvetter U, Ditscheid B, Kiehntopf M, Jahreis G. A combination of calcium phosphate and probiotics beneficially influences intestinal lactobacilli and cholesterol metabolism in humans. Clin Nutr 2012;31(2):230-7.
30. Mäkeläinen H, Forssten S, Saarinen M, Stowell J, Rautonen N, Ouwehand AC. Xylo-oligosaccharides and lactitol promote the growth of Bifidobacterium lactis and Lactobacillus species in pure cultures. Beneficial Microbes 2010;1:139-48.
31. Larsen N, Vogensen FK, Gøbel R, Michaelsen KF, Abu Al-Soud W, Sørensen SJ, et al. Predominant genera of fecal microbiota in children with atopic dermatitis are not altered by intake of probiotic bacteria Lactobacillus acidophilus NCFM® and Bifidobacterium animalis subsp. Lactis Bi-07™. FEMS Microbiol Ecol 2011;75(3):482-96.
32. Björklund M, Ouwehand AC, Forssten SD, Nikkilä J, Tiihonen K, Rautonen N, et al. Gut microbiota of healthy elderly NSAID users is selectively modified with the administration of Lactobacillus acidophilus NCFM® and lactitol. Age (Dordr) 2012;34(4):987-99.
33. Varcoe J, Zook C, Sui J, Leighton S, Busta F, Brady L. Variable response to exogenous Lactobacillus acidophilus NCFM® consumed in different delivery vehicles. J Appl Microbiol 2002;93: 900-6.
34. Magro DO, de Oliveira LM, Bernasconi I, Ruela Mde S, Credidio L, Barcelos IK, et al. Effect of yogurt containing polydextrose, Lactobacillus acidophilus NCFM and Bifidobacterium lactis HN019: a randomized, double-blind, controlled study in chronic constipation. Nutr J 2014;13(1):75.
35. Kim HS, Gilliland SE Lactobacillus acidophilus as a dietary adjunct for milk to aid lactose digestion in humans. J Dairy Sci 1983;66(5):959-66.
36. Goldin BR, Gorbach SL The effect of oral administration on Lactobacillus and antibiotics on intestinal bacterial activity and chemical induction of large bowel tumors. Dev Indust Microbiol 1984;25:139-50.
37. Gorbach SL. The effect of milk and lactobacillus feeding on human intestinal bacterial enzyme activity. Amer J Clin Nutr 1984;39:756-61.
38. Goldin BR, Swenson L, Dwyer J, Sexton M, Gorbach SL Effect of diet and Lactobacillus acidophilus supplements on human fecal bacterial enzymes. J Natl Cancer Instit 1980;64:255-61.
39. Dunn SR, Simenhoff ML, Ahmed KE, Gaughana WJ, Eltayebaet BO, Fitzpatrick MED, et al. Effect of oral administration of freeze-dried Lactobacillus acidophilus on small bowel bacterial overgrowth in patients with end stage kidney disease: reducing uremic toxins and improving nutrition. Int Dairy J 1998;8:545-53.
40. Paineau D, Carcano D, Leyer G, Darquy S, Alyanakian MA, Simoneau G, et al. Effects of seven potential probiotic strains on specific immune responses in healthy adults:a double-blind, randomized, controlled trial. FEMS Immunol Med Microbiol 2008;53(1):107-13.
41. Reid G. Investigation of the properties of Lactobacillus acidophilus NCFM™ as a possible probiotic for the urogenital tract. Int Dairy J 2000;10(5-6):415-9.
42. Ouwehand AC, Nermes M, Collado MC, Rautonen N, Salminen S, Isolauri E. Specific probiotics alleviate allergic rhinitis during the birch pollen season. World J Gastroenterol 2009; 15(26):3261-8.
43. Muccioli GG, Naslain D, Bäckhed F, Reigstad CS, Lambert DM, Delzenne NM, et al. The endocannabinoid system links gut microbiota to adipogenesis. Mol Syst Biol 2010;6:392.
44. Turroni S, Vitali B, Bendazzoli C, Candela M, Gotti R, Federici F, et al. Oxalate consumption by lactobacilli: evaluation of oxalyl-CoA decarboxylase and formyl-CoA transferase activity in Lactobacillus acidophilus. J Appl Microbiol 2007;103:5:1600-9.
45. Azcarate-Peril MA, Bruno-Bárcena JM, Hassan HM, Klaenhammer TR. Transcriptional and functional analysis of oxalyl-coenzyme A (CoA) decarboxylase and formyl-CoA transferase genes from Lactobacillus acidophilus. Appl Environ Microbiol 2006;72(3):1891-9.
46. Ouwehand AC, DongLian C, Weijian X, Stewart M, Ni J, Stewart T, et al. Probiotics reduce symptoms of antibiotic use in a hospital setting: a randomized dose response study. Vaccine 2014;32(4):458-63.
47. Lau CS, Chamberlain RS. Probiotics are effective at preventing Clostridium difficile-associated diarrhea: a systematic review and meta-analysis. Int J Gen Med 2016;9:27-37.
48. Chapman CM, Gibson GR, Rowland I. Health benefits of probiotics: are mixtures more effective than single strains? Eur J Nutr 2011;50(1):1-17.