Redacción Farmacosalud.com
Las firmas GSK e Innoviva, Inc han anunciado los resultados positivos del estudio de asma Salford Lung Study (SLS), un ensayo clínico innovador en el que han participado 4.233 pacientes tratados por su médico de Atención Primaria en un entorno de práctica clínica habitual. Este estudio abierto y aleatorizado ha mostrado que un número significativamente mayor de pacientes con asma en los que se había iniciado el tratamiento con Relvar® Ellipta® 92/22 mcg o 184/22 mcg (furoato de fluticasona “FF”/vilanterol “VI” o “FF/VI”) alcanzaron una mejora en el control del asma en comparación con los pacientes que habían seguido tomando su medicación habitual. Los tratamientos habituales incluían corticoesteroides inhalados (ICS) administrados en monoterapia o en combinación con agonista β2-adrenérgico de acción prolongada (LABA).
En el análisis primario de efectividad a las 24 semanas, un porcentaje significativamente mayor de pacientes con asma no controlada que habían iniciado tratamiento con FF/VI, obtuvieron un mejor control del asma, medido con el ACT (Asthma Control Test), en comparación con los pacientes que continuaron con el tratamiento habitual (71% vs 56 %) (odds ratio 2,00, 95% CI 1,70, 2,34; p<0,001). La mejora se definió como una puntuación total del ACT ≥20 o un aumento respecto al valor basal ≥3. También se observaron resultados estadísticamente significativos a las 12, 40 y 52 semanas.

Autor/a: Michelle Brea
Fuente: Flickr / Creative Commons
La neumonía, una variable de evaluación de seguridad
Dentro de la población por intención de tratar (ITT, por sus siglas en inglés), la incidencia de acontecimientos adversos graves (AAGs) fue similar entre ambos grupos (13% con FF/VI y 13% con el tratamiento habitual). La neumonía fue una variable de evaluación de seguridad de especial interés y un requerimiento post-autorización específico de la Agencia Europea del Medicamento (EMA, por sus siglas en inglés). Un aspecto novedoso del diseño de este estudio es que permitía que el tratamiento de un paciente se modificara durante el transcurso del trabajo. Por tanto, se han realizado dos evaluaciones relativas a la neumonía: una basada en el grupo al que se asignó aleatoriamente a los pacientes, y la segunda basada en el tratamiento al que estaban expuestos los pacientes en el momento de darse el acontecimiento. 39 pacientes comunicaron acontecimientos adversos graves de neumonía por grupo de asignación aleatoria (23 pacientes, 1% en el grupo de FF/VI; 16 pacientes, <1% en el grupo del tratamiento habitual). Estos pacientes presentaron 42 acontecimientos y, basándose en un análisis previsto, no se confirmó la no inferioridad de FF/VI comparado con el tratamiento habitual. Cuando estos acontecimientos se agruparon según el tratamiento real que los pacientes recibían en el momento del acontecimiento, se registraron 21 de ellos en el grupo de FF/VI y 21 en el grupo del tratamiento habitual.
El estudio SLS (Salford Lung Study) es un ensayo clínico de fase III, multicéntrico, aleatorizado, abierto y controlado. El objetivo de este estudio fue comparar la efectividad y perfil de seguridad de iniciar tratamiento con FF/VI frente a continuar el tratamiento habitual de mantenimiento del asma durante un periodo superior a 52 semanas. Todos los pacientes con asma elegibles de 74 centros de atención primaria en Salford, South Manchester y sus alrededores (Reino Unido), fueron identificados, a partir de bases de datos obtenidas de la práctica clínica, e invitados a participar por sus propios médicos de atención primaria. La variable principal del estudio se evaluó en la semana 24 en la población del análisis primario de efectividad.
El médico de Atención Primaria prescribía el tratamiento habitual
En total, 4.233 pacientes con asma que estaban siendo tratados con un corticoide inhalado (ICS) en monoterapia o en combinación con un agonista β2-adrenérgico de acción prolongada (LABA, por sus siglas en inglés), fueron aleatorizados a recibir FF/VI o a continuar con su tratamiento habitual de mantenimiento para el asma. El médico de Atención Primaria prescribía el tratamiento habitual e incluía un ICS en monoterapia o en combinación con un LABA. Al inicio de la investigación, en el brazo del tratamiento habitual el 36% de los pacientes recibían un ICS en monoterapia y un 64% estaban en tratamiento con una combinación ICS/LABA. El Salford Lung Study tenía unos criterios de exclusión mínimos e incluía una amplia representación de los pacientes con asma. En el momento de inicio del estudio, los pacientes tenían una edad media de 49,8 (mínimo 18 años) y distribuidos por género (hombres vs. mujeres 41/59%). Para ser incluidos en la investigación, los pacientes debían tener un diagnóstico de asma como principal enfermedad respiratoria emitido por su médico de atención primaria y estar recibiendo tratamiento de mantenimiento con un ICS en monoterapia o en combinación con un LABA durante al menos 4 semanas antes de la visita 2. En el momento inicial, el 72% de los pacientes tenían asma no controlada con una puntuación ACT entre 5-19.

Autor/a: webvilla
Fuente: Pixabay / Public Domain
Durante un periodo de 52 semanas se hizo un seguimiento de los pacientes en el entorno de la práctica clínica habitual, utilizando su historia clínica electrónica que vinculaba atención primaria, atención especializada y datos de farmacia para recoger información. A lo largo del estudio, los médicos podían modificar o cambiar el tratamiento en cualquier punto del estudio como hubiera hecho en la práctica clínica habitual. Como única excepción, no se permitió el cambio de tratamiento habitual a FF/VI. En las semanas 12, 24 y 40 se preguntó telefónicamente a los pacientes si habían presentado algún acontecimiento adverso grave o reacciones adversas a la medicación. Durante estas llamadas también se pidió a los pacientes que dieran respuestas sobre su Test de Control del Asma. A los 12 meses se llevó a cabo una visita presencial. También se realizó telefónicamente el cuestionario de calidad de vida para asma (Asthma Quality of Life Questionnaire) en las semanas 24 y 52.
El equipo del estudio podía controlar todos los ingresos hospitalarios, consultas externas y visitas a urgencias, así como los datos procedentes de atención primaria (incluyendo todos los contactos con profesionales de la salud, consultas fuera de horario y prescripción de antibióticos o esteroides orales) a través de la historia clínica electrónica. La población por intención de tratar (ITT, por sus siglas en inglés) se define como todos los pacientes que han sido asignados aleatoriamente y han recibido al menos una prescripción de la medicación del estudio (p.ej.- FF/VI o su tratamiento habitual de mantenimiento de asma). La población del análisis principal de efectividad se define como todos los pacientes de la población ITT que tenían una puntuación basal de ACT total inferior a 20 (visita de aleatorización). El odds ratio expresado en los resultados se calcula como la razón entre la probabilidad que tiene un paciente que ha iniciado tratamiento con Relvar® Ellipta® de mejorar su control del asma y la probabilidad para lo mismo de un paciente que continúa con su tratamiento habitual. Este valor se ajusta para cualquier desequilibrio entre los brazos del tratamiento de del estudio en ciertas características clave.
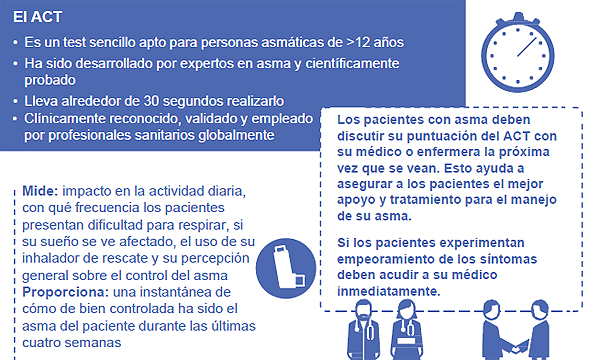
El Asthma Control Test (ACT)
El Test de Control del Asma o ACT es un instrumento muy reconocido que se utiliza globalmente en las guías terapéuticas de tratamiento del asma para evaluar el control de la enfermedad. Se auto-administra utilizando 5 preguntas para evaluar el control del asma durante las 4 semanas anteriores en una escala categórica de 5 puntos (del 1 al 5). Al responder las cinco preguntas, un paciente con asma puede obtener una puntuación que oscila entre 5 y 25, siendo las puntuaciones mayores las que indican un mejor control. Una puntuación ACT entre 5 y 19 sugiere que el paciente con asma no está bien controlado. Una puntuación de 20 a 25 sugiere que el paciente con asma probablemente esté bien controlado. La puntuación total se calcula como la suma de las puntuaciones de las 5 preguntas, recogiendo todas las puntuaciones de las 5 preguntas; si falta cualquier puntuación individual esa pregunta no se puede contar y la puntuación global se pierde. Un cambio de 3 puntos es clínicamente relevante para el paciente.

Asma Control Test
Fuente: GSK / Berbés Asociados
El asma es una enfermedad pulmonar crónica en la que hay inflamación y estrechamiento de las vías respiratorias. El asma afecta a 358 millones de personas en todo el mundo. A pesar de los avances de la medicina, más de la mitad de los pacientes siguen teniendo mal control y sufriendo síntomas importantes que influyen en su calidad de vida. No se conocen por completo las causas de esta afección, aunque probablemente haya una interacción entre la dotación genética de una persona y su entorno. Los principales factores de riesgo son sustancias inhaladas que provocan reacciones alérgicas o que irritan las vías respiratorias.
Relvar® Ellipta® es un tratamiento combinado dual que se administra una vez al día y que está compuesto por furoato de fluticasona, un corticoesteroide inhalado, y vilanterol, un agonista beta2 de acción prolongada, en un único inhalador, el dispositivo Ellipta®. Relvar ® Ellipta® está indicado en Europa para el tratamiento habitual de pacientes de 12 años de edad o mayores con asma, en los que sea adecuado el uso de un producto combinado (agonista ß2 de acción prolongada, LABA, y corticoesteroide inhalado, ICS): Pacientes no controlados adecuadamente con un ICS y un agonista ß2 de acción corta (SABA) a demanda.
Información importante sobre la seguridad de Relvar® Ellipta® en Europa
La combinación de FF/VI está contraindicada en pacientes con hipersensibilidad al furoato de fluticasona, el vilanterol o cualquiera de los excipientes. No se debe utilizar FF/VI para tratar los síntomas del asma aguda ni una agudización de EPOC, situaciones en las que es necesario un broncodilatador de acción corta. El aumento del uso de broncodilatadores de acción corta para aliviar los síntomas indica pérdida del control, y los pacientes deben ser revisados por un médico. Los pacientes no deben suspender el tratamiento con FF/VI del asma ni de la EPOC sin la supervisión de un médico, porque los síntomas pueden reaparecer tras suspenderlo. Durante el tratamiento con FF/VI pueden producirse acontecimientos adversos relacionados con el asma y agudizaciones. Se debe recomendar a los pacientes que continúen el tratamiento, y que soliciten asistencia médica, si los síntomas del asma siguen sin estar controlados o si empeoran después de iniciar el tratamiento con FF/VI.
Puede producirse broncoespasmo paradójico, con aumento de las sibilancias inmediatamente tras la administración del fármaco. En este caso se debe tratar inmediatamente con un broncodilatador inhalado de acción corta. Se debe suspender inmediatamente el tratamiento con FF/VI, se debe evaluar al paciente y se debe iniciar un tratamiento alternativo si es necesario. Pueden producirse efectos cardiovasculares, como arritmias cardíacas, p. ej. taquicardia supraventricular y extrasístoles, con los medicamentos simpaticomiméticos, incluyendo FF/VI. Por lo tanto, se debe utilizar con precaución la combinación de furoato de fluticasona/vilanterol en pacientes con enfermedades cardiovasculares graves.
Autor/a: Hey Paul Studios
Fuente: Flickr / Creative Commons
En los pacientes con insuficiencia hepática moderada o grave se debe utilizar la dosis de 92/22 µg, y se debe vigilar a los pacientes para detectar reacciones adversas sistémicas relacionadas con el corticoesteroide. FF/VI 184/22 µg no está indicado en pacientes con EPOC. La dosis de 184/22 µg no supone ningún beneficio adicional respecto de la dosis de 92/22 µg, y existe la posibilidad de que aumente el riesgo de neumonía y de reacciones adversas sistémicas relacionadas con los corticoesteroides. Se ha observado un aumento de la incidencia de neumonía en los pacientes con EPOC tratados con FF/VI. También se ha visto un aumento de la incidencia de neumonías que llevan a un ingreso hospitalario. En algunos casos estos episodios de neumonía fueron mortales.
La incidencia de neumonía en pacientes con asma fue frecuente con la dosis mayor. En un estudio previo de FF/VI en el asma, la incidencia de neumonía en pacientes con asma que tomaban FF/VI 184/22 µg fue numéricamente superior a la observada en los pacientes tratados con FF/VI 92/22 µg o con el placebo. Hiperglucemia: Se ha descrito un aumento de la concentración de glucosa sanguínea en pacientes diabéticos, y se debe tener en consideración este hecho cuando se prescriba a pacientes con antecedentes de diabetes mellitus.
Pueden producirse efectos sistémicos con cualquier corticoesteroide inhalado, particularmente cuando se prescriben dosis elevadas durante períodos prolongados. Estos efectos tienen una probabilidad de producirse mucho menor que con los corticoesteroides orales. Los posibles efectos sistémicos incluyen síndrome de Cushing, rasgos cushingoides, supresión suprarrenal, disminución de la densidad mineral ósea, retraso del crecimiento en niños y adolescentes, cataratas y glaucoma y, con menos frecuencia, diversos efectos psicológicos o conductuales como hiperactividad psicomotriz, trastornos del sueño, ansiedad, depresión y agresividad (particularmente en niños). Se debe administrar FF/VI con precaución a pacientes con tuberculosis pulmonar y a pacientes con infecciones crónicas o no tratadas. Se utilizaron datos de extensos ensayos clínicos en asma y EPOC para determinar la frecuencia de los acontecimientos adversos asociados a FF/VI.
Posibles reacciones adversas
Las reacciones adversas muy frecuentes (que se produjeron en >1/10 pacientes) con FF/VI fueron cefalea y nasofaringitis. Las reacciones adversas frecuentes (que se produjeron en >1/100 a <1/10 pacientes) fueron neumonía, infección del tracto respiratorio superior, bronquitis, gripe, candidiasis de la boca y la garganta, dolor bucofaríngeo, sinusitis, faringitis, rinitis, tos, disfonía, dolor abdominal, artralgia, dolor de espalda, fracturas, pirexia y espasmos musculares. Se produjeron extrasístoles como reacción adversa poco frecuente (se produjeron en >1/1000 a <1/100 pacientes). Las reacciones adversas raras (que se produjeron en >1/10.000 a <1/1000) fueron reacciones de hipersensibilidad (incluyendo anafilaxia, angioedema, erupción y urticaria), ansiedad, temblor, palpitaciones, taquicardia y broncoespasmo paradójico. Con la excepción de la neumonía y las fracturas, el perfil de seguridad fue similar en pacientes con asma y EPOC. En los estudios clínicos, la neumonía y las fracturas se observaron con más frecuencia en pacientes con EPOC.
Fuente: GSK / Berbés Asociados




