Tras casi 20 años de disponibilidad de infliximab intravenoso (IFX-IV), en 2020 se aprobó en Europa la primera formulación subcutánea (SC) de IFX biosimilar, CT-P13 SC (IFX-SC), para el tratamiento de la Enfermedad Inflamatoria Intestinal (EII)1. Los resultados del ensayo clínico de fase 1, multicéntrico, abierto y aleatorizado, demostraron la no inferioridad farmacocinética de CT-P13 SC en comparación con la formulación IV, y los perfiles comparables de eficacia, seguridad e inmunogenicidad entre ambas formulaciones en pacientes con enfermedad de Crohn (EC) y colitis ulcerosa (CU). El régimen recomendado es una inducción IV de IFX en las semanas 0 y 2 a 5 mg/kg, comenzando en la semana 6 con CT-P13 SC a 120 mg cada dos semanas. El switch de CT-P13 IV a SC durante el mantenimiento debe hacerse a 120 mg cada dos semanas2.

Dra. Marisa Iborra
Fuente: Dra. Iborra
Los ensayos clínicos y los estudios en vida real han demostrado que esta formulación SC de IFX no sólo se tolera bien, sino que tiene ventajas adicionales como la facilidad de administración y la reducción de visitas al hospital y de infecciones nosocomiales, así como una reducción de los costes indirectos (absentismo laboral, transporte, etc)3. La mayoría de estudios publicados demuestran que el switch a CT-P13 SC desde IV es eficaz y seguro en pacientes con EII estable3-6, con altas tasas de persistencia, bajos niveles de inmunogenicidad y sin cambios en la actividad clínica de la enfermedad o en los biomarcadores3,4,6,7. Ya se ha descrito su uso en pacientes con refractariedad a otros biológicos y con anticuerpos frente a IFX-IV en los que administraron 4 dosis de 120 mg a intervalos semanales en la inducción y consiguieron seroconversión en más de la mitad de los pacientes (10 de 17 pacientes)8.
Recientemente se ha publicado una cohorte prospectiva comparando pacientes con EII en tratamiento de mantenimiento con IFX-IV que cambiaron a IFX-SC frente a pacientes que continúan con el fármaco IV. Los autores concluyen que el switch a IFX-SC indujo similar remisión bioquímica y curación mucosa con una mayor persistencia a 1 año que la continuación de IFX-IV en estos pacientes, mostrando una seguridad similar9.
La monitorización terapéutica de fármacos biológicos (TDM) ha surgido como una estrategia para optimizar el tratamiento en la EII y aumentar la eficacia y persistencia de los tratamientos. En este sentido, las concentraciones óptimas varían en función de los objetivos terapéuticos, el fenotipo de la enfermedad, la carga inflamatoria y el momento de la toma de la muestra durante el ciclo de tratamiento.
Por lo que respecta al tratamiento de mantenimiento con IFX-IV, las concentraciones mínimas de entre 3 y 7 µg/mL se asocian a remisión clínica, aunque para obtener resultados terapéuticos más rigurosos (endoscópicos, histológicos y curación de patrones fistulizantes agresivos) se necesitan concentraciones mayores10. Sin embargo, las concentraciones IFX-SC e IV no son directamente comparables entre ambos modos de administración debido a las diferencias en la farmacocinética. En este sentido, se ha observado un aumento de los niveles séricos de IFX entre las últimas dosis IV y las siguientes en pacientes que cambiaron de IFX-IV a IFX-SC3,4,11.
Con todo lo revisado en la literatura, realizamos un estudio observacional, multicéntrico, promovido y avalado por GETECCU (Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa), en el que participaron 10 centros de referencia en EII que incluyeron pacientes del Registro ENEIDA (Estudio Nacional en Enfermedad Inflamatoria Intestinal sobre Determinantes Genéticos y Ambientales)12 clínicamente inactivos y en tratamiento de mantenimiento con IFX-IV, a los que se les realizó el switch a IFX-SC. Investigamos en nuestro entorno y en vida real, además de los resultados clínicos, bioquímicos y farmacocinéticos tras el switch, los puntos de corte de IFX-SC en función del objetivo terapéutico y en diferentes escenarios en pacientes con EII, y los factores asociados al fracaso del switch. Incluimos un total de 220 pacientes, 74 (34%) tenían CU y 146 (66%) EC; la mayoría de ellos sólo habían llevado previamente IFX-IV y la indicación de éste fue por actividad luminal en un 73% (n=160) y por enfermedad perianal en un 12% (n=26). En el momento del switch, el 44% de pacientes llevaban inmunosupresor concomitante y el 48% (n=106) estaban con dosis de IFX-IV intensificadas (mayores de 5 mg/kg/8 semanas)13.
En nuestro estudio encontramos, coincidiendo con la literatura, que, tras el switch, se mantenía la remisión clínica y la normalización de los parámetros inflamatorios, proteína C reactiva (PCR) y calprotectina fecal (CF), y observamos un aumento significativo de los niveles de IFX (desde 5,25 μg/mL con IFX-IV a 14-15 μg/mL), los cuales se mantuvieron estables durante el año de seguimiento (Figura 1)13.
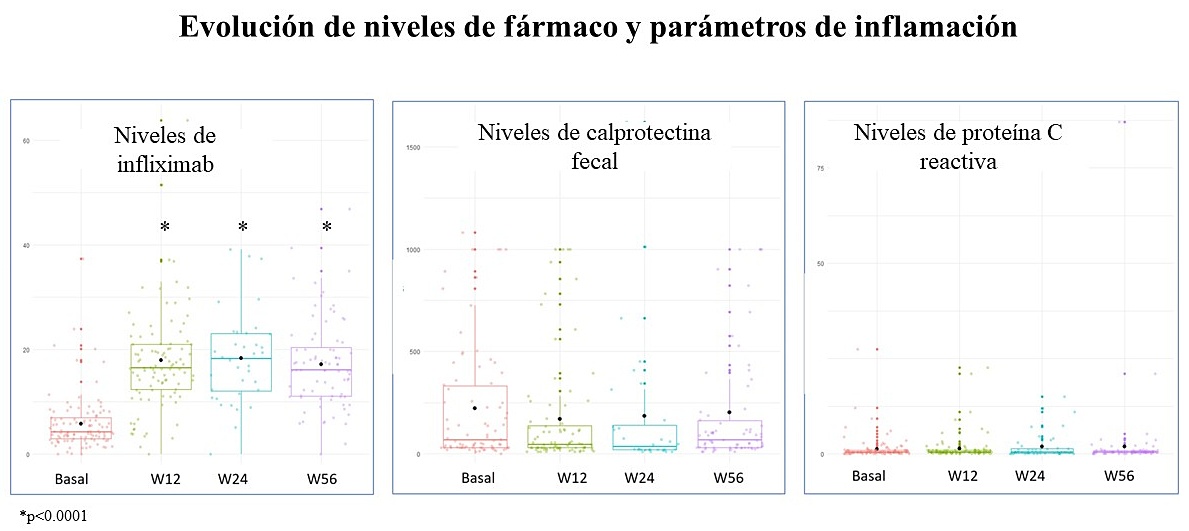
Figura 1. W: semana
Extraída de 13
De forma similar al IFX-IV, medimos los niveles de IFX-SC el día de la administración del fármaco. No obstante, se ha demostrado que el perfil de exposición sistémica estable de IFX-SC permite medir los niveles en cualquier momento durante el ciclo de tratamiento de 14 días14,15. Mientras que la formulación IV presenta un pico de concentración rápido y precoz seguido de un descenso constante hasta un mínimo, la formulación SC ofrece un perfil de tiempo de concentración en estado estacionario más estable. Sin embargo, el área bajo la curva durante un periodo de tratamiento de 8 semanas es comparable en ambas formulaciones (35.467 µg/mL frente a 28.284 µg/mL)15. La exposición constante al fármaco puede explicar el menor riesgo de desarrollo de anticuerpos durante el tratamiento SC en comparación con el IV, además de permitir que las mediciones de niveles del fármaco para el TDM sean más flexibles2,16.
En nuestra cohorte observamos que los niveles en la semana 12 de entre 8 y 14 μg/mL se asociaban a remisión clínica; niveles de 15,5 μg/mL se asociaban a remisión clínica y normalización de la PCR (<5 mg/l) y niveles de 16,6 μg/mL se asociaban a remisión profunda (remisión clínica, PCR <5 mg/l y FC <250 μg/g)13. En este sentido, un estudio transversal reciente que incluyó a 71 pacientes con EII, coincide con nosotros, ya que demostró que umbrales de concentración de IFX-SC más elevados se asociaban a la consecución de objetivos más estrictos. Así pues, niveles de 12 μg/mL se asociaban con la remisión clínica, de 16 μg/mL con la remisión clínica y de PCR <5 mg/L, y de 20 μg/mL con la remisión clínica y biológica (remisión clínica, PCR <5 mg/L y CF <250 μg/g)11. Estos resultados demuestran que, al igual que con la fórmula IV, se requiere una mayor concentración del fármaco para alcanzar objetivos terapéuticos más exigentes.
En nuestro estudio se propone por primera vez como concentración óptima para el mantenimiento con IFX-SC asociado a remisión clínica y biológica niveles de 12-13 μg/mL13. Estos hallazgos apoyan el uso de TDM proactivo y reactivo en pacientes a los que se les realiza el switch de IFX-IV a IFX-SC, a pesar de estar en remisión clínica, para mejorar los resultados.
Similar al análisis post hoc del ensayo controlado aleatorizado17, en nuestro estudio el IFX-SC utilizado en monoterapia presentó farmacocinética, eficacia, seguridad e inmunogenicidad comparables al tratamiento combinado con inmunosupresores. Cabe destacar que los pacientes que estaban con dosis estándar de IFX-IV (5 mg/kg/día) conseguían tras el switch a SC niveles de PCR y CF significativamente menores y niveles de IFX en sangre significativamente mayores que aquellos pacientes que se encontraban bajo tratamiento de mantenimiento con IFX-IV a dosis intensificada. En este sentido, el estudio REMSWITCH apunta a que en pacientes muy intensificados, a dosis de 10 mg/kg cada 4 semanas, sería recomendable el switch a IFX-SC a dosis de 240 mg cada 2 semanas o 120 mg semanal directamente, mientras que los pacientes con dosis de 10 mg/kg cada 6 semanas deberían ser estrechamente monitorizados y, en caso de no tener un incremento de niveles en semana 8 o CF en ascenso, aumentar la dosis de IFX-SC16.
Los factores que encontramos asociados con niveles más bajos de IFX-SC fueron un mayor índice de masa corporal (IMC) y niveles elevados de PCR13, en contraste con otros estudios en los que estas variables no se asociaban con los niveles séricos de IFX3,18. Sin embargo, a diferencia del IFX-IV, la enfermedad perianal no requirió unos mayores niveles del fármaco para el mantenimiento de la remisión.
En definitiva, la nueva formulación de IFX-SC ha demostrado ventajas potenciales en términos de perfil farmacocinético, eficacia, inmunogenicidad y satisfacción del paciente. Se ha calificado como bio-better debido a su exposición más estable con la consecuente disminución de inmunogenicidad8,19.
Con todo lo expuesto, parece que los escenarios ideales para indicar IFX-SC serían aquellos pacientes con EII con alto riesgo de inmunogenicidad por positividad al alelo HLA DQA1*05 o contraindicación de inmunosupresores, pacientes con necesidad de mantener IFX largos periodos por tener enfermedad perianal o manifestaciones extraintestinales, aquellos con riesgo de infecciones hospitalarias o que prefieren autoadministrarse en casa por dificultades laborales, familiares o personales, e incluso, pacientes que han experimentado pérdida de respuesta al IV y están con niveles bajos20 (Figura 2).
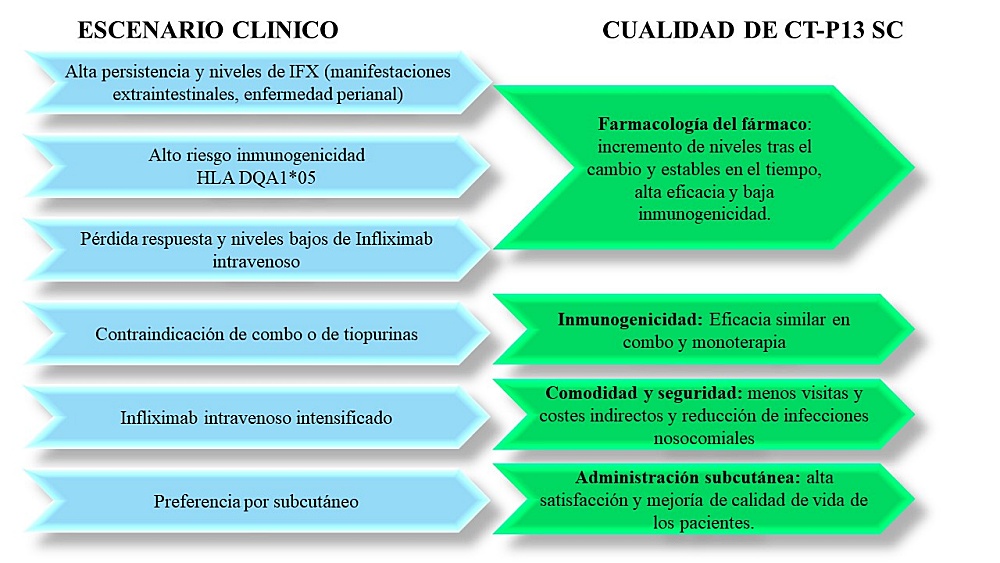
Figura 2. IFX: infliximab; HLA DQA1*05: alelo HLA DQA1*05
Elaboración propia
El switch de IFX-IV a SC-IFX a dosis de 120 mg cada 2 semanas parece ser seguro y eficaz para mantener la remisión a largo plazo en pacientes con EII, incluidos aquellos pacientes con enfermedad perianal y sin inmunosupresor concomitante. Dados los resultados de nuestro trabajo y de otras publicaciones, recomendamos que los pacientes con un régimen de IFX-IV intensificado antes del switch (probablemente dosis superiores a 10 mg/kg cada 6 semanas), IMC alto y niveles elevados de PCR (más inflamación) se considere intensificar la dosis de IFX-SC habitual porque son pacientes considerados de mayor riesgo de recaída16. Por lo tanto, sugerimos que la dosis podría aumentarse a 240 mg cada 2 semanas o 120 mg semanal en este subgrupo de pacientes. En el mantenimiento, proponemos que las concentraciones de IFX-SC permanezcan superiores a 12-13 μg/mL para asegurar el mantenimiento de la remisión profunda. Con todo lo previamente explicado, un TDM precoz con optimización de los niveles séricos del fármaco desde el inicio puede proporcionarnos un mantenimiento más duradero de la remisión.
Bibliografía
1. Parigi TL, D’Amico F, Peyrin-Biroulet L, Danese S. Evolution of infliximab biosimilar in inflammatory bowel disease: from intravenous to subcutaneous CT-P13. Expert Opinion on Biological Therapy 2021;21:37–46. https://doi.org/10.1080/14712598.2020.1811849.
2. Randomized Controlled Trial_ Subcutaneous vs Intravenous Infliximab CT-P13 Maintenance in Inflammatory Bowel Disease _ Elsevier Enhanced Reader.pdf n.d.
3. Smith PJ, Critchley L, Storey D, Gregg B, Stenson J, Kneebone A, et al. Efficacy and Safety of Elective Switching from Intravenous to Subcutaneous Infliximab [CT-P13]: A Multicentre Cohort Study. Journal of Crohn’s and Colitis 2022;16:1436–46. https://doi.org/10.1093/ecco-jcc/jjac053.
4. Huguet JM, García-Lorenzo V, Martí L, Paredes JM, Ramírez JJ, Pastor M, et al. Subcutaneous Infliximab [CT-P13], a True Biologic 2.0. Real Clinical Practice Multicentre Study. Biomedicines 2022;10:2130. https://doi.org/10.3390/biomedicines10092130.
5. Buisson A, Nachury M, Reymond M, Yzet C, Wils P, Payen L, et al. Effectiveness of Switching From Intravenous to Subcutaneous Infliximab in Patients With Inflammatory Bowel Diseases: the REMSWITCH Study. Clinical Gastroenterology and Hepatology 2023;21:2338-2346.e3. https://doi.org/10.1016/j.cgh.2022.08.011.
6. Argüelles-Arias F, Fernández Álvarez P, Castro Laria L, Maldonado Pérez MB, Belvis Jiménez M, Merino-Bohórquez V, et al. Switch to infliximab subcutaneous during SARS-CoV-2 pandemic: preliminary results. Rev Esp Enferm Dig 2021. https://doi.org/10.17235/reed.2021.8320/2021.
7. Chetwood JD, Tran Y, Subramanian S, Smith PJ, Iborra M, Buisson A, et al. Intravenous Versus Subcutaneous Infliximab in Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis. Journal of Crohn’s and Colitis 2024:jjae059. https://doi.org/10.1093/ecco-jcc/jjae059.
8. Cerna K, Duricova D, Lukas M, Kolar M, Machkova N, Hruba V, et al. Subcutaneous Infliximab in Refractory Crohn’s Disease Patients: A Possible Biobetter? Crohn’s & Colitis 360 2023;5:otad040. https://doi.org/10.1093/crocol/otad040.
9. Hong SN, Hye Song J, Jin Kim S, Ha Park Y, Wan Choi C, Eun Kim J, et al. One-Year Clinical Outcomes of Subcutaneous Infliximab Maintenance Therapy Compared With Intravenous Infliximab Maintenance Therapy in Patients With Inflammatory Bowel Disease: A Prospective Cohort Study. Inflammatory Bowel Diseases 2024;30:517–28. https://doi.org/10.1093/ibd/izad094.
10. Papamichael K, Cheifetz AS. Therapeutic drug monitoring in inflammatory bowel disease: for every patient and every drug? Current Opinion in Gastroenterology 2019;35:302–10. https://doi.org/10.1097/MOG.0000000000000536.
11. Roblin X, Nancey S, Papamichael K, Duru G, Flamand M, Kwiatek S, et al. Higher serum infliximab concentrations following subcutaneous dosing are associated with deep remission in patients with inflammatory bowel disease. Journal of Crohn’s and Colitis 2023:jjad188. https://doi.org/10.1093/ecco-jcc/jjad188.
12. Zabana Y, Panés J, Nos P, Gomollón F, Esteve M, García-Sánchez V, et al. El registro ENEIDA (Estudio Nacional en Enfermedad Inflamatoria intestinal sobre Determinantes genéticos y Ambientales) de GETECCU: diseño, monitorización y funciones. Gastroenterología y Hepatología 2020;43:551–8. https://doi.org/10.1016/j.gastrohep.2020.05.007.
13. Iborra M, Caballol B, Garrido A, Huguet JM, Mesonero F, Ponferrada A, et al. P516 Subcutaneous infliximab cut-off points in a large cohort of Spanish patients with inflammatory bowel disease and factors associated with long-term outcomes. Journal of Crohn’s and Colitis 2024;18:i1020–1. https://doi.org/10.1093/ecco-jcc/jjad212.0646.
14. Roblin X, Veyrard P, Bastide L, Berger AE, Barrau M, Paucelle A, et al. Subcutaneous injection of infliximab CT‐P13 results in stable drug levels within 14‐day treatment cycle in Crohn’s disease. Aliment Pharmacol Ther 2022;56:77–83. https://doi.org/10.1111/apt.16852.
15. Little RD, Ward MG, Wright E, Jois AJ, Boussioutas A, Hold GL, et al. Therapeutic Drug Monitoring of Subcutaneous Infliximab in Inflammatory Bowel Disease—Understanding Pharmacokinetics and Exposure Response Relationships in a New Era of Subcutaneous Biologics. JCM 2022;11:6173. https://doi.org/10.3390/jcm11206173.
16. Buisson A, Nachury M, Bazoge M, Yzet C, Wils P, Dodel M, et al. Long‐term effectiveness and acceptability of switching from intravenous to subcutaneous infliximab in patients with inflammatory bowel disease treated with intensified doses: The REMSWITCH‐LT study. Aliment Pharmacol Ther 2023:apt.17822. https://doi.org/10.1111/apt.17822.
17. D’Haens G, Reinisch W, Schreiber S, Cummings F, Irving PM, Ye BD, et al. Subcutaneous Infliximab Monotherapy Versus Combination Therapy with Immunosuppressants in Inflammatory Bowel Disease: A Post Hoc Analysis of a Randomised Clinical Trial. Clin Drug Investig 2023;43:277–88. https://doi.org/10.1007/s40261-023-01252-z.
18. Buisson A, Nachury M, Pereira B, Fumery M. Switching From Intravenous to Subcutaneous Infliximab is Safe and Feasible in Patients With Inflammatory Bowel Disease Suffering From Obesity: A Post Hoc Analysis of the REMSWITCH Study. Clinical Gastroenterology and Hepatology 2023:S1542356523007668. https://doi.org/10.1016/j.cgh.2023.09.027.
19. D’Amico F, Solitano V, Aletaha D, Hart A, Magro F, Selmi C, et al. Biobetters in patients with immune-mediated inflammatory disorders: An international Delphi consensus. Autoimmunity Reviews 2021;20:102849. https://doi.org/10.1016/j.autrev.2021.102849.
20. Alten R, An Y, Kim D-H, Yoon S, Peyrin-Biroulet L. Re-Routing Infliximab Therapy: Subcutaneous Infliximab Opens a Path Towards Greater Convenience and Clinical Benefit. Clin Drug Investig 2022;42:477–89. https://doi.org/10.1007/s40261-022-01162-6.




