1. Introducción
2. Evidencias preclínicas en candidiasis
3. Evidencias clínicas en candidiasis
a) Tratamiento
b) Prevención
c) Situaciones especiales
4. Seguridad y tolerabilidad
5. Conclusiones
6. Bibliografía
1. Introducción

Dra. Silvia P. González Rodríguez
Las inflamaciones vulvovaginales son un motivo muy frecuente de consulta en Atención Primaria, Especializada y Urgencias Hospitalarias, suponiendo hasta una quinta parte del volumen de las consultas ginecológicas en la práctica clínica diaria (1). Si bien pueden existir múltiples causas no infecciosas que ocasionen vulvovaginitis (alérgenos, irritantes, alteraciones hormonales, radioterapia…), las vulvovaginitis infecciosas son clínicamente muy relevantes por su frecuencia y sintomatología/signología asociada. Aunque existen otros patógenos que pueden causarlas, dentro de la etiología de las vulvovaginitis suelen incluirse la candidiásica, la tricomoniásica y la vaginosis bacteriana, si bien esta última no es realmente una alteración infeccioso-inflamatoria, sino más bien una disbacteriosis. A modo de recuerdo, sus características diferenciales se recogen en la Tabla 1.
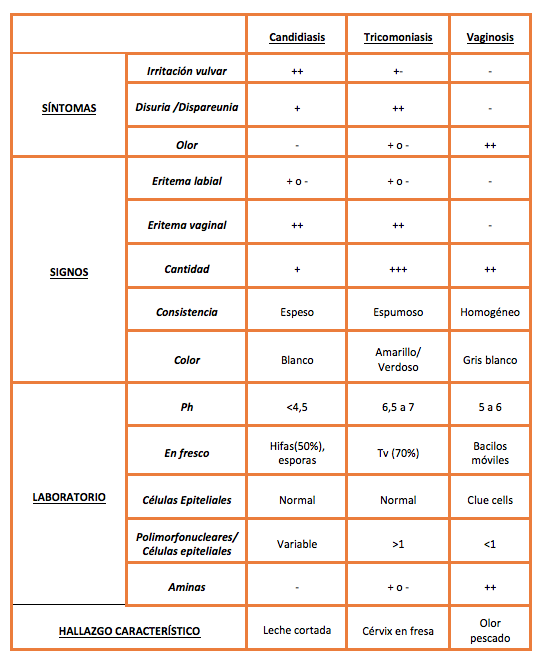
Tabla 1. Diagnóstico diferencial de las vulvovaginitis.
En Europa la entidad más prevalente y que más consultas supone en la clínica dentro del grupo de las infecciones vulvovaginales es la vulvovaginitis candidiásica (VVC), que resulta en EE.UU. la segunda causa en frecuencia después de la vaginosis bacteriana (2). La mayoría de las mismas son producidas por Candida de la especie albicans, aproximadamente 67-95%(3,4,5), aunque se han identificado más de 200 cepas del género cándida, todas con capacidad infectiva y responsables, en muchas ocasiones, de recurrencias. De esta forma, otras especies como C.glabrata, C.tropicalis, C. krusei se encuentran a veces implicadas en la etiología y son responsables frecuentes de las multirresistencias a los tratamientos.
La presentación clínica característica comprende síntomas como eritema vulvovaginal acompañado de prurito, quemazón, leucorrea blanquecina grumosa que se adhiere a las paredes vaginales, y otros síntomas, como disuria o dispareunia (Figura 1).
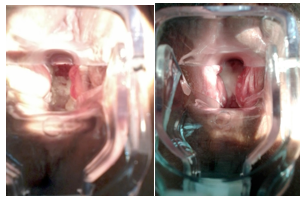
Figura 1. Imagen clínica de la vulvovaginitis candidiásica. (leucorrea característica)
A nivel práctico, puede considerarse que existen tres situaciones clínicas diferenciadas (5):
1. Portadoras asintomáticas: son aquellas mujeres que no desarrollan síntomas de VVC, pese a presentar una colonización mantenida durante largos períodos de tiempo por la levadura (suponen entre un 20 y un 25% de la población premenopáusica) (3)
2. Candidiasis episódicas: Desarrollo de episodios aislados de VVC aguda. Suponen el 75% de la población femenina y al menos el 40% desarrollará un nuevo episodio(5).
3. VVC recurrente (VVCR): Infección clínica de 4 episodios/año o más. Dentro de la misma se distinguen:
a) Reinfecciones: episodios causados por un nuevo proceso infeccioso en cada ocasión (sea por la misma o diferente especie)
b) Recidivas: ausencia de una completa erradicación de la infección inicial por un tratamiento inadecuado o resistencia de la levadura mismo (6). (Figura 2)
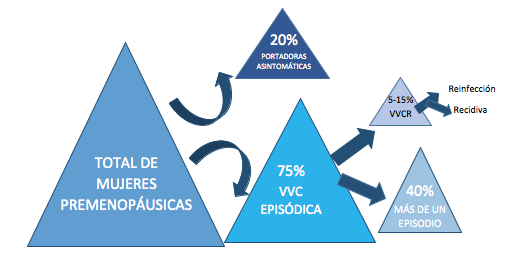
Figura 2. Situaciones clínicas posibles en relación con la VVC.
Las VVCR suponen sólo un 5-15% de las pacientes, pero constituyen un reto para los profesionales sanitarios y una alteración significativa para la calidad de vida de las mujeres (5).
Los episodios de VVC suceden muchas veces en relación con la presencia de determinados factores desencadenantes como antibioticoterapia de amplio espectro, duchas vaginales, endocrinopatías (diabetes mellitus mal controlada, alteraciones de los niveles estrogénicos, como en la gestación o el empleo de contraceptivos hormonales), inmunodepresión, etc.
Según la Sociedad Española de Ginecología y Obstetricia (SEGO), toda mujer que presente VVC sintomática debe ser tratada (1). El tratamiento habitual de la entidad lo constituyen los agentes azólicos, orales (contraindicados en gestantes) o vaginales. Sin embargo, en muchos casos existen fracasos terapéuticos. Trabajos muy recientes sugieren que esto puede ser debido a la formación de biofilms (colonias microbianas ancladas a las células superficiales en una matriz extracelular producida por ellas mismas), que las harían menos sensibles a los antifúngicos (7). Ello hace que sea necesario desarrollar nuevas estrategias terapéuticas. Respecto al empleo de probióticos en la VVC podemos subrayar que si bien en ella no hay típicamente una disminución cuantitativa de lactobacilos, sí que existe una alteración cualitativa de los mismos, de modo que las cepas más eficaces en el mantenimiento del ecosistema se encuentran descendidas en favor de otras menos adecuadas(8).
2. Evidencias preclínicas en el empleo de probióticos en VVC
Los lactobacilos constituyen la barrera defensiva más importante frente a la infección candidiásica actuando por diferentes mecanismos que han sido evidenciados en estudios in vitro (5,9,10,11), tales como competir con los hongos por los nutrientes disponibles, impedir su unión a los receptores epiteliales por bloqueo y formación de coagregados, generar sustancias (como H2O2, lactacinas y acidolinas) capaces de inhibir la germinación de micelios o potenciar la respuesta inmune (secreción de IL-8 y de IL-10 o inhibición de las citoquinas proinflamatorias, IL1 e IL6 (12) en el epitelio infectado. Todos ellos hacen que se pueda afirmar que los lactobacilos administrados sean capaces no sólo de colonizar el ecosistema vaginal (13), sino de desarrollar un importante papel en la prevención y tratamiento de la VVC.
Estas propiedades han sido demostradas para algunas cepas de Lactobacillus rhamnosus (11,14)., Lact. paracasei(15), L. brevis, L. salivarius (12), L. gasseri o L. plantarum (16). Cepas de esta última especie han demostrado también alta capacidad de adhersión al epitelio (17), inhibición del crecimiento de Candida albicans y no albicans, resistencia a antimicóticos y capacidad de supervivencia en tejido vaginal sano e inflamado. Este aspecto es altamente relevante, dado que la mayoría de los probióticos no han probado su resistencia para sobrevivir en las condiciones en que los agentes antimicrobianos (lisozima y defensinas) se encuentran incrementados en el trasudado vaginal, como puede ser el caso de las pacientes con candidasis (18).
Igualmente, las relaciones sexuales pueden afectar a los tratamientos basados en algunos agentes probióticos, al elevar el pH local. Algunas cepas han demostrado mantener su acción en un amplio rango de pH sin verse afectado por la alcalinidad del esperma (19).
3. Evidencias clínicas en el empleo de probióticos en VVC
Siendo la VVC una entidad tan relevante dentro del grupo de las vulvovaginitis y que atesora tal número de fracasos terapéuticos, resulta interesante analizar la utilidad que podrían tener los probióticos en varios escenarios terapéuticos diferentes (Tabla 2):
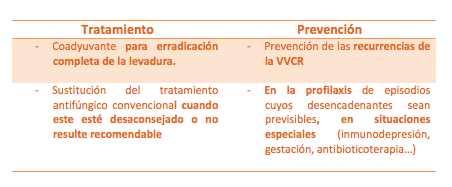
Tabla 2. Escenarios terapéuticos para el potencial uso de probióticos en VVC.
En este sentido, los estudios que han investigado los probióticos como posibles agentes para la prevención o tratamiento de la candidasis se recogen posteriormente. Si bien el número de ensayos al respecto es limitado, y existen en muchos de ellos ciertos problemas metodológicos (tamaños muestrales reducidos, ausencia de grupo placebo, inclusión de pacientes sin confirmación diagnóstica microbiológica o de VVC recurrente), en varios de ellos se evidencia que la adición de determinadas cepas lactobacilares vía oral o vaginal podría resultar beneficiosa en la profilaxis o tratamiento de los episodios cadidiásicos. La heterogeneidad de resultados posiblemente obedece a diferentes factores (Figura 3):
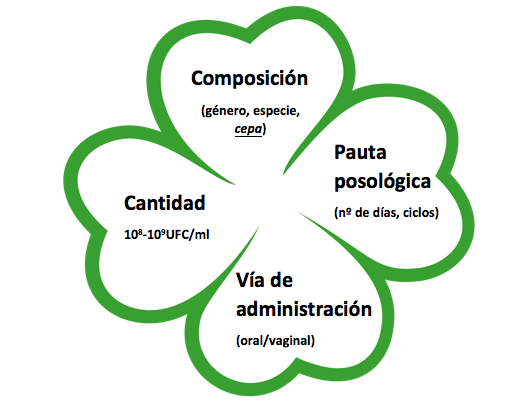
Figura 3: Factores básicos que afectan a la eficacia de los probióticos en VVC.
- De una parte, la composición del probiótico empleado: no sólo se emplean cepas diferentes (ej: Lactobacillus fermentum LN99 vs Lactobacillus fermentum LF10), sino especies diferentes (Lactobacillus plantarum vs Lactobacillus rhamnosus) e, incluso, otros géneros distintos del lactobacilar (Streptococcus(20)), Pediococcus(21)). Es muy relevante tener en cuenta el concepto cepa, siendo ésta la que determina que las acciones demostradas puedan ser muy diferentes a las observadas en otros probióticos, aunque compartan género y especie.
- De otra parte, la cantidad de probiótico: los estudios, en muchos casos, no refieren la concentración de unidades formadoras de colonias (UFC) administrada. Ha sido recientemente recomendado que para garantizar la colonización de la mucosa vaginal se empleen un mínimo de 10(8) UFC/ml de secreción vaginal o 10(9) si se trata de vía oral (22,23).
- De otra parte, la pauta posológica: el número de días, de ciclos de administración, el tiempo entre administraciones es desigual en todos los estudios.
- Por último, la vía de administración: los estudios contemplan tanto vía oral como vía vaginal. Incluso dentro de la misma vía, la forma farmacéutica tampoco es la misma (cápsulas vs. comprimidos vaginales, en algunos casos, de liberación prolongada(24)). A este respecto sí se encuentra establecido que la vía oral requiere de dosis más elevadas y pautas más prolongadas.
En cualquier caso, el análisis de la evidencia publicada ha hecho a los consensos nacionales más recientes recomendar el uso de los probióticos vaginales para la prevención de las recurrencias en CVVR, señalando su papel en la mejora de las tasas de curación cuando se emplean como coadyuvantes en VVC(1,2). La reciente guía de práctica clínica alemana (2015) señala que los resultados son prometedores, pero se necesitan estudios más exhaustivos(25).
3.a. Probióticos como coadyuvante en el tratamiento de los episodios de VVC
Todos los estudios existentes para la VVC episódica valoran el papel del probiótico como adyuvante, nunca como sustituto del tratamiento antifúngico. Si bien son menos numerosos que los existentes para VVCR, otorgan resultados generalmente positivos (Tabla 3).
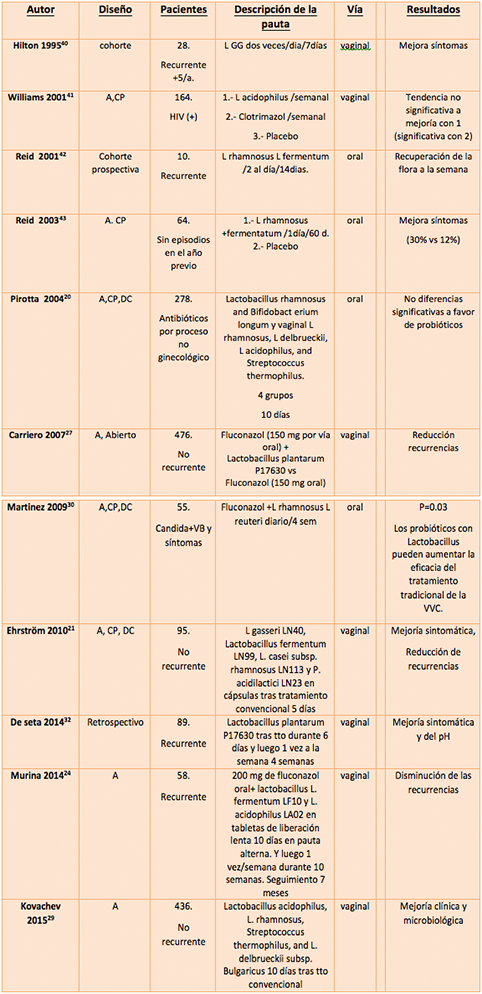
Tabla 3. Resumen de los estudios más relevantes efectuados con probióticos en VVC
A: aleatorizado, CP controlado con placebo, DC doble ciego.
1- La mayor evidencia científica es para los estudios realizados con probióticos vía vaginal. Existe un estudio muy reciente, prospectivo y abierto sobre la factibilidad y comodidad de aplicación de probiótico vaginal inmediatamente después de una VVC aguda (26). En dicho estudio las pacientes fueron tratadas con antifúngico convencional, a criterio de su ginecólogo, y posteriormente fue administrado el probiótico a base de Lactobacillus plantarum I1001 tres veces por semana a días alternos durante dos meses. A las pacientes participantes se les entregó un diario de seguimiento en el que anotar signos y síntomas de la infección. Se observaron reducciones estadísticamente significativas de la frecuencia de todos los síntomas vaginales respecto a la visita de inclusión en las semanas siguientes, alcanzándose la significación estadística para todos los parámetros al día 14 de tratamiento:
Carriero et al. (27) han llevado a cabo un estudio multicéntrico, prospectivo confrontando 252 mujeres en el grupo de estudio a las que se administró fluconazol 150 mg por vía oral más Lactobacillus plantarum P 17630 a 224 del grupo de control con tratamiento sólo con el antimicótico. Se demostró que la adición del probiótico vaginal a la toma de fluconazol oral puede aumentar la eficacia terapéutica.
Por otra parte, la eficacia de la administración de esta cepa de Lactobacillus plantarum ha sido demostrada por Nava en 2002 y Drazskdenko, en 2007 (28), quienes han comunicado alivio de la sintomatología propia de las infecciones vulvovaginales en la mayoría de las pacientes estudiadas (94%) tras seis días de tratamiento; además, la eficacia se mantenía dos semanas después. Esta mejoría se manifiesta, especialmente, en una disminución del prurito vaginal, con disminución de la sensación de escozor y el edema y un efecto beneficioso en la leucorrea y fetidez.
Un estudio muy reciente (Kovachev 2015) refrenda estos hallazgos, porque sobre 436 pacientes ratifica mayores tasas de curación clínica y microbiológica cuando se emplean probióticos (Lactobacillus acidophilus, L. rhamnosus, L. delbrueckii y Streptococcus thermophilus) vía vaginal(29).
2- Son pocos los estudios que evalúan el beneficio de los probioticos orales en la VVC episódica. Ensayos como el de Martínez et al(30) demuestran cómo el empleo de probióticos con Lactobacillus rhamnosus GR-1 y Lactobacillus reuteri RC-14 diariamente en las 4 semanas tras la administración de fluconazol produce significativamente menos leucorrea sintomática y menor número de levaduras detectables en cultivo que cuando se emplea placebo (10.3%vs 34.6%; p = 0.03 y 10.3%vs 38.5%; p = 0.014, respectivamente).
En el caso de los probióticos orales, se aconseja tomarlos en ayunas (con zumo, leche o agua) y/o por la noche, antes de acostarse y esperar al menos 2 horas después de tomar antibióticos. También se recomienda no tomar con bebidas calientes. Las bacterias deben estar rodeadas por una matriz de un polisacárido ácido estable para protegerlas de las condiciones altamente ácidas del estómago y que puedan llegar en buen estado al colon y luego colonizar vagina (2). Los probióticos vía oral requieren ser aplicados cuando se va a mantener el decúbito, generalmente, al acostarse.
Para la candidiasis episódica, los distintos ensayos clínicos aconsejan un tratamiento de entre 5 – 10 días utilizando la vía vaginal, mientras que en el caso de la vía oral, el tratamiento debería ser más prolongado(2) (15-30 días o hasta 60 para normalizar totalmente la microbiota (31)).
3.b. Probióticos en la profilaxis de las recurrencias de la VVC
Las recurrencias en VVC son frecuentes y han sido subsidiarias de tratamiento preventivo con antifúngico vaginal u oral, en dosis durante períodos variables, de hasta 6-12 meses (1). La otra alternativa es favorecer la recuperación de la microbiota vaginal con la administración de lactobacillus. El empleo de probióticos como coadyuvantes en estas pacientes ha sido investigado en numerosos estudios de calidad científica variable (escasos ensayos clínicos) y con tendencia a los resultados positivos utilizando fundamentalmente la vía vaginal (2), que se muestran también en la Tabla 3. Es a este respecto donde se están centrando las investigaciones más recientes, con resultados satisfactorios.
Se ha evaluado la eficacia de Lactobacillus plantarum P17630 como probiótico vaginal para prevenir la recurrencia de VVC, en un estudio observacional, multicéntrico, prospectivo en 476 mujeres (27). En el grupo con probiótico, la recurrencia de CVV a los 4 meses fue registrada sólo en 22 casos de los 252 en el grupo de tratamiento con lactobacilos, mientras que en el grupo control se produjo en 59 de 224: OR = 3,74 (IC 95% 2,20-6,34) y p <0,001.
Un reciente estudio retrospectivo comparativo también con L.Plantarum P17630(32) encuetra una mejor resolución subjetiva de los síntomas locales como picor o ardor (90% versus 67.5%, p<0.03) cuando se emplean probióticos en las pacientes con VVCR.
En otro estudio muy reciente (Palacios, 2015) (33) se incluyeron 55 pacientes, de las cuales 33 cumplían criterios de VVC recurrente, que fueron tratadas con Clotrimazol 500mg. Posteriormente, se administró 1 comprimido 3 días a la semana en días alternos durante 2 meses, bien de placebo, bien de Lactobacillus plantarum I1001, realizándose visitas de seguimiento tras el inicio a los 60 días y 90 días. También en el subgrupo de pacientes que cumplía criterios de VVCR, el uso de probiótico se asoció a un menor número de recidivas durante el periodo de estudio (74,2% vs 32,3%; p=0,001).
Teniendo en cuenta todo lo señalado, la SEGO sostiene que la evidencia indirecta sugiere quelos lactobacilos podrían ser una alternativa, prometedora, costo-efectiva y segura en comparación con antimicóticos en la prevención de recurrencias en población seleccionada y por dicho motivo encuentra razonable recomendar la prescripción de lactobacillus por vía vaginal en pacientes con alto riesgo de recurrencias sugiriéndose la administración durante 5-10 días y repetir el tratamiento tres meses (intra o postmenstrual)(1). El consenso de la AEEM reseña que en la actualidad no existe evidencia científica suficiente para recomendar una posología determinada en prevención(2), por lo cual, no es descartable el prolongar la administración más de 3 meses si existe éxito terapéutico y se estima que el riesgo de recurrencia sigue siendo elevado, o considerar también el uso premenstrual (Figura 4).

Figura 4. Resumen de pautas para el uso de probióticos en la VVC
3.c. Probióticos para la VVC en grupos especiales
1- Las pacientes inmunodeprimidas presentan una mayor tendencia a la colonización vaginal por cándida (30% de las pacientes (25)) y los episodios de VVC y por tanto, pueden ser un subgrupo de pacientes en las cuales resulta interesante demostrar su seguridad y eficacia. La revisión Cochrane respecto de la prevención y tratamiento de la VVC en pacientes VIH+ de 2011 no encuentra resultados definitivos de la eficacia de los probióticos (tampoco de antifúngicos) en estas pacientes, si bien señala que la tendencia de los resultados indicaría que el empleo de cotrimazol y de probióticos podría ser eficaz en comparación con el placebo (34).
2- La microbiota habitual de la mujer puede resultar seriamente afectada con la ingesta de antibióticos de amplio espectro, dado que muchas de las especies que la componen se ven arrasadas al no ser resistentes a antibioticoterapia. De esta forma, repoblar de lactobacilos la cavidad vaginal podría ser teóricamente eficaz como profilaxis de un episodio candidiásico tras tratamiento antibiótico por una cistitis, otitis, faringitis, etc. Sin embargo, existen muy escasos estudios al respecto que además, no consiguen demostrar la utilidad de esta aplicación (35,36,37). El más destacable es el ensayo aleatorizado de Pirotta (2004) (20), que empleó probióticos orales, vaginales o ambos durante todo el tiempo del tratamiento antibiótico y hasta 4 días más tarde, pero no encontró diferencias significativas en la aparición de candidiasis entre los grupos. Dado que fiopatológicamente es sabido que la flora lactobacilar no se encuentra cuantitativa sino cualitativamente alterada en la VVC, es posible que las cepas seleccionadas para los estudios no hayan sido las óptimas o simplemente, no fueran resistentes al tratamiento antibiótico empleado. Serán necesarios estudios posteriores para esclarecer esta potencial indicación.
3- Durante la gestación se produce cierta inmunosupresión, caracterizada por la disminución de la concentración de la inmunoglobulina G y los linfocitos T colaboradores circulantes y el aumento de los linfocitos T supresores. Esto ocurre para evitar el rechazo del embrión, que expresará antígenos paternos y, por tanto, extraños para el sistema inmune materno. Este efecto se ve compensado por el incremento de los mecanismos de defensa inespecíficos y la disminución del pH vaginal, debido al engrosamiento del epitelio, que segrega más glucógeno, lo que va a provocar un incremento en la concentración de lactobacilos y de la acidez que producen, sobre todo durante el tercer trimestre del embarazo. A esto habría que añadir que la ausencia de flujo menstrual evitaría la elevación periódica del pH y el barrido de la microbiota residente. Esto supone un mecanismo defensivo contra muchas infecciones, pero no sobre la VVC. De hecho, el porcentaje de portadoras asintomáticas de candida se eleva en la gestación hasta el 30%(25). No existen estudios selectivos sobre el uso de probióticos en relación a la prevención o tratamiento de la VVC en la gestación, pero sí disponemos al menos de datos de seguridad respecto del uso de probióticos en ella(38).
4. Seguridad y tolerabilidad
La seguridad y tolerabilidad de los probióticos es un aspecto muy relevante a tener en cuenta en la práctica clínica dado que una de sus principales ventajas que justifica su empleo por largos periodos de tiempo o en ciclos repetidos es la ausencia de efectos adversos en las usuarias.
Los test in vitro e in vivo (test de Hipersensibilidad retardada, Test de Citotoxicidad) han demostrado que los probióticos pueden ser considerados como no irritantes para la mucosa.
Igualmente, los estudios efectuados reflejan que hasta para el 93,6% de las usuarias la tolerabilidad de estos productos fue buena/muy buena(39).
Los escasos efectos locales descritos pueden incluir algo de disconfort local al aplicar o leucorrea posterior.
Solo se reconocen como contraindicaciones de uso de probióticos en la actualidad(2):
- Pacientes inmunocomprometidos severos.
- Patologías multisistémicas graves
5. Conclusiones
▪ De todo lo mencionado anteriormente es fácilmente deducible que el empleo de probióticos, especialmente vaginales, representa una herramienta farmacológica muy útil como coadyuvante en el tratamiento o la prevención de la vulvovaginitis candidiásica tanto aislada como recurrente.
▪ Aquellos probióticos que presenten determinadas características, como elevada capacidad de adhesión al epitelio vaginal, mayor capacidad de inhibir la germinación de micelios, mejor modulación de la respuesta inmune, resistencia a antimicóticos y capacidad de supervivencia en tejido vaginal inflamado resultarán óptimos en esta indicación.
▪ Los consensos nacionales más recientes señalan la utilidad de los probióticos en las pacientes que sufren VVC, en pautas de entre 5 y 10 días de tratamiento para la vía vaginal y más prolongadas para el uso oral, pudiendo repetirse para la profilaxis de recurrencias durante al menos 3 meses.
▪ La tolerabilidad y seguridad de los probióticos es óptima, con prácticamente ausencia de contraindicaciones de uso.
6. Bibliografía
1. Diagnóstico y tratamiento de las infecciones vulvovaginales. Sociedad Española de Ginecología y Obstetricia. Protocolo actualizado en 2012. Editado por Editorial Equium S.L.
2. Beltrán Vaquero, D.A., Guerra Guirao, J.A.. Consenso en probióticos vaginales. AEEM. Ed: EDIMSA.2012.
3. Sobel JD et al. Vulvovaginal candidiasis: epidemiologic, diagnostic, and therapeutic considerations. Am J Obstet Gynecol 1998 Feb; 178 (2) 203-11
4. Issler JR. Infecciones del tracto genital inferior. Rev. Postgrado Cátedra Vía Medicina nº 102 Marzo 2001 pág 21-38
5. Barrenetxea G. Vulvovaginitis Candidiásica. Rev. Iberoam Micol 2002; 19: 22-24
6. Gonzalez SP. Retrato de un probiótico. La visión del clínico en Ginecología. Edimsa. 2010
7. Muzny CA, Schwebke JR. Biofilms: An Underappreciated Mechanism of Treatment Failure and Recurrence in Vaginal Infections. Clin Infect Dis. 2015 May 1. pii: civ353.
8. Falagas ME, Betsi GI, Athanasiou S. Probiotics for prevention of recurrent vulvovaginal candidiasis: a review. J Antimicrob Chemother. 2006 Aug;58(2):266-72
9. Reid G, Dols J, Miller W. Targeting the vaginal microbiota with probiotics as a means to counteract infections.Curr Opin Clin Nutr Metab Care. 2009 Nov;12(6):583-7
10. Ogunshe AA, Omotoso MA, Bello VB.The in vitro antimicrobial activities of metabolites from lactobacillus strains on Candida species implicated in Candida vaginitis. Malays J Med Sci. 2011 Oct;18(4):13-25.
11. Martinez RC, Seney SL, Summers KL, Nomizo A, De Martinis EC, Reid G. Effect of Lactobacillus rhamnosus GR-1 and Lactobacillus reuteri RC-14 on the ability of Candida albicans to infect cells and induce inflammation. Microbiol Immunol 2009 Sep;53(9):487-95.
12. Hemalatha R, Mastromarino P, Ramalaxmi BA, Balakrishna NV, Sesikeran B Effectiveness of vaginal tablets containing lactobacilli versus pH tablets on vaginal health and inflammatory cytokines: a randomized, double-blind study. Eur J Clin Microbiol Infect Dis. 2012 Nov;31(11):3097-105
13. Jeavons HS.J Prevention and treatment of vulvovaginal candidiasis using exogenous Lactobacillus.Obstet Gynecol Neonatal Nurs. 2003 May-Jun;32(3):287-96.
14. Coudeyras S et al. Adhesion of human probiotic lactobacillus rhamnosus to cervical and vaginal cells and interaction with vaginosis-associated pathogen. Infect Dis Obstet Gynecol 2008.
15. Verdenelli MC, Coman MM, Cecchini C, Silvi S, Orpianesi C, Cresci A.Evaluation of antipathogenic activity and adherence properties of human Lactobacillus strains for vaginalformulations. J Appl Microbiol. 2014 May;116(5):1297-307.
16. Bonetti A, Morelli L, Campominosi E, Ganora E, Sforza F. Adherence of Lactobacillus plantarum P 17630 in soft-gel capsule formulation versus Doderlein's bacillus in tablet formulation to vaginal epithelial cells. Minerva Ginecol 2003 Jun;55(3):279-7.
17. Culici M, Braga PC. Adhesion of Lactobacillus plantarum P 17630 to vaginal epithelial cells and its influence on Candida albicans adhesion. GIMMOC 2004.
18. González SP. Revisión de la eficacia y seguridad de un probiótico vaginal a base de la cepa Lactobacillus plantarum 1001 en salud vaginal. (en prensa)
19. Dho G, Marchese A. Microbiological characteristics of Lactobacillus plantarum P17630 contined in vaginal suppositories. GIMMOC. 2003; VII (2).
20. Pirotta M, Gunn J, Chondros P, Grover S, O'Malley P, Hurley S, Garland S.Effect of lactobacillus in preventing post-antibiotic vulvovaginal candidiasis: a randomised controlled trial. BMJ. 2004 Sep 4;329(7465):548. Epub 2004 Aug 27.
21. Ehrström S, Daroczy K, Rylander E, Samuelsson C, Johannesson U, Anzén B, Påhlson C.Lactic acid bacteria colonization and clinical outcome after probiotic supplementation in conventionally treated bacterial vaginosis and vulvovaginal candidiasis.Microbes Infect. 2010 Sep;12(10):691-9
22. Hajela ND, Nair GD, Abraham PD, Ganguly NP. Health impact of probiotics - vision and opportunities. Gut Pathog 2012 Mar 12;4(1):1.
23. Khani S, Hosseini HM, Taheri M, Nourani MR, Imani Fooladi AA, Probiotics as an Alternative Strategy for Prevention and Treatment of Human Diseases: A Review. Inflamm Allergy Drug Targets. 2012 Apr; 11(2):79-89
24. Murina F, Graziottin A, Vicariotto F, De Seta F.Can Lactobacillus fermentum LF10 and Lactobacillus acidophilus LA02 in a slow-release vaginal product be useful for prevention of recurrent vulvovaginal candidiasis?: A clinical study. J Clin Gastroenterol. 2014 Nov-Dec;48 Suppl 1:S102-5
25. Mendling W Guideline: Vulvovaginal Candidosis (AWMF 015/072), S2k (excluding chronic mucocutaneous candidosis). Mycoses. 2015 Mar;58 Suppl 1:1-15.
26. Palacios S. et al (2015) “Estudio piloto sobre la factibilidad y comodidad en la aplicación de un probiótico vaginal inmediatamente después de una infección vulvovaginal aguda por cándida”. Data on file (GYLAC022012).
27. Carriero C, Lezzi V, Mancini T, Selvaggi L. Vaginal capsules of Lactobacillus plantarum P17630 fo prevention of relapse of candida vulvovaginitis: an italian multicentre observational study. Int J Probiotics & Precbiotics 2007; 2:155-62.
28. Drazskdenko V. Effectiveness and tolerability of Lactobacillus plantarum P 17630 in vaginal soft-gel capsule formulation in women with vaginal infection caused by different pathogens. 2007 (data on file).
29. Kovachev SM, Vatcheva-Dobrevska RS.Local Probiotic Therapy for Vaginal Candida albicans Infections. Probiotics Antimicrob Proteins. 2015 Mar;7(1):38-44.
30. Martinez RC, Franceschini SA, Patta MC, Quintana SM, Candido RC, Ferreira JC, De Martinis EC, Reid G. Improved treatment of vulvovaginal candidiasis with fluconazole plus probiotic Lactobacillus rhamnosus GR-1 and Lactobacillus reuteri RC-14. Lett Appl Microbiol. 2009 Mar; 48(3): 269-74.
31. Homayouni A1, Bastani P, Ziyadi S, Mohammad-Alizadeh-Charandabi S, Ghalibaf M, Mortazavian AM, Mehrabany EV.Effects of probiotics on the recurrence of bacterial vaginosis: a review. J Low Genit Tract Dis. 2014 Jan;18(1):79-86
32. De Seta F, Parazzini F, De Leo R, Banco R, Maso GP, De Santo D, Sartore A, Stabile G, Inglese S, Tonon M, Restaino 3.Lactobacillus plantarum P17630 for preventing Candida vaginitis recurrence: a retrospective comparative study. Eur J Obstet Gynecol Reprod Biol. 2014 Nov;182:136-9
33. Palacios S, Salas N, Fernández-Moya JM, Bajona M, Prieto C. Lactobacillus plantarum I1001 en la prevención de la candidiasis vulvovaginal recurrente. Aceptado como póster en el XXXIII Congreso Nacional de la Sociedad Española de Ginecología y Obstetricia, Bilbao, 16-20 Junio de 2015.
34. Ray A, Ray S, George AT, Swaminathan N.Interventions for prevention and treatment of vulvovaginal candidiasis in women with HIV infection. Cochrane Database Syst Rev. 2011 Aug 10;(8):CD008739.
35. Sobel JD.Does lactobacillus prevent post-antibiotic vulvovaginal candidiasis? Curr Infect Dis Rep. 2005
36. Ainsworth J, Nail M, Fox A.Question: In females being treated with antibiotics, is probiotic use effective in reducing the incidence of vulvovaginal candidiasis? Nov;7(6):443-4.J Okla State Med Assoc. 2012 Sep;105(9):349-50.
37. Bern VH. [New study shows probiotics ineffective in prevention of post-antibiotic vaginal candidiasis]. [Article in German] Praxis (Bern 1994). 2004 Oct 27;93(44):1 p following 1843 Praxis (Bern 1994). 2004 Oct 27;93(44):1 p following 1843
38. Griffin C.Probiotics in obstetrics and gynaecology.Aust N Z J Obstet Gynaecol. 2015 Jun 5.
39. Andreu A. et al (2012) “Valoración de la capacidad de colonización y de la tolerabilidad de comprimidos vaginales de Lactobacillus plantarum I1001 con el fin de determinar su pauta posológica”. Documentación interna (GYLAC012011).




