Dr. Juan Ramón Malagelada Benaprés
La proporción de individuos de edad avanzada aumenta en la mayor parte de los países del mundo. La combinación del incremento progresivo de la longevidad y de la incidencia de Enfermedad Inflamatoria Intestinal (EII) que se observa globalmente, implica que un número cada vez mayor de individuos con EII corresponde al segmento de edad superior a 60 años[1,2]. Este grupo de pacientes con EII y edad avanzada comprende tanto pacientes que desarrollaron la enfermedad en edades más tempranas y continúan con brotes de actividad y/o farmacoterapia preventiva, como otros que desarrollan manifestaciones clínicas por primera vez en épocas tardías de la vida. El objetivo de este comentario es describir las características específicas de la EII en pacientes mayores de 60 años (que es la edad comúnmente aceptada para definir presentación tardía) y los aspectos que inciden en el tratamiento correcto de su patología.
En pacientes mayores, el diagnóstico diferencial de la EII incluye patologías propias de dicho segmento de edad como son la colitis isquémica, la diverticulitis y el sangrado diverticular, la colitis diverticular que puede confundirse especialmente con la enfermedad de Crohn[3,4], la colitis post- radiación y la colitis por uso crónico de antiinflamatorios no esteroideos.

Dr. Juan Ramón Malagelada Benaprés
Fuente: Dr. Malagelada Benaprés
Los pacientes de edad avanzada con EII requieren hospitalización con mayor frecuencia que los pacientes jóvenes[5] y durante su hospitalización son más propensos a complicaciones graves[6]. Es importante destacar que los estudios clínicos controlados con nuevos fármacos tienden a excluir pacientes de edad avanzada, por lo que los datos disponibles de eficacia y seguridad de los fármacos en dichos estudios son aplicables necesariamente[7].
La presentación clínica de la EII en mayores de 60 años es, en general, similar a los jóvenes pero con matices. La colitis ulcerosa puede manifestarse de forma intensa y brusca, pero a menudo es más sutil con escasa diarrea, rectorragia y dolor abdominal. La inflamación tiende a localizarse en colon izquierdo y recto, lo que suscita un diagnóstico diferencial más selectivo[8,9]. En estos pacientes mayores la colitis tiende a permanecer estable y sólo en un 16% se extiende proximalmente[10]. Sin embargo, la actividad crónica o recidiva con patrón agresivo no es infrecuente[11]. En la enfermedad de Crohn predominan las formas inflamatorias con menos fistulización o estenosis[(8,12,13] y la localización preferente es el íleon distal[14] en contraposición a los pacientes más jóvenes, que es íleo-colónica[15].
Las manifestaciones extraintestinales de la EII tienden a ser menos frecuentes a partir de los 60 años (4.9%) que en menores de 17 años (23.5%)[16].
Tratamiento
Consideraciones generales
La inmunidad innata decrece con la edad y la malnutrición. Por otra parte, la edad avanzada predispone a inflamación tisular crónica de baja intensidad. Ambas características del perfil inmunológico interaccionan en este grupo de pacientes mayores de 65 años en los que, no obstante, la EII tiende a ser poco progresiva[7,8,17,18].
La polifarmacia es común en ancianos y además estas personas suelen ser inconstantes en la toma de medicamentos[19]. El cumplimiento oscila entre el 40-60% en diversos estudios, por lo que en general es preferible concentrar la toma de fármacos una vez al día. Al mismo tiempo, algunos de los fármacos utilizados para el tratamiento de la EII en mayores conllevan riesgos adicionales en este grupo de edad. Por ejemplo, el tratamiento inmunosupresor en la persona mayor aumenta el riesgo de infecciones oportunistas y quizás tumores malignos. Por lo tanto, la EII en el anciano requiere unos planteamientos específicos y en algunos aspectos claramente diferenciados de los pacientes más jóvenes con la misma patología[20]. La psicopatología es un factor agravante a tener en cuenta[21]. A pesar[22] de todos estos factores concomitantes, la EII en edad avanzada no implica una disminución de la calidad de vida en comparación con pacientes más jóvenes si está controlada adecuadamente[23].

Autor/a: Bruno Martins
Fuente: Unsplash.com (free photo)
Aminosalicilatos
Constituyen el primer nivel farmacoterapéutico en la colitis ulcerosa y posiblemente son también eficaces en la colitis granulomatosa. La combinación de aplicación oral y tópica es más efectiva en la afectación baja, frecuente en los mayores. Sin embargo, en ancianos los enemas corticoides con espuma suelen ser mejor tolerados que los enemas líquidos de 5-ASA por problemas de incontinencia.
La nefrotoxicidad con nefritis intestinal es rara e idiosincrática[24], por lo que no debemos anticiparla en función de la edad avanzada. Por otra parte, la interacción farmacológica es relevante con diversos fármacos y, por ejemplo, la 5-ASA puede potenciar los efectos cumarínicos[25].
Esteroides
Son efectivos a corto plazo para inducir remisión en brote resistente a 5-ASA o en la fase inicial del tratamiento de la enfermedad de Crohn. Los ancianos son más susceptibles que los jóvenes a los efectos secundarios de los corticoides incluyendo diabetes, hipertensión, osteoporosis, y glaucoma a largo plazo[26]. Por consiguiente, es importante evitar tratamientos prolongados y en todo caso conviene prevenir efectos secundarios frecuentes como la osteoporosis.
En ancianos, los esteroides pueden producir alteraciones del estado mental, inducir retención de líquidos y descompensar parámetros metabólicos[26]. También pueden potenciar el glaucoma e interaccionar con otros fármacos incluidos anticoagulantes cumarínicos[25,27]. No sorprende, pues, que en algunas series la utilización de esteroides e inmunosupresores sea más restringida en ancianos, particularmente mayores de 70 años, que en jóvenes[28].
Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Corticoides de acción predominante (no exclusiva) tópica se han introducido y aplicado con mayor frecuencia en épocas recientes y son de elección en el anciano con EII. La budesonida en cápsula entérica está indicada en la enfermedad de Crohn ileo-colónica derecha con menores efectos secundarios óseos que los esteroides convencionales[29]. Recientemente se ha comercializado una preparación de liberación retardada para la colitis ulcerosa extensa[29].
La beclometasona es un fármaco esteroide que se modifica por la acción bacteriana en el colon convirtiéndose en la molécula activa. Es eficaz en el tratamiento de la colitis ulcerosa extensa. Similar a la budesonida, los efectos sistémicos son reducidos aunque, en principio, este tipo de medicaciones no está concebida para uso prolongado.
Inmunomoduladores
Su utilización en ancianos requiere consideraciones especiales. En principio pueden introducirse por falta de efectividad del 5-ASA o para evitar prolongar el uso de corticosteroides.
Las tiopurinas (azatioprina o 6-mercaptopurina) están indicadas para mantener la remisión en colitis ulcerosa o enfermedad de Crohn una vez alcanzada la remisión total o parcial con el uso de esteroides. El metotrexato intramuscular está indicado con objetivo similar en la enfermedad de Crohn. La eficacia de estos agentes -tiopurinas y metotrexato- es probablemente similar en jóvenes y en ancianos, pero en edad avanzada existe una mayor prevención a utilizarlos[11] por temor a la trascendencia en este grupo de edad a efectos secundarios que incluyen reacciones idiosincráticas (fiebre, pancreatitis y hepatitis)[30] o leucopenia. Esta última guarda cierta correlación con los niveles del enzima TPMT que determina la capacidad de metabolización del fármaco. La deficiencia de TPMT puede agravar la depresión medular con el riesgo consecuente de infección, cuya susceptibilidad es superior en el anciano. A efectos prácticos la determinación del nivel de TPMT en sangre puede utilizarse para identificar baja capacidad de metabolización de las tiopurinas, lo cual incrementa el riesgo de toxicidad aunque la proporcionalidad no es absoluta[31,32].
El alopurinol incrementa los niveles y riesgos de depresión medular por tiopurinas pero al mismo tiempo puede ser útil, con reducción proporcional de dosis, para prevenir la hepatotoxicidad en pacientes que manifiestan alteraciones enzimáticas[33].
El uso prolongado de tiopurinas puede incrementar el riesgo de linfoma y este efecto parece más probable en individuos mayores de 60 años[34]. Las tiopurinas incrementan el riesgo de cáncer cutáneo no melanoma[35].
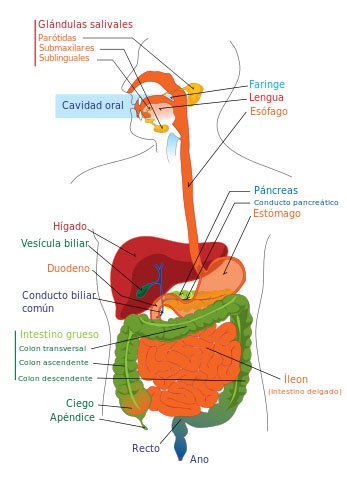
Autor/a: Mariana Ruiz (English version); User:Bibi Saint-Pol, Jmarchn (Spanish version, translation by User:AlvaroRG) - Own work; translated from Image:Digestive system diagram en.svg
Fuente: Wikipedia
Metotrexato
Útil en el tratamiento de la enfermedad de Crohn, especialmente por vía parenteral. La eficacia es similar en jóvenes y ancianos pero debe tenerse en cuenta que la excreción biliar y renal del fármaco disminuye con la edad, incrementando la probabilidad de efectos secundarios gastrointestinales y hepatológicos. La suplementación con ácido fólico es útil para reducir efectos secundarios molestos[36]. El metotrexato aparentemente no incrementa el riesgo de linfoma[37].
Tratamientos biológicos
Agentes anti-TNF han demostrado su eficacia en el tratamiento de la EII, eficacia que se manifiesta en la relativamente alta probabilidad de inducción de remisión, acortamiento de hospitalización, disminución de la necesidad de cirugía e incremento de calidad de vida.
Algunos estudios demuestran que los anti-TNF son igual de eficaces en jóvenes y ancianos[38,39], mientras que otros datos sugieren una menor eficacia en el anciano[40].
Es probable que los anti-TNF se infrautilicen en ancianos por la preocupación que, con respecto a los efectos secundarios, muestran algunos médicos con poca experiencia con estas relativamente nuevas medicaciones. Quizás por la misma razón, la duración del tratamiento con anti-TNF tiende a ser más corta que en los jóvenes[40].
Ciertamente, los efectos secundarios importantes y mortalidad parecen mayores en ancianos porque la edad comporta un riesgo claramente superior a contraer infecciones graves[41,42].
La terapéutica convencional con anti-TNF probablemente incrementa la probabilidad de desarrollar neoplasia a largo plazo (particularmente linfoma y melanoma cutáneo). Otras series no demuestran un riesgo de neoplasia incrementado por el tratamiento anti-TNF[43]. Dado que en muchos estudios se incluye un porcentaje de pacientes tratados simultáneamente con inmunosupresores convencionales, el riesgo que conlleva el tratamiento exclusivo con anti-TNF es todavía impreciso en sus situaciones[37]. En todo caso, estos aspectos oncológicos son particularmente relevantes en el anciano, que en función de su edad tiene un riesgo incrementado de generación de tumores.
El empeoramiento de insuficiencia cardíaca congestiva, una patología común en el anciano, es otra potencial complicación del tratamiento anti-TNF relevante en el sector de mayor edad. Asimismo, otras secuelas potenciales como reacciones a la infusión del fármaco, psoriasis y desmielinización del tejido cerebral deben tenerse en cuenta[44,45]. Sin embargo, todos estos riesgos adicionales en el anciano en principio no deberían contraindicar su uso terapéutico.

Autor/a: NEC Corporation of America (with Creative Commons license)
Fuente: Flickr / Creative Commons
Anti-integrinas
Vedolizumab. Es una anti-integrina α4β7 que inhibe la translocación linfocítica al tejido intestinal. Los riesgos de efectos secundarios en ancianos no han sido establecidos claramente, pero no parecen ser superiores a los pacientes jóvenes. Sin embargo, las series publicadas incorporan un número reducido de pacientes mayores de 60 años. Las complicaciones más frecuentes fueron neumonía, enteropatía por clostridium difficile y síntomas pseudo-gripales[46].
Ustekinumab. Es un anti-IL12/23 p40 que interfiere con la diferenciación de linfocitos indiferenciados en formas proinflamatorias. El uso de ustekinumab en 46 pacientes psoriásicos de 65 años y mayores no produjo un aumento significativo de efectos adversos al año[47,48]. Sin embargo, no hay experiencia bien controlada en la enfermedad de Crohn.
Cirugía
La EII conlleva un riesgo de cirugía por falta de respuesta suficiente al tratamiento farmacológico y/o complicaciones. La necesidad de cirugía puede sobrevenir tanto en la colitis ulcerosa como en la enfermedad de Crohn. La morbilidad y mortalidad asociada a la cirugía han disminuido sustancialmente en las últimas décadas pero siguen siendo significativas. Actualmente no existen diferencias aparentes en el riesgo de precisar cirugía entre jóvenes y mayores con EII[8,49], pero este dato es más relevante en la enfermedad de Crohn que en la colitis ulcerosa porque, en general, el curso de esta última en ancianos es menos agresivo y por tanto es menos probable que se requiera colectomía. Por otra parte, en los mayores es más probable la necesidad de cirugía por complicaciones graves como cáncer colorrectal, displasia o infección resistente por clostridium difficile. También, en personas mayores cabe esperar una mayor frecuencia de complicaciones postoperatorias. Por ejemplo, en la serie publicada por Sacleux et al[50] un tercio de los ancianos operados padecieron como mínimo una complicación y la mitad de éstas fueron infecciones graves.

Mangos de bisturís quirúrgicos
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com / Gentileza del Hospital Sagrat Cor de Barcelona
La colectomía con reservorio ileal y anastomosis entero-anal es la cirugía más usual en pacientes con colitis ulcerosa grave. Si no hay incontinencia anal preexistente[51], la edad en principio no es factor de exclusión para este tipo de cirugía. Sin embargo, es cierto que la función del reservorio tiende a deteriorarse más rápidamente en los ancianos por la aparición o agravación de incontinencia[52]. Los trastornos cognitivos y enfermedad neurológica asociada a la edad también deben tenerse en cuenta al evaluar la opción quirúrgica. En principio, sólo deben intervenirse pacientes de edad avanzada con buenas perspectivas de retornar a una vida autónoma y satisfactoria.
Degeneración maligna intestinal en la EII
Pacientes con colitis subtotal o pancolitis tienen un riesgo elevado de presentar displasia y desarrollar cáncer colorrectal[53]. Factores que incrementan esta probabilidad incluyen la duración de la enfermedad (a partir de los 8-10 años del diagnóstico), la intensidad y persistencia de inflamación, la historia familiar y una concomitante colangitis esclerosante[53].
En los mayores, la vigilancia preventiva debe aplicarse en principio con los mismos criterios que en los jóvenes pero conviene diferenciar entre pacientes cuya enfermedad se ha desarrollado en edad avanzada (60 años) y aquellos en los que la enfermedad comenzó siendo más jóvenes, en los que el riesgo degenerativo es más elevado[53,54]. Por el contrario, los pacientes que desarrollan la enfermedad a partir de los 60 años parecen tener un menor riesgo de desarrollar cáncer colorrectal (similar a la población general).
La indicación de vigilancia colonoscópica periódica con objetivo preventivo en pacientes ancianos debe restringirse a aquellos cuyos riesgos quirúrgicos no son desproporcionados y con expectativa de vida activa ulterior[55]. Además, el riesgo de perforación durante colonoscopia es mayor en ancianos con EII[56,57].
Referencias
1. Cosnes J, Gower-Rousseau C, Seksik P, Cortot A. Epidemiology and natural history of inflammatory bowel diseases. Gastroenterology. 2011;140(6):1785-94.
2. Molinie F, Gower-Rousseau C, Yzet T, Merle V, Grandbastien B, Marti R, et al. Opposite evolution in incidence of Crohn's disease and ulcerative colitis in Northern France (1988-1999). Gut. 2004;53(6):843-8.
3. Peppercorn MA. Drug-responsive chronic segmental colitis associated with diverticula: a clinical syndrome in the elderly. Am J Gastroenterol. 1992;87(5):609-12.
4. Hadithi M, Cazemier M, Meijer GA, Bloemena E, Felt-Bersma RJ, Mulder CJ, et al. Retrospective analysis of old-age colitis in the Dutch inflammatory bowel disease population. World J Gastroenterol. 2008;14(20):3183-7.
5. Komoto S, Higashiyama M, Watanabe C, Suzuki Y, Watanabe M, Hibi T, et al. Clinical differences between elderly-onset ulcerative colitis and non-elderly-onset ulcerative colitis: A nationwide survey data in Japan. J Gastroenterol Hepatol. 2018;33(11):1839-43.
6. Ananthakrishnan AN, Binion DG. Treatment of ulcerative colitis in the elderly. Dig Dis. 2009;27(3):327-34.
7. Charpentier C, Salleron J, Savoye G, Fumery M, Merle V, Laberenne JE, et al. Natural history of elderly-onset inflammatory bowel disease: a population-based cohort study. Gut. 2014;63(3):423-32.
8. Lakatos PL, David G, Pandur T, Erdelyi Z, Mester G, Balogh M, et al. IBD in the elderly population: results from a population-based study in Western Hungary, 1977-2008. J Crohns Colitis. 2011;5(1):5-13.
9. del Val JH. Old-age inflammatory bowel disease onset: a different problem? World J Gastroenterol. 2011;17(22):2734-9.
10. Gower-Rousseau C, Vasseur F, Fumery M, Savoye G, Salleron J, Dauchet L, et al. Epidemiology of inflammatory bowel diseases: new insights from a French population-based registry (EPIMAD). Dig Liver Dis. 2013;45(2):89-94.
11. Fries W, Viola A, Manetti N, Frankovic I, Pugliese D, Monterubbianesi R, et al. Disease patterns in late-onset ulcerative colitis: Results from the IG-IBD "AGED study". Dig Liver Dis. 2017;49(1):17-23.
12. Harper PC, McAuliffe TL, Beeken WL. Crohn's disease in the elderly. A statistical comparison with younger patients matched for sex and duration of disease. Arch Intern Med. 1986;146(4):753-5.
13. Greth J, Torok HP, Koenig A, Folwaczny C. Comparison of inflammatory bowel disease at younger and older age. Eur J Med Res. 2004;9(12):552-4.
14. Song EM, Kim N, Lee SH, Chang K, Hwang SW, Park SH, et al. Clinical characteristics and long-term prognosis of elderly-onset Crohn's disease. Scand J Gastroenterol. 2018;53(4):417-25.
15. Afzali A, Katz S. Inflammatory Bowel Disease in the Baby to Baby Boomer: Pediatric and Elderly Onset of IBD. Curr Treat Options Gastroenterol. 2018.
16. Duricova D, Sarter H, Savoye G, Leroyer A, Pariente B, Armengol-Debeir L, et al. Impact of Extra-Intestinal Manifestations at Diagnosis on Disease Outcome in Pediatric- and Elderly-Onset Crohn's Disease: A French Population-Based Study. Inflamm Bowel Dis. 2018.
17. Juneja M, Baidoo L, Schwartz MB, Barrie A, 3rd, Regueiro M, Dunn M, et al. Geriatric inflammatory bowel disease: phenotypic presentation, treatment patterns, nutritional status, outcomes, and comorbidity. Dig Dis Sci. 2012;57(9):2408-15.
18. Quezada SM, Steinberger EK, Cross RK. Association of age at diagnosis and Crohn's disease phenotype. Age Ageing. 2013;42(1):102-6.
19. MacLaughlin EJ, Raehl CL, Treadway AK, Sterling TL, Zoller DP, Bond CA. Assessing medication adherence in the elderly: which tools to use in clinical practice? Drugs Aging. 2005;22(3):231-55.
20. Kedia S, Limdi JK, Ahuja V. Management of inflammatory bowel disease in older persons: evolving paradigms. Intest Res. 2018;16(2):194-208.
21. Bernstein CN, Hitchon CA, Walld R, Bolton JM, Sareen J, Walker JR, et al. Increased Burden of Psychiatric Disorders in Inflammatory Bowel Disease. Inflamm Bowel Dis. 2018.
22. Lin W, Chen M, Chu G, Wang T, Wang H, Shih S, et al. Crohn's Disease: Specific Concerns in the Elderly. International Journal of Gerontology. 2016;10(3):126-30.
23. Perera LP, Bhandari S, Liu R, Guilday C, Zadvornova Y, Saeian K, et al. Advanced Age Does Not Negatively Impact Health-Related Quality of Life in Inflammatory Bowel Disease. Dig Dis Sci. 2018;63(7):1787-93.
24. Gisbert JP, Gonzalez-Lama Y, Mate J. 5-Aminosalicylates and renal function in inflammatory bowel disease: a systematic review. Inflamm Bowel Dis. 2007;13(5):629-38.
25. Greenwald DA, Brandt LJ. Inflammatory Bowel Disease After Age 60. Curr Treat Options Gastroenterol. 2003;6(3):213-25.
26. Thomas TP. The complications of systemic corticosteroid therapy in the elderly. A retrospective study. Gerontology. 1984;30(1):60-5.
27. Stallmach A, Hagel S, Gharbi A, Settmacher U, Hartmann M, Schmidt C, et al. Medical and surgical therapy of inflammatory bowel disease in the elderly - prospects and complications. J Crohns Colitis. 2011;5(3):177-88.
28. Huguet JM, Iborra M, Bosca-Watts MM, Maroto N, Gil R, Cortes X, et al. Inflammatory bowel disease in patients over the age of 70 y. Does the disease duration influence its behavior? Scand J Gastroenterol. 2018:1-6.
29. Travis SP, Danese S, Kupcinskas L, Alexeeva O, D'Haens G, Gibson PR, et al. Once-daily budesonide MMX in active, mild-to-moderate ulcerative colitis: results from the randomised CORE II study. Gut. 2014;63(3):433-41.
30. Present DH, Meltzer SJ, Krumholz MP, Wolke A, Korelitz BI. 6-Mercaptopurine in the management of inflammatory bowel disease: short- and long-term toxicity. Ann Intern Med. 1989;111(8):641-9.
31. Cuffari C, Dassopoulos T, Turnbough L, Thompson RE, Bayless TM. Thiopurine methyltransferase activity influences clinical response to azathioprine in inflammatory bowel disease. Clin Gastroenterol Hepatol. 2004;2(5):410-7.
32. Chaparro M, Ordas I, Cabre E, Garcia-Sanchez V, Bastida G, Penalva M, et al. Safety of thiopurine therapy in inflammatory bowel disease: long-term follow-up study of 3931 patients. Inflamm Bowel Dis. 2013;19(7):1404-10.
33. Govani SM, Higgins PD. Combination of thiopurines and allopurinol: adverse events and clinical benefit in IBD. J Crohns Colitis. 2010;4(4):444-9.
34. Beaugerie L, Brousse N, Bouvier AM, Colombel JF, Lemann M, Cosnes J, et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study. Lancet. 2009;374(9701):1617-25.
35. Ariyaratnam J, Subramanian V. Association between thiopurine use and nonmelanoma skin cancers in patients with inflammatory bowel disease: a meta-analysis. Am J Gastroenterol. 2014;109(2):163-9.
36. Shea B, Swinden MV, Ghogomu ET, Ortiz Z, Katchamart W, Rader T, et al. Folic acid and folinic acid for reducing side effects in patients receiving methotrexate for rheumatoid arthritis. J Rheumatol. 2014;41(6):1049-60.
37. Subramaniam K, D'Rozario J, Pavli P. Lymphoma and other lymphoproliferative disorders in inflammatory bowel disease: a review. J Gastroenterol Hepatol. 2013;28(1):24-30.
38. Lobaton T, Ferrante M, Rutgeerts P, Ballet V, Van Assche G, Vermeire S. Efficacy and safety of anti-TNF therapy in elderly patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2015;42(4):441-51.
39. Cottone M, Kohn A, Daperno M, Armuzzi A, Guidi L, D'Inca R, et al. Advanced age is an independent risk factor for severe infections and mortality in patients given anti-tumor necrosis factor therapy for inflammatory bowel disease. Clin Gastroenterol Hepatol. 2011;9(1):30-5.
40. Desai A, Zator ZA, de Silva P, Nguyen DD, Korzenik J, Yajnik V, et al. Older age is associated with higher rate of discontinuation of anti-TNF therapy in patients with inflammatory bowel disease. Inflamm Bowel Dis. 2013;19(2):309-15.
41. Ljung T, Karlen P, Schmidt D, Hellstrom PM, Lapidus A, Janczewska I, et al. Infliximab in inflammatory bowel disease: clinical outcome in a population based cohort from Stockholm County. Gut. 2004;53(6):849-53.
42. Lichtenstein GR, Feagan BG, Cohen RD, Salzberg BA, Diamond RH, Chen DM, et al. Serious infections and mortality in association with therapies for Crohn's disease: TREAT registry. Clin Gastroenterol Hepatol. 2006;4(5):621-30.
43. Lichtenstein GR, Feagan BG, Cohen RD, Salzberg BA, Diamond RH, Langholff W, et al. Drug therapies and the risk of malignancy in Crohn's disease: results from the TREAT Registry. Am J Gastroenterol. 2014;109(2):212-23.
44. Denadai R, Teixeira FV, Saad-Hossne R. Management of psoriatic lesions associated with anti-TNF therapy in patients with IBD. Nat Rev Gastroenterol Hepatol. 2012;9(12):744.
45. Singh JA, Wells GA, Christensen R, Tanjong Ghogomu E, Maxwell L, Macdonald JK, et al. Adverse effects of biologics: a network meta-analysis and Cochrane overview. Cochrane Database Syst Rev. 2011(2):CD008794.
46. Shim H, Chan P, Chuah S, Schwender B, Kong S, Ling K. A review of vedolizumab and ustekinumab for the treatment of inflammatory bowel diseases. Journal of Gastroenterology and Hepatology. 2018;2(5):223-34.
47. Hayashi M, Umezawa Y, Fukuchi O, Ito T, Saeki H, Nakagawa H. Efficacy and safety of ustekinumab treatment in elderly patients with psoriasis. J Dermatol. 2014;41(11):974-80.
48. Megna M, Napolitano M, Balato N, Monfrecola G, Villani A, Ayala F, et al. Efficacy and safety of ustekinumab in a group of 22 elderly patients with psoriasis over a 2-year period. Clin Exp Dermatol. 2016;41(5):564-6.
49. Jeuring S, Van den Heuvel T, Zeegers M, Hameeteman W, Romberg-Camos M, Oostenbrug I, et al. OP005 Is elderly-onset ulcerative colitis a different entity? Natural disease course and treatment response compared to adult-onset disease in the population-based IBD-SL cohort. J Crohns Colitis. 2014;8(1):S3-S4.
50. Sacleux SC, Sarter H, Fumery M, Charpentier C, Guillon-Dellac N, Coevoet H, et al. Post-operative complications in elderly onset inflammatory bowel disease: a population-based study. Aliment Pharmacol Ther. 2018;47(12):1652-60.
51. Delaney CP, Fazio VW, Remzi FH, Hammel J, Church JM, Hull TL, et al. Prospective, age-related analysis of surgical results, functional outcome, and quality of life after ileal pouch-anal anastomosis. Ann Surg. 2003;238(2):221-8.
52. Church JM. Functional outcome and quality of life in an elderly patient with an ileal pouch-anal anastomosis: a 10-year follow up. Aust N Z J Surg. 2000;70(12):906-7.
53. Farraye FA, Odze RD, Eaden J, Itzkowitz SH, McCabe RP, Dassopoulos T, et al. AGA medical position statement on the diagnosis and management of colorectal neoplasia in inflammatory bowel disease. Gastroenterology. 2010;138(2):738-45.
54. Rutter MD, Saunders BP, Wilkinson KH, Rumbles S, Schofield G, Kamm MA, et al. Thirty-year analysis of a colonoscopic surveillance program for neoplasia in ulcerative colitis. Gastroenterology. 2006;130(4):1030-8.
55. Rex DK, Johnson DA, Anderson JC, Schoenfeld PS, Burke CA, Inadomi JM, et al. American College of Gastroenterology guidelines for colorectal cancer screening 2009 [corrected]. Am J Gastroenterol. 2009;104(3):739-50.
56. Bielawska B, Day AG, Lieberman DA, Hookey LC. Risk factors for early colonoscopic perforation include non-gastroenterologist endoscopists: a multivariable analysis. Clin Gastroenterol Hepatol. 2014;12(1):85-92.
57. Navaneethan U, Parasa S, Venkatesh PG, Trikudanathan G, Shen B. Prevalence and risk factors for colonic perforation during colonoscopy in hospitalized inflammatory bowel disease patients. J Crohns Colitis. 2011;5(3):189-95.




