Redacción Farmacosalud.com
La contribución de la madre a la composición de la microbiota del recién nacido está bien documentada. Ahora, un nuevo trabajo publicado en ‘Cell Host & Microbe’ muestra la importante contribución de los padres a la composición de los microorganismos que colonizan el intestino de un bebé. Además, el estudio confirma que la transferencia de microbiota fecal materna (FMT, por sus siglas en inglés) en bebés nacidos por cesárea puede ayudar a corregir las alteraciones de la microbiota, habituales en los recién nacidos que no nacen por vía vaginal1.
Los fetos tienen tractos gastrointestinales estériles, y los cuerpos de los bebés se colonizan durante y poco después del nacimiento. Aproximadamente, la mitad de las cepas presentes en el organismo de los recién nacidos proceden del intestino materno. Esto llevó a los investigadores a plantear la hipótesis de que otras personas en estrecho contacto con el bebé podrían contribuir al resto, proporcionando una fuente estable de cepas microbianas asociadas a la buena salud.
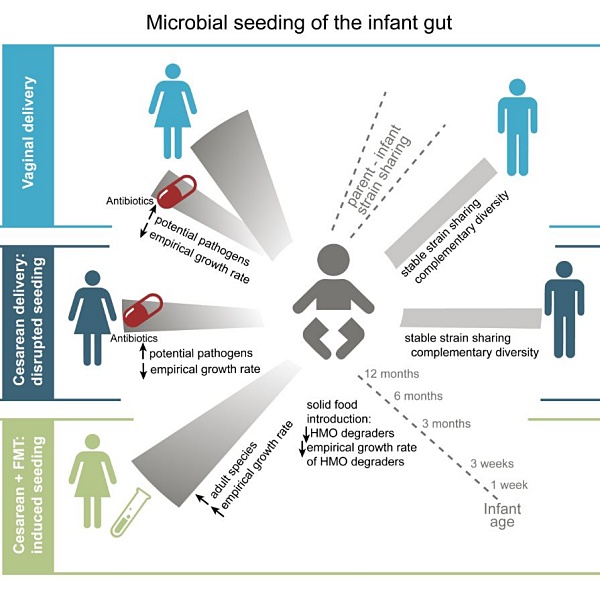
Resumen gráfico de la investigación
Fuente: Cell Host & Microbe
Difusión: UPF
"El papel del padre puede ser pequeño, pero no hay que desestimarlo”
“Este estudio aporta datos significativos sobre cómo se coloniza un recién nacido”, afirma Willem M. de Vos, autor principal y coautor de la nueva investigación y miembro de la Universidad de Wageningen (Países Bajos) y la Universidad de Helsinki (Finlandia). "El papel del padre puede ser pequeño, pero no hay que desestimarlo. Es probable que lo mismo ocurra con otras personas que tienen un contacto estrecho con el recién nacido", agrega.
“Estamos muy contentos de haber encontrado esta conexión”, señala el coautor Nicola Segata, de la Universidad de Trento (Italia). “Esto pone de relieve la importancia de estudiar también otras contribuciones microbianas, como las de los hermanos y los compañeros de guardería”. El grupo de Segata aportó el análisis computacional, mientras que el grupo de De Vos diseñó el estudio.
"El año pasado demostramos que existe una amplia transmisión del microbioma entre adultos en estrecho contacto social. Nos entusiasma tener ahora la confirmación de que esto también ocurre en los recién nacidos: reciben su primera microbiota de sus madres, pero otros individuos cercanos (como los padres) complementan su contribución. Esto es especialmente importante para los bebés nacidos por cesárea", remarca Mireia Vallès-Colomer, investigadora de la Universidad Pompeu Fabra (UPF, en Barcelona) y coprimera autora del trabajo.
Inspirado por su propia experiencia como padre, De Vos lleva muchos años estudiando la microbiota de los bebés y cómo se coloniza su tracto gastrointestinal tras el nacimiento. En octubre de 2020, él y sus colegas publicaron en ‘Cell’ un estudio de prueba de concepto que confirmaba que exponer a los recién nacidos por cesárea a la microbiota de su madre justo después del parto era seguro y eficaz para dar a los bebés una composición microbiana más parecida a la de los bebés nacidos por vía vaginal. Los niños recibieron una pequeña cantidad de la microbiota fecal de sus madres poco después de nacer.
Los partos por cesárea representan una cuarta parte de los nacimientos
Este nuevo trabajo ofrece datos de seguimiento de ese estudio, así como nuevas investigaciones sobre la contribución de los padres a la composición microbiana de los bebés. Los autores afirman que, dado que los partos por cesárea representan actualmente una cuarta parte de los nacimientos en todo el mundo, debería prestarse más atención a la creación de un equilibrio saludable de la microbiota intestinal en estos recién nacidos. Los investigadores realizaron análisis metagenómicos de muestras fecales de recién nacidos y de sus padres. Buscaron la presencia de una amplia gama de cepas bacterianas a lo largo del tiempo. En el caso de los bebés que formaron parte del estudio anterior, se confirmó mediante análisis de seguimiento de hasta un año que el TFM materno reducía significativamente los niveles de cepas bacterianas potencialmente patógenas hasta un año después.
En el estudio más reciente, se compararon los microbiomas fecales de bebés (21 nacidos por cesárea y 52 por vía vaginal) de los que se tomaron muestras longitudinales durante un año con los de sus madres y padres. Descubrieron que muchas de las cepas encontradas en los bebés de 3 semanas, 3 meses y 12 meses procedían del padre, no de la madre. Entre ellas se identificó Bifidobacterium longum, que se sabe que utiliza los oligosacáridos de la leche materna, aunque puede proceder del padre y no de la madre.

Procedimiento de trasplante de microbiota fecal
Fuente: Hospital Universitario de Bellvitge
“Saber que el padre contribuye sustancialmente al microbioma en desarrollo del bebé subraya el importante papel de las interacciones físicas y sociales entre el recién nacido y su padre, así como con otros miembros de la familia”, sostiene Segata. A lo que añade: “esperamos que este estudio ayude a concienciar sobre esas importantes contribuciones».
Los resultados del trabajo son fruto de la colaboración internacional de investigadores de la Universidad de Wageningen, Helsinki y Trento, que han dirigido el estudio, con la Universidad Pompeu Fabra, el Hospital Universitario de Helsinki, el Instituto Finlandés de Salud y Bienestar y el Instituto Europeo de Oncología IRCCS.
El trasplante fecal, alternativa a los antibióticos frente a la infección por C. difficile
Por otro lado, un estudio llevado a cabo por el Hospital Universitario de Bellvitge (HUB, en l’Hospitalet de Llobregat, en Barcelona) y el Instituto de Investigación Biomédica de Bellvitge (IDIBELL), presentado en el Congreso Europeo de Microbiología y Enfermedades Infecciosas ESCMID Global, revela una recuperación significativa de la diversidad de la microbiota fecal en la mayoría de los casos de infección por Clostridiodes difficile tratados con trasplante de microbiota fecal (TMF). “Estos resultados son relevantes, puesto que la infección por C. difficile puede poner en riesgo la vida de los pacientes, y estos primeros resultados sustentan el uso del trasplante de microbiota como una alternativa segura y eficaz”, comenta la Dra. Daiana Guevara, coordinadora de la Unidad de Microbioma del HUB e investigadora del IDIBELL.
Los resultados se basan en la secuenciación y estudio posterior de la diversidad microbiana de muestras de donantes y receptoras de trasplantes de microbiota fecal realizados en el Hospital de Bellvitge desde finales de noviembre de 2021 a junio de 2022, los primeros que se incluyeron en el Banco de Microbioma de Cataluña. Se observó que las muestras fecales de los sujetos con infección por C.difficile mostraban una baja diversidad microbiana, en comparación con las muestras de donantes sanos.
“La microbiota intestinal se compone de millones de microorganismos que desarrollan una amplia variedad de funciones beneficiosas para la salud. Factores externos como los hábitos alimenticios, el consumo de antibióticos, entre otros, generan cambios en la microbiota habitual que pueden desencadenar desequilibrios que predispongan a infecciones gastrointestinales, como es la infección por C. difficile, una de las primeras causas de diarrea asociada a los cuidados de salud”, explica la Dra. Guevara.
El trasplante de microbiota fecal (TMF) es un procedimiento médico mediante el cual se transfiere la microbiota fecal de un donante sano al trato gastrointestinal de otro individuo, a fin de conferirle un beneficio para su salud.

Cápsula usada en el trasplante de microbiota fecal
Fuente: Hospital Universitario de Bellvitge
El HUB fabrica cápsulas liofilizadas de microbiota intestinal a partir de las heces de donantes con un microbioma intestinal sano. Este tratamiento oral es eficaz en menos de 48 horas. Para producir estas cápsulas, son necesarias donaciones altruistas de heces. Tres de cada cuatro potenciales donantes son descartados en un proceso de selección muy exigente. Se descartan personas con condiciones como diabetes u obesidad, o cualquier patología crónica, así como los portadores de gérmenes multirresistentes o patógenos en las heces. La misión del Banco de Microbioma es acelerar estos pasos proporcionando de forma inmediata muestras de heces congeladas.
Artículo de referencia:
1. Dubois et al. Paternal and induced gut microbiota seeding complement mother-to-infant transmission, Cell Host & Microbe. 2024. https://doi.org/10.1016/j.chom.2024.05.004




