Redacción Farmacosalud.com
Una mujer japonesa ha sido el primer paciente del mundo que recibe un trasplante de córnea generada a partir de células madre 'reprogramadas' o iPS, según publica la prestigiosa revista ‘Nature’. “Es un avance muy significativo en la línea de otros avances que ya se están produciendo con este tipo de células. Los investigadores japoneses tienen un clarísimo liderazgo en este campo; se están llevando a cabo muchos ensayos clínicos en los que las células de reprogramación inducida se utilizan para ‘fabricar’ células de un tipo determinado, con el fin de suplir células que están afectas de algún tipo de patología”, afirma la Dra. Anna Veiga, directora del Banco de Líneas Celulares del Centro de Medicina Regenerativa de Barcelona (CMR[B]).
La Dra. María Esther Gallardo Pérez, directora del grupo de Investigación Traslacional con Células iPS (ITiPS) del Instituto de Investigación del Hospital 12 de Octubre (Madrid), celebra también el avance conseguido: “Para alguien que, como yo, lidera un grupo de investigación centrado en la utilización de tecnología de células iPS, es una gran noticia. Te hace sentir que realmente estamos en el buen camino y que la utilización de células iPS en terapia celular y medicina regenerativa es algo que va tomando forma y acabará siendo una realidad para el tratamiento de un gran número de enfermedades”.

Dra. María Esther Gallardo Pérez
Fuente: Hospital Universitario 12 de Octubre
El trasplante de córnea convencional genera largas listas de espera
Hasta ahora, las personas con la córnea dañada se pueden tratar utilizando tejido obtenido a partir de donantes que hayan fallecido, pero lógicamente este método de tratamiento genera listas de espera muy largas y no es asequible para cualquier paciente. “En este sentido, la posibilidad de poder generar capas de células corneales in vitro a partir de células iPS supondría un gran avance”, remarca la Dra. Gallardo Pérez.
Si los beneficios del trasplante revolucionario de córnea se confirmaran en posteriores estudios, ello significaría que una persona que necesitara ese tejido para mejorar su visión ya no tendría que esperar a una donación corneal procedente de cadáver, tal y como apunta Veiga: “Esa es la idea final de la terapia celular: en vez de trasplantar órganos enteros -en este caso la córnea- partiendo de cadáver o de donante vivo -de donante vivo por ejemplo en el caso de un riñón-, aquí lo que haríamos es trasplantar células, es decir, sustituiríamos células que han dejado de funcionar por unas que habremos elaborado en el laboratorio a partir de células de reprogramación inducida”.
La nueva técnica empleada para el trasplante de córnea consiste en crear láminas de células corneales a partir de células madre pluripotentes inducidas (iPS), mediante la reprogramación de células cutáneas adultas. Si bien en este caso se ha usado material cutáneo, cabe destacar que las iPS se pueden obtener a partir de cualquier otro tejido, órgano o fluido, y además de una forma menos invasiva (células de la sangre, de la orina, etc).
En el caso de la paciente japonesa, hay que puntualizar que los tejidos ‘fabricados’ no son exactamente córneas completas, sino capas de células corneales. Para obtenerlas, lo primero que se hace es generar células iPS mediante la reprogramación de células somáticas obtenidas de un donante. Hoy en día es posible reprogramar a células iPS partiendo casi de cualquier tipo celular. En esta ocasión, como punto de partida se han utilizado fibroblastos, que son un tipo de células que se obtienen a partir de una biopsia de piel del donante. “Una vez obtenidas las células iPS, existen protocolos que permiten obtener capas 3D de células de la córnea. Éstas serían las que realmente se trasplantarían al paciente”, especifica la experta del Instituto de Investigación del Hospital 12 de Octubre.
Volver para atrás para avanzar después hacia otro camino
“En cualquier caso -señala la Dra. Veiga-, lo que se hace con las células iPS es inducirlas a volver atrás en su ‘programa’ de funcionamiento y convertirlas en células con una calidad de pluripotencia, es decir, con la capacidad de convertirse en cualquier tipo celular. Esto es lo que representa la reprogramación: coger una célula que ya ha hecho todo su camino y que se ha convertido en lo que el individuo necesitaba (célula de la piel, sangre, páncreas, cerebro, etc) y se la empuja a volver atrás, es decir, se revierte su ‘programa’, que estaba ya muy determinado para ser una célula de la piel, corazón o de lo que sea, y se la convierte en una célula pluripotente, cuya utilidad reside en que tiene versatilidad para transformarse en cualquier tipo celular”.
Así, lo que han hecho los investigadores que han tratado a la paciente japonesa es transformar las iPS en células corneales y, “como tienen el procedimiento muy bien estandarizado, una vez han conseguido esta pequeña capa de células corneales, la han trasplantado a la mujer que tenía el problema ocular, obteniéndose el beneficio terapéutico buscado”, explica Veiga. “Eso es lo que se denomina terapia celular. Estamos curando con células. Tenemos una córnea dañada y lo que estamos haciendo es sustituir esta córnea por una membrana de células corneales que hemos ‘fabricado’ en el laboratorio”, precisa.
![Dra. Anna Veiga Dra. Anna Veiga Fuente: CMR[B]](http://farmacosalud.com/wp-content/uploads/2019/10/400-doctora-Anna-Veiga.jpg)
Dra. Anna Veiga
Fuente: CMR[B]
Las perspectivas que se abren con las células iPS son muy amplias. Sin ir más lejos, en la actualidad el CMR[B] ya dispone de protocolos muy bien establecidos para convertir las iPS en células del epitelio de la retina con el fin último de tratar afecciones oculares como la degeneración macular. Se está trabajando también para convertirlas en células del corazón (en cardiomiocitos) para tratar problemas a nivel cardiovascular, infartos, etc.
Las células corneales derivadas de las iPS pueden elaborarse a partir de la piel del propio paciente, pero también a partir de la piel de otra persona, por ejemplo un individuo sano. Desde un punto de vista meramente técnico, los dos tipos de tejidos cutáneos son igual de útiles para el posterior injerto. Otro tema muy diferente es el tema del rechazo, ya que, si se recurre a las células del propio enfermo, ese enfermo va a reconocer las células como propias y por lo tanto disminuye la posibilidad de repudio del injerto, cosa que podría no pasar con células procedentes de otro sujeto. “Ahora bien, lo que ocurre es que, desde un punto de vista organizativo, logístico y económico, es totalmente inviable pensar que para cada paciente que tengamos que tratar de cada una de las enfermedades existentes, vayamos a poder hacer células especiales para él, es decir, hacerle a cada uno sus células iPS. Teóricamente sería la mejor de las situaciones, pero es un procedimiento inviable”, comenta Veiga. “Además -prosigue-, si la patología que se trata resulta que tiene un origen genético, lógicamente no nos interesa usar células del propio paciente”.
Cuando el donante es el propio enfermo, se habla de trasplante autólogo, mientras que cuando el donante es un individuo sano, se habla de trasplante alogénico. “Este tipo de aproximación (alogénica) es la que se está tendiendo a utilizar, cada vez, con mayor frecuencia. La razón por la que esto es así se debe a que, de este modo, es más factible la ‘industrialización’ del proceso. Esto es, se podrían generar bancos de células iPS perfectamente caracterizadas, no sólo desde el punto de vista genómico, sino también desde el punto de vista inmunológico, de forma que puedan existir células iPS compatibles con el sistema inmune de cualquier paciente. De este modo, no habría necesidad de reprogramar cada vez que hubiera que utilizar estas células, sino simplemente recurrir al banco de células iPS”, explica la Dra. Gallardo Pérez.
Las novedosas terapias mediante iPS podrían generalizarse en pocos años
Según la directora del Banco de Líneas Celulares del CMR[B], actualmente lo que se intenta es establecer bancos de líneas celulares a partir de células del cordón umbilical que sean aprovechables para un amplio segmento poblacional. “Acabaríamos haciendo un poquito lo mismo que se hace, por ejemplo, con los donantes de médula ósea: intentar encontrar haplotipos que sean compatibles con una franja importante de población. De hecho, nuestro grupo tiene un proyecto con el Banc de Sang i Teixits [Banco de Sangre y Tejidos] precisamente para hacer eso: buscar haplotipos muy frecuentes -que cubran a muchas personas- de sangre de cordón umbilical con los que fabricar células iPS, para poderlas transformar posteriormente en distintos tipos celulares, útiles para tratamientos destinados a una franja importante de la población”, subraya la Dra. Veiga.
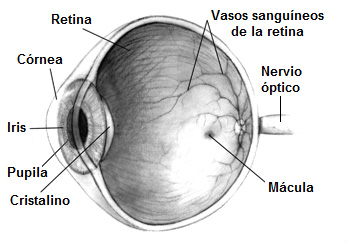
Sección de un ojo humano
Autor/a de la imagen: Modificado de: Human_eye.jpg (14KB, MIME type: image/jpeg) (Wikipedia commons) Human eye cross-sectional view grayscale Copyright: public domain, credit to NIH en:National Eye Institute requested. Original source: http://www.nei.nih.gov/health/macularhole/index.asp. Ojo_humano.jpg: Pixel derivative work: Taty2007 (talk) - Ojo_humano.jpg
Fuente: Wikipedia
En condiciones normales, la córnea cubre y protege el ojo. La beneficiaria del trasplante pionero de córnea es una mujer japonesa de unos 40 años afecta de una enfermedad que se caracteriza por generar una pérdida de células madre que reparan este órgano ocular. Esta condición hace que la visión sea borrosa, lo que puede conducir a la ceguera. El equipo que ha llevado a cabo la intervención asegura que la visión de la mujer ha mejorado desde el trasplante.
A juicio de Veiga, en pocos años podrían generalizarse los injertos mediante iPS, siempre y cuando los ensayos clínicos que se están realizando o se vayan a realizar de ahora en adelante vayan confirmando los resultados conseguidos en estudios como el relativo al trasplante corneal. Gallardo Pérez también se muestra muy prudente: “Hay que tener en cuenta que, aunque las células iPS se hayan descubierto hace más de una década, todas las aplicaciones terapéuticas que puedan derivarse de su utilización se encuentran en un estado preliminar. Esto significa que hay que ser cautos y esperar para ver cuál es el resultado final, descartar la aparición de tumores y ver qué sucede en otros pacientes trasplantados. Por tanto, aún pasará algún tiempo antes de que todas estas tecnologías puedan estar al alcance de los científicos de cualquier parte del mundo. Pero, sin lugar a dudas, estamos en el buen camino… y el hecho de que la paciente haya recuperado la visión en tan solo un mes desde que se realizó el trasplante es, ciertamente, muy esperanzador”.




