Redacción Farmacosalud.com
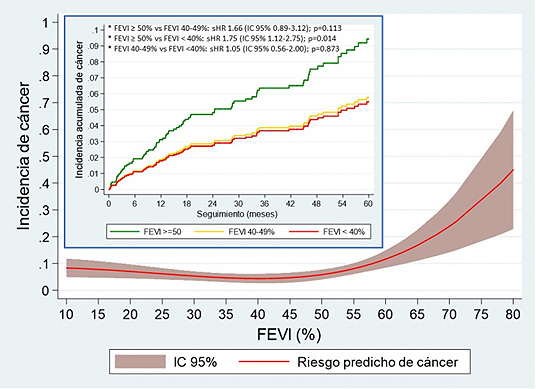
El riesgo de desarrollar cáncer tras un ingreso por insuficiencia cardiaca (IC) es dependiente de la fracción de eyección, es decir, del porcentaje de sangre expulsada por el ventrículo izquierdo con cada latido (FEVI). Así lo ha demostrado un análisis realizado por el Servicio de Cardiología del Hospital Universitario Álvaro Cunqueiro (Vigo), cuyos resultados se han presentado en el Congreso de las Enfermedades Cardiovasculares SEC 2018, celebrado recientemente en Sevilla.
La insuficiencia cardiaca es una enfermedad grave que impide el correcto bombeo del corazón, haciendo que no llegue suficiente riego sanguíneo al organismo y que se acumulen los líquidos que el corazón no expulsa adecuadamente. Esta patología afecta a más de 390.000 personas en España (el 8,8% de los mayores de 74 años). Hasta ahora existía una gran controversia sobre si los pacientes con IC presentaban o no mayor riesgo de desarrollar cáncer, pues diversos estudios han mostrado resultados contradictorios en diferentes poblaciones. El grupo de investigación de Vigo, liderado por el Dr. Andrés Iñiguez, anterior presidente de la Sociedad Española de Cardiología (SEC), está poniendo mucho énfasis en el estudio de la asociación entre cáncer y enfermedad cardiovascular.
Fuente: SEC
Mecanismos compartidos con la fisiopatología del cáncer
“Con nuestro estudio pretendíamos esclarecer si existía aumento del riesgo de cáncer en función de la fracción de eyección ventricular izquierda, teniendo en cuenta los tres estadios propuestos por la Sociedad Europea de Cardiología: FEVI igual o mayor del 50%, FEVI entre 40 y 49% y FEVI menor del 40%”, explica la Dra. Isabel Muñoz Pousa, primera firmante del estudio. “Conocer este dato podría ayudarnos a tomar decisiones de forma precoz en pacientes seleccionados, por ejemplo, con seguimientos más estrictos sobre todo por parte del médico de atención primaria en cuanto a signos o síntomas de alarma que puedan orientar al diagnóstico de una neoplasia. No sería indicación de realizar pruebas diagnósticas concretas, pero sí ayudaría a un mejor enfoque clínico”, apunta la especialista.
En el estudio se incluyeron todos los pacientes con diagnóstico de IC dados de alta entre 2009 y 2016 en el Hospital Universitario Álvaro Cunqueiro, excluyendo aquellos que habían sufrido cáncer con anterioridad. De los 1.371 pacientes estudiados, 492 tenían una FEVI igual o superior al 50%, 232 presentaron una FEVI entre el 40 y el 49% y 647 una FEVI inferior al 40%. Los pacientes fueron seguidos durante una media de casi dos años y medio. Durante ese seguimiento, 88 pacientes desarrollaron cáncer (6,4%) y 517 fallecieron (37,8%).
Los pacientes con FEVI mayor al 50% mostraron un 75% más riesgo de desarrollar cáncer: concretamente, de cada 100 pacientes, presentaron cáncer 2,7 de ellos al año. En cambio, aquellos con FEVI inferior al 50% (incluyendo a los pacientes con FEVI inferior al 40%) presentaron una incidencia de cáncer de 1,9 pacientes por cada 100 personas al año. “Que la población con FEVI igual o mayor del 50% sea la que se asocia a mayor riesgo de cáncer podría explicarse por factores de riesgo compartidos y por mecanismos fisiopatológicos comunes, como el nuevo paradigma de la insuficiencia cardiaca con FEVI conservada que explica la enfermedad como un estado proinflamatorio sistémico por disfunción microvascular y daño mitocondrial, mecanismos compartidos con la fisiopatología del cáncer”, revela la Dra. Muñoz Pousa.
Nuevo hallazgo sobre el envejecimiento del corazón

(de izq. a dcha): los investigadores Diana Bou Teen, Marisol Ruiz-Meana, David Garcia-Dorado, y Elisabet Miro-Casas (CIBERCV-VHIR)
Fuente: CIBERCV / Centro de Investigación Biomédica en Red (CIBER)
Por otro lado, un estudio[1] dirigido por la Dra. Marisol Ruiz-Meana, investigadora principal del grupo de Enfermedades Cardiovasculares del Vall d’Hebron Institut de Recerca (VHIR, en Barcelona) que lidera el Dr. David García-Dorado, en el que ha participado el Grupo de Química de Proteínas del Centro Nacional de Investigación Cardiovascular (CNIC), ambos pertenecientes al CIBERCV del ISCIII, ha descubierto que las alteraciones funcionales de las células cardiacas en el envejecimiento no se explican por cambios oxidativos, sino que se deben a la acumulación de productos avanzados de la glicación (AGEs, del inglés advanced glycation end-products) que se produce, en parte, por un fallo en el sistema enzimático encargado de prevenir el daño por glicación.
A medida que envejecemos, el corazón se adapta peor al ejercicio y se vuelve más vulnerable al estrés y al daño por isquemia. Si lo observamos a nivel celular, vemos que en las células musculares del corazón, los cardiomiocitos, se produce un desajuste progresivo entre sus necesidades energéticas y la capacidad para generar energía. Esto facilita el desarrollo de insuficiencia contráctil, entre otras alteraciones. Pero se desconocen los mecanismos celulares responsables de este deterioro, y hasta ahora la principal hipótesis era el aumento de daño oxidativo asociado a la edad.
En este estudio, publicado en la revista 'Circulation', se ha identificado “una nueva vía para explicar el proceso y los mecanismos que llevan a un cardiomiocito envejecido pero sano a convertirse en un cardiomiocito deteriorado que predisponga al corazón a desarrollar una insuficiencia cardíaca”, explica la Dra. Marisol Ruiz-Meana. “Esta nueva vía es la glicación, un ataque químico no regulado que produce alteraciones irreversibles y terminales en las proteínas”, afirma. El trabajo demuestra que el daño glicativo asociado a la edad afecta al receptor de rianodina, el canal que controla la liberación de calcio desde el retículo sarcoplásmico, una red de conductos que se extiende por toda la célula y que en cada latido cardíaco libera y recoge calcio para regular la activación de las proteínas contráctiles y la producción de energía (en forma de ATP) en las mitocondrias.
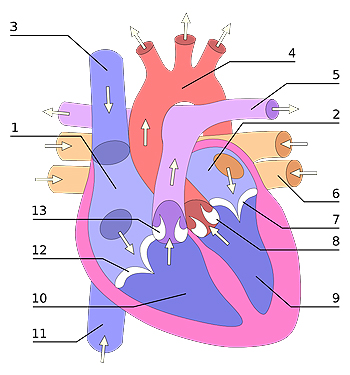
Vista frontal de un corazón humano. Las flechas blancas indican el flujo normal de la sangre. 1. Aurícula derecha; 2. Aurícula izquierda; 3. Vena cava superior; 4. Arteria aorta; 5. Arterias pulmonares, izquierda y derecha; 6. Venas pulmonares; 7. Válvula mitral; 8. Válvula aórtica; 9. Ventrículo izquierdo; 10. Ventrículo derecho; 11. Vena cava inferior; 12. Válvula tricúspide; 13. Válvula pulmonar
Autor/a de la imagen: User:Wapcaplet. - EN Wikipedia (slightly edited by Stanisław Skowron)
Fuente: Wikipedia
El estudio indica que el receptor de rianodina se encuentra parcialmente glicado en los cardiomiocitos de ratones viejos (más de 20 meses) y de pacientes mayores de 75 años. La glicación del receptor de rianodina hace que el cierre de este canal sea defectuoso, de forma que se produce una liberación no controlada de calcio desde el retículo sarcoplásmico que acaba exponiendo a las mitocondrias a un exceso de calcio. Como consecuencia, las mitocondrias acumulan calcio en su interior y pierden la capacidad respiratoria necesaria para generar energía de forma eficiente.
Los investigadores proponen que esta cadena de alteraciones producida por la glicación constituye la base fisiopatológica del deterioro funcional del corazón durante el envejecimiento que, a su vez, podría facilitar la transición hacia la insuficiencia cardiaca, una condición que aumenta de forma exponencial a medida que envejecemos y que constituye una de las principales causas de muerte y discapacidad en todos los países del mundo. La identificación de este mecanismo molecular de envejecimiento cardíaco podría permitir el desarrollo de tratamientos encaminados a prevenirlo.
Nuevo método para los huecos de ablación
El aislamiento o ablación de las venas pulmonares es un procedimiento habitual en el tratamiento de la fibrilación auricular, la arritmia más frecuente causada por un problema en la conductividad eléctrica del corazón que, a menudo, se desencadena inicialmente en la proximidad de las venas pulmonares. Este procedimiento quirúrgico produce una lesión o cicatriz que afecta las venas dificultando la propagación de la señal eléctrica del corazón.
Desafortunadamente, a menudo la lesión es incompleta y se convierte en una combinación de lesiones y huecos de tejido sano. Estas lagunas pueden hacer fracasar el tratamiento, dado que son causas potenciales de recurrencia de la fibrilación auricular. La resonancia magnética cardíaca es una técnica no invasiva utilizada para detectar estos huecos, pero es un proceso que requiere mucho tiempo y que es difícil de estandarizar porque la inspección visual depende de la variabilidad entre los observadores.
Definición estandarizada del resultado de la intervención
Un equipo de investigadores, en un trabajo[2] publicado en la edición avanzada en línea de la revista 'Medical Image Analysis', presenta un nuevo método para identificar y cuantificar de manera semiautomática los huecos de ablación a través de la cuantificación empleando métodos analíticos matemáticos de teoría de grafos. Marta Núñez García, Òscar Cámara y Konstantine Butakoff, investigadores del Grupo de Investigación Physense del Departamento de Tecnologías de la Información y las Comunicaciones (DTIC) de la Universidad Pompeu Fabra (UPF, en Barcelona), conjuntamente con investigadores del Kings College de Londres (Reino Unido), proponen una medida para estimar el porcentaje de huecos o lagunas alrededor de una vena que ha sido sometida a ablación.

Autor/a: r. nial bradshaw
Fuente: Flickr / Creative Commons
El método se ha evaluado sobre datos sintéticos y clínicos provenientes de 50 pacientes con diagnóstico de fibrilación auricular que fueron intervenidos de aislamiento de venas pulmonares con ablación por radiofrecuencia. Sobre los datos procesados y con esta nueva metodología, los investigadores han podido concluir que la vena pulmonar superior izquierda es la más propensa a los huecos de lesiones mientras que la vena pulmonar inferior izquierda es la menos propensa, lo que podría ser muy útil para la optimización o evaluación objetiva de las intervenciones de aislamiento de venas pulmonares. Por lo tanto, este trabajo proporciona herramientas de decisión a partir del estudio de los resultados de la segmentación de cicatrices obtenidas en un conjunto de pacientes.
Referencias
1. Marisol Ruiz-Meana, Marta Minguet, Diana Bou-Teen, et. Ryanodine Receptor Glycation Favors Mitochondrial Damage in the Senescent Heart. Originally published 25 Oct 2018. Circulation. 2018;0.
2. Marta Núñez-García, Óscar Cámara, Mark D. O'Neill, Reza Razavi, Henry Chubb, Konstantine Butakoff (2018),"Mind the gap: Quantification of incomplete Ablation patterns after Pulmonary vein isolation using minimum path search", Medical Image Analysis, edición avanzada en línea. https://doi.org/10.1016/j.media.2018.10.001.




