Redacción Farmacosalud.com
Científicos del Instituto de Investigación Biomédica (IRB Barcelona) han dado el primer paso de lo que podría suponer la creación de un anticonceptivo masculino con potencial para llegar a interrumpir irreversiblemente la producción de espermatozoides, las células sexuales masculinas involucradas en la fecundación. El primer paso de estos científicos, liderados por el investigador ICREA Ángel R. Nebreda, se ha completado una vez que han logrado descubrir -tal y como han publicado en ‘Nature Communications’- que la proteína RingoA es un regulador fundamental de la meiosis, proceso de división celular por el que se producen óvulos y espermatozoides para la reproducción sexual de mamíferos. En concreto, han hallado que RingoA es un activador fundamental de la proteína Cdk2, la quinasa con la que forma un complejo necesario para llevar a cabo la meiosis.

Profesor Ángel R. Nebreda
Fuente: IRB Barcelona
Así pues, no sería irrazonable pensar en desarrollar un anticonceptivo masculino basado en inhibidores para RingoA-Cdk2. Teniendo en cuenta las características de la proteína RingoA-Cdk2 y que los hombres producen espermatozoides durante prácticamente toda la edad adulta, esos hipotéticos anticonceptivos masculinos, en caso de que se lograran elaborar, “probablemente deberían ser tomados regularmente”, explica a www.farmacosalud.com el profesor Nebreda. De todos modos, “por los resultados que hemos visto en ratones, existe la posibilidad de que después de un periodo de uso continuado la producción de espermatozoides se interrumpa de forma irreversible. En cualquier caso, también dependería de la potencia de los compuestos y sus características farmacocinéticas”, puntualiza el investigador.
Los ratones sin RingoA están aparentemente sanos pero son completamente estériles
Las células sexuales, a diferencia de las células del resto del organismo, contienen la mitad de cromosomas (son haploides) debido a su especial división celular. En la meiosis, a partir de una célula precursora -células germinales primordiales- se obtienen durante la espermatogénesis cuatro espermatozoides, mientras que en la ovogénesis se produce un solo ovocito (los otros tres degeneran durante el proceso). Los ratones sin RingoA obtenidos en el Laboratorio de Señalización y Ciclo Celular del profesor Nebreda están aparentemente sanos pero son completamente estériles, tanto machos como hembras. Tras tres años de experimentos, los investigadores postdoctorales del IRB Barcelona, Petra Mikolcevic y Michitaka Isoda, describen los desajustes moleculares que se producen durante la meiosis debido a la falta de esta proteína.
Con el estudio, los investigadores aportan nuevos datos sobre un proceso fundamental para todas las formas de vida que se reproducen sexualmente. “Todos empezamos con una meiosis, así que saber cómo funciona es intelectualmente muy interesante”, apunta Nebreda en unas declaraciones recogidas por IRB Barcelona. Aunque la meiosis se describió a finales del siglo XIX, “quedan muchos interrogantes abiertos”, apunta este científico galardonado con un proyecto del European Research Council. “No hay buenos modelos in vitro para estudiar la meiosis. Es difícil extraer los espermatozitos y hacer estudios en placas, hay que estudiarlos en los testículos. Y con los ovocitos todavía es peor porque en las hembras los óvulos se generan en las fases tempranas del desarrollo y trabajar con embriones es técnicamente complejo”.
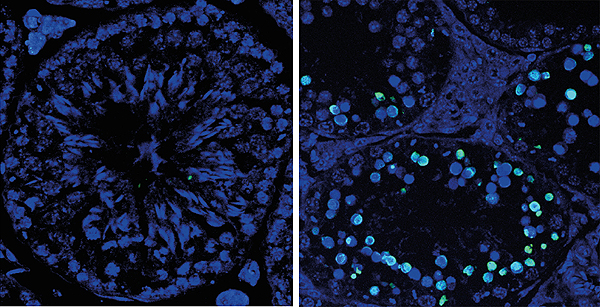
Estructura microscópica de tejido testicular de ratón. Izquierda, detalle de túbulo seminífero sano con espermátidas y espermatozoides. Derecha, los túbulos se encogen debido a la muerte masiva de células germinales (en verde)
Autor/a y fuente: Petra Mikolcevic, IRB Barcelona
Tal y como se ha destacado unas líneas más arriba, RingoA y Cdk2 forman un dúo esencial en la meiosis. El modelo genético de ratón sin Cdk2 publicado hace 12 años por el grupo de Mariano Barbacid en el CNIO es también viable pero estéril y presenta exactamente las mismas alteraciones en meiosis que el obtenido ahora por los investigadores del IRB Barcelona. “En biología, si obtienes dos fenotipos prácticamente indistinguibles es una indicación de que las proteínas ejercen la misma función y que pueden trabajar juntas”, detalla el profesor. Lo que no se sabía hasta ahora era que la pareja fundamental de Cdk2 en meiosis es RingoA, porque Cdk2 normalmente forma complejos con otro tipo de proteínas llamadas ciclinas.
Los análisis demuestran que RingoA funciona en los telómeros, unas estructuras que protegen los extremos de los cromosomas, y donde también se localiza Cdk2. En meiosis, los telómeros actúan como anclajes para que los cromosomas se agarren a la membrana nuclear, lo que permite a los cromosomas intercambiar trozos de ADN; este proceso de recombinación cromosómica es una característica esencial de la meiosis. Sin el complejo RingoA-Cdk2, los telómeros de los cromosomas no se anclan a la membrana, andan sueltos por el núcleo, la recombinación es caótica, no se reparan los cortes de ADN necesarios para intercambiar trozos y la meiosis no se puede completar. Como resultado, no se generan las células sexuales.
Lograr crear este anticonceptivo masculino, toda una previsible carrera de obstáculos
Nebreda expone abiertamente que, “si la industria quisiera invertir en este tema”, actualmente ya se tienen “las técnicas bioquímicas a punto” para buscar inhibidores. Con todo, el proceso para intentar encontrar ese anticonceptivo masculino sería largo, advierte el profesor desde www.farmacosalud.com: “La identificación de compuestos que inhiban el complejo quinasa podrían ser 3-4 años, dependiendo de los recursos disponibles. Las consecuentes modificaciones para aumentar efectividad y especificidad y el desarrollo a partir de estos compuestos de un fármaco que pueda ser utilizado en humanos es difícil de predecir, pero fácilmente serían 10 años”.
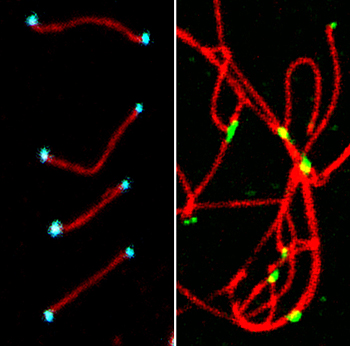
Sin RingoA, los telómeros (verde) -extremos de los cromosomas - se fusionan entre ellos lo que produce fallos en meiosis y muerte celular. Con la proteína en telómeros (azul), los cromosomas se mantienen separados
Autor/a y fuente: Petra Mikolcevic, IRB Barcelona
La carrera de obstáculos, pues, estaría garantizada. Habría una serie de contratiempos técnicos y biológicos que deberían sortearse para poder conseguir crear el susodicho anticonceptivo masculino, añade el investigador: “La identificación de compuestos que inhiban la actividad de una quinasa es teóricamente posible pero no está garantizada. En este caso concreto, el tema de la especificidad podría ser complicado, ya que idealmente el inhibidor debería afectar solo al complejo RingoA-Cdk2 pero no a otros complejos que incluyen la quinasa Cdk2 con diferentes subunidades. Por último, aunque los análisis genéticos indican que la eliminación de la proteína RingoA produce esterilidad, es posible que la inhibición química del complejo RingoA-Cdk2 no produzca un efecto igual de contundente. Por razones obvias, un efecto inhibitorio parcial no sería aceptable como anticonceptivo masculino”.
¿Un inhibidor de RingoA podría usarse como anticonceptivo femenino? Depende…
Dado que RingoA es un regulador fundamental de la meiosis, proceso de división celular por el que se producen óvulos y espermatozoides, hay que tener en cuenta que desde la pubertad, una vez al mes madura un ovocito. La pregunta parece obligada: ¿Un inhibidor RingoA-Cdk2 podría ser útil como anticonceptivo femenino?
“Nuestros resultados en ratones indican que RingoA-Cdk2 es esencial en los estadios iniciales de la profase durante la primera división meiótica, que en las mujeres se produce durante el desarrollo embrionario, por lo que en ausencia de RingoA no se forman los ovocitos. No obstante, un trabajo previo de nuestro grupo utilizando las ranas Xenopus ha demostrado que el complejo de XRingo (homóloga a RingoA de ratón) con Cdk1* es importante para la maduración de los ovocitos, es decir, para la reanudación de la primera división meiótica que se produce a partir de la pubertad en mujeres. Para abordar esa posibilidad en ratones haría falta utilizar un modelo genético que elimine la proteína RingoA específicamente en ovocitos, ya que en el modelo que hemos utilizado los problemas iniciales en la meiosis impiden que lleguen a formarse los ovocitos. Si se confirmase que la función observada en ranas está conservada en ratones, un inhibidor de la actividad quinasa asociada a RingoA podría ser potencialmente utilizable como anticonceptivo femenino”, responde el profesor.
En mujeres hay dos divisiones meióticas: la primera se inicia durante el desarrollo embrionario y queda interrumpida, reanudándose a partir de la pubertad. En este punto se completa la primera división y se inicia la segunda. La segunda división meiótica queda a su vez interrumpida y no se completa hasta que no ocurre la fecundación, si es que ésta llega a producirse. ¿Así pues, en caso de fecundación, dicho inhibidor interrumpiría el proceso hacia el embarazo? Según Nebreda, “por lo que sabemos hasta ahora, la proteína RingoA es esencial para la primera división meiótica pero no tenemos ninguna evidencia de que participe en la segunda división meiótica ni en la fecundación”.
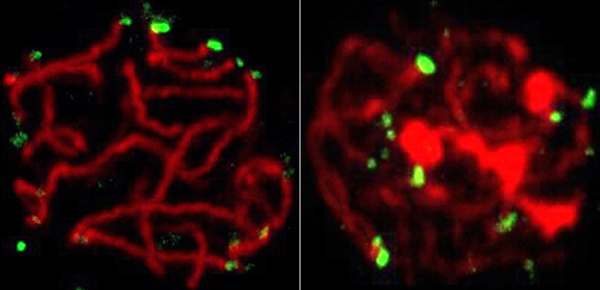
Corte transversal del núcleo celular. En la izquierda, los telómeros -extremos de los cromosomas- (en verde) están unidos a la membrana nuclear. Sin RingoA, los telómeros no se anclan bien, la meiosis se detiene y la célula muere
Autor/a y fuente: Petra Mikolcevic, IRB Barcelona
El trabajo del equipo liderado por el profesor Nebreda ha recibido el apoyo de la Fundación BBVA, del Ministerio de Economía y Conocimiento y del programa CO-FUND FP7 de la Unión Europea.
* Cdk1 y Cdk2 son dos proteína-quinasas distintas pero que están muy relacionadas y pueden ser ambas activadas por RingoA. No obstante, desempeñan distintas funciones. Análisis genéticos en ratón han demostrado que Cdk2 es esencial en los estadios iniciales de la profase durante la primera división meiótica, mientras que Cdk1 no participa. Sin embargo, la reanudación de la primera división meiótica, lo que se denomina maduración meiótica, está regulada por Cdk1 pero no por Cdk2. Esto es consistente con los resultados que observamos en Xenopus indicando que la función de XRingo (RingoA) durante la maduración de los ovocitos estaría mediada por Cdk1.
Artículo de referencia:
'Essential role of the Cdk2 activator RingoA in meiotic telomere tethering to the nuclear envelope'. Petra Mikolcevic, Michitaka Isoda, Hiroki Shibuya, Ivan del Barco Barrantes, Ana Igea, Jose´ A. Suja, Sue Shackleton, Yoshinori Watanabe & Angel R. Nebreda. Nature Comms. (2016, 30 March): doi: 10.1038/NCOMMS11084




