Redacción Farmacosalud.com
La compañía Novartis ha anunciado que el Comité Independiente de Monitorización de Datos de MONALEESA-2 recomendó detener el ensayo de forma anticipada, ya que los resultados del análisis intermedio previsto demostraron que el ensayo ha cumplido el objetivo primario de mejora clínicamente significativa de la SLP[1]. MONALEESA-2 es un ensayo clínico Fase III de LEE011 (ribociclib), un inhibidor de quinasa dependiente de ciclina (CDK4/6), en combinación con letrozol comparado con letrozol solo, en mujeres postmenopáusicas que no se habían sometido a ninguna terapia anterior para cáncer de mama avanzado receptor hormonal positivo y receptor 2 del factor de crecimiento epidérmico humano negativo (HR+/HER2-)[1].
Novartis evaluará la posibilidad de iniciar programas de acceso expandido en ciertas regiones para garantizar que las mujeres puedan beneficiarse de LEE011. Los acontecimientos adversos observados con LEE011 en combinación con letrozol en MONALEESA-2 fueron coherentes en general con sus respectivos perfiles de acontecimientos adversos conocidos[1]. El ensayo MONALEESA-2 continuará evaluando los datos de supervivencia global. Los datos detallados de seguridad y eficacia se presentarán en un importante congreso médico y Novartis iniciará conversaciones con las autoridades sanitarias globales para las solicitudes de registro.
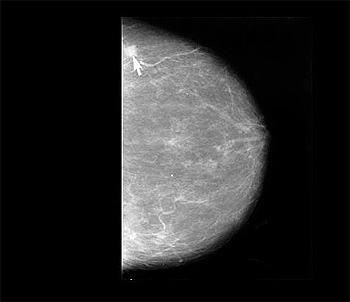
Mamografía que muestra un cáncer de mama (indicado con la flecha)
NIH Senior Health
Fuente: Viquipèdia / Wikipedia
Ribociclib, un inhibidor de quinasa dependiente de ciclina (CDKi)
MONALEESA-2 (Mammary ONcology Assessment of LEE011’s Efficacy and SAfety-2) es un ensayo aleatorizado, doble ciego, controlado por placebo, multicéntrico, de registro global de Fase III para evaluar la seguridad y eficacia de LEE011 en combinación con letrozol comparado con letrozol solo, en mujeres postmenopáusicas con cáncer de mama avanzado HR+/HER2- que no se habían sometido a ninguna terapia previa para el cáncer de mama avanzado[1]. El estudio se realizó en 294 centros clínicos de todo el mundo, aleatorizando a 668 pacientes en razón 1:1 estratificados según la presencia de metástasis hepáticas y/o pulmonares[1]. Las pacientes recibieron LEE011 600 mg/día o el placebo (tres semanas sí y una no), en combinación con letrozol 2,5 mg/día conforme a la indicación aprobada[1]. El objetivo primario del ensayo era la SLP[1]. Los objetivos secundarios incluían: supervivencia global, tasa de respuesta global, tasa de beneficio clínico, calidad de vida asociada a la salud, seguridad y tolerabilidad[1].
LEE011 (ribociclib) es un inhibidor de quinasa dependiente de ciclina (CDKi), un nuevo tipo de fármaco que ayuda a ralentizar la progresión del cáncer inhibiendo dos proteínas llamadas quinasas dependientes de ciclinas 4 y 6 (CDK4/6). Si dichas proteínas están sobreactivadas en una célula, pueden provocar que las células cancerígenas se desarrollen y se dividan demasiado rápido. LEE011 se ha estudiado en modelos no clínicos y actualmente se está evaluando en combinación con otros agentes endocrinos dentro del programa de ensayos clínicos MONALEESA. Actualmente, LEE011 no ha sido aprobado para ninguna indicación ni en ningún mercado. El ensayo MONALEESA-3 está evaluando LEE011 en combinación con fulvestrant, comparado con fulvestrant solo en hombres y mujeres postmenopáusicas con cáncer de mama avanzado HR+/HER2- que no hubiesen recibido ninguna terapia endocrina o hubiesen recibido como máximo una terapia endocrina previa. El ensayo MONALEESA-7 investiga LEE011 en combinación con terapia endocrina y goserelina, comparado con terapia endocrina y goserelina sola en mujeres premenopaúsicas con cáncer de mama avanzado HR+/HER2- que no hubiesen recibido ninguna terapia endocrina previa. Ambos programas de Fase III, MONALEESA-3 y MONALEESA-7, están reclutando pacientes en todo el mundo.
Tumor mamario avanzado: incluye cáncer de mama Fase IV y Fase III
El cáncer de mama avanzado incluye el cáncer de mama metastásico (Fase IV) y el cáncer de mama localmente avanzado (Fase III)[2]. El cáncer de mama metastásico es la forma más grave de esta enfermedad y se produce cuando el cáncer se extiende a otras partes del cuerpo, como el cerebro, el hígado o los huesos[2]. El cáncer de mama localmente avanzado se produce cuando el cáncer se extiende a los nódulos linfáticos y/u otros tejidos en la zona mamaria, pero no a otras partes del cuerpo más alejadas[2]. El cáncer de mama avanzado HR+/HER2- es el tipo más común de cáncer de mama avanzado; se estima que cada año se diagnostica a 220.000 mujeres en todo el mundo[3,4]. El cáncer de mama avanzado HR+ es un grupo de cánceres que expresan receptores para ciertas hormonas, como estrógenos y progesterona[5]. El desarrollo de las células cancerígenas puede estar motivado por estas hormonas[5].

Doctora Ana Lluch
Fuente: Dra. Lluch / Fundación Investigación H. Clínico de Valencia
Instituto de Investigación Sanitaria INCLIVA (Archivo)
Fulvestrant alcanza su objetivo de eficacia en cáncer de mama avanzado
Por otro lado, la compañía biofarmacéutica AstraZeneca ha anunciado los resultados positivos del ensayo clínico de fase III, FALCON, en el que se compara fulvestrant 500 mg (Faslodex®) con anastrozol 1 mg (Arimidex®) para el tratamiento del cáncer de mama localmente avanzado o metastásico en mujeres posmenopáusicas que no habían recibido ningún tratamiento hormonal previo para su cáncer de mama con receptores hormonales positivos (RH+). El estudio FALCON ha demostrado la superioridad de fulvestrant 500 mg con respecto a anastrozol 1 mg y ha alcanzado su objetivo primario de prolongar la supervivencia libre de progresión (SLP/PFS). Según la doctora Ana Lluch, jefa del Servicio de Oncología del Hospital Clínico Universitario de Valencia, “los datos actuales demuestran la superioridad de fulvestrant frente a anastrozol; por lo tanto, si la evidencia científica se confirma, estaríamos ante un estándar de primera línea del tratamiento hormonal en pacientes post-menopáusicas con receptores positivos. Su mecanismo de acción le hace un fármaco muy atractivo por ser diferente a los tratamientos hormonales de los que se dispone en la actualidad”.
En general, el ensayo FALCON mostró un perfil de acontecimientos adversos en línea con los datos actualmente disponibles sobre el perfil de seguridad de este medicamento.
‘Historias de mujeres: primera parada China’
‘Historias de Mujeres’ es un proyecto único, un documento de investigación desarrollado por primera vez en el mundo y que se plasmará en la realización de cinco documentales en cinco países diferentes. Los reportajes son una idea original de la Dra. Laura G. Estévez, directora de la Unidad de Mama del Centro Integral Oncológico Clara Campal HM CIOCC y cuenta con el aval del Instituto de la Mujer (Ministerio de Sanidad, Servicios Sociales e Igualdad), ha informado HM Hospitales.

Presentación del proyecto 'Historias de Mujeres'
Fuente: HM Hospitales
La investigación recorre el itinerario de la enfermedad con un punto de vista multidisciplinar, desde el diagnóstico hasta el posterior tratamiento y recuperación, incluyendo la dimensión psicológica y la perspectiva emocional. Los documentales tratarán de enfatizar la información necesaria para sensibilizar a la población sobre la importancia de la detección precoz del cáncer de mama. En el caso del trabajo realizado en Asia, se ha sometido a valoración su medicina pública, así como el papel ejercido por la medicina tradicional china a la hora de paliar / aliviar los efectos producidos por los tratamientos convencionales como la quimioterapia y hormonoterapia. China será en 2025 uno de los países con mayor incidencia de cáncer de mama, y según los investigadores chinos entrevistados, ese aumento de incidencia puede ser debido a factores ambientales, dietéticos y estilos de vida, entre otras causas.
Las variantes genéticas desconocidas en los genes BRCA, reto destacado
Aproximadamente el 7% de los cánceres de mama y entre el 11 y el 15% de los cánceres de ovario se asocian a una predisposición hereditaria que en un porcentaje considerable está relacionada con los genes BRCA1 y BRCA2[6]. El avance en la investigación frente a estos tipos de cáncer ha tenido como resultado el desarrollo de nuevos tratamientos como la primera terapia personalizada en cáncer de ovario, indicada en tumores con mutación del gen BRCA.
Sin embargo, en la determinación de estas mutaciones, los especialistas pueden encontrar variantes genéticas de significado incierto en estos genes, cuyo papel es aún una incógnita. “Quizá sea uno de los mayores retos a los que nos enfrentamos, ya que es un resultado no informativo que supone un problema importante a la hora de ofrecer consejo genético a las pacientes. Hasta hace pocos años había poca información disponible para el manejo de estas variantes, pero en la última década han surgido multitud de herramientas que nos permiten ‘enfrentarnos’ a las variantes de significado desconocido. En una población bien caracterizada como la nuestra, estas herramientas nos permiten reducir el porcentaje de variantes de significado desconocido a no más de un 10%”, asegura la Dra. Ana Osorio, investigadora del Centro Nacional de Investigaciones Oncológicas (CNIO), durante el Workshop ‘Análisis de variantes en BRCA y sus implicaciones clínicas’, han apuntado desde la compañía biofarmacéutica AstraZeneca.
Autor/a de la imagen: Babita Singh
Fuente: UPF
Hallado un nuevo mecanismo molecular implicado en el desarrollo de cáncer
El grupo de investigación en Genómica Computacional de la Universidad Pompeu Fabra (UPF, en Barcelona) ha descubierto nuevas alteraciones vinculadas a cáncer y ha puesto de relieve la importancia del transcriptoma en el desarrollo de tumores. Por primera vez, científicos estudian la variabilidad del transcriptoma celular en varios tumores a la vez, es decir, no se centran en el ADN, sino en los productos que se extraen de él. Los resultados del estudio[7] aparecen en la revista ‘Genome Research’.
La información genética de las células se encuentra codificada en la cadena de ADN. Esta información es leída por la maquinaria celular, que primero generará el llamado ARN para después traducirlo a proteínas. Se trata de un proceso que requiere una regulación muy minuciosa. En ocasiones, el mismo gen puede dar lugar a distintas moléculas de ARN, las cuales producen diferentes proteínas, con funciones potencialmente muy diversas. Esto se debe al proceso conocido como ‘splicing alternativo’. Este splicing alternativo influye en la síntesis de la mayoría de las proteínas de las células eucariotas y su regulación depende de las proteínas de unión al ARN (RBPs, en sus siglas en inglés).
A pesar de que la relevancia del splicing alternativo en el funcionamiento celular es ampliamente conocida por la comunidad científica, el papel que juega en cáncer no ha hecho más que empezar a aflorar. Esto ha sido posible gracias a las nuevas técnicas de secuenciación y la disponibilidad de datos de secuencias de ARN de múltiples tumores a través de proyectos como el Atlas del Genoma de Cáncer (TCGA en sus siglas en inglés). Aunque el cáncer se origina a partir de mutaciones en el ADN, éstas tienen un impacto en el conjunto de moléculas de ARN de la célula, conocido como transcriptoma, que puede inducir y sostener mecanismos vinculados al desarrollo del cáncer. El equipo de investigación liderado por Eduardo Eyras, jefe del laboratorio de Genómica Computacional, ha descubierto ciertas alteraciones en las RBPs que generan cambios en el splicing alternativo vinculados con el desarrollo de cáncer.
Realizado en tiempo récord un análisis del ARN de más de 4.000 muestras tumorales
Gracias a herramientas bioinformáticas diseñadas por el propio grupo de investigación, los científicos han podido realizar, en tiempo récord y usando recursos computacionales limitados, un análisis exhaustivo del ARN de más de 4.000 muestras tumorales de once tipos diferentes de cáncer extraídas del proyecto TCGA. Este análisis demuestra que las proteínas ligadas al ARN se encuentran con mucha frecuencia alteradas en los tumores humanos y que dichas alteraciones determinan el transcriptoma de las células e induce transformaciones celulares ligadas al desarrollo de cáncer. Dichas alteraciones habían permanecido invisibles hasta ahora a los métodos usados en grandes proyectos de análisis de genomas de cáncer.
En colaboración con los doctores Juan Valcárcel y Belén Miñana del Centro de Regulación Genómica (CRG), y los doctores Miguel Ángel Pujana y Francesca Mateo del Instituto Catalán de Oncología (ICO), los autores han demostrado que introduciendo las alteraciones identificadas del transcriptoma en células no tumorales, éstas adquieren propiedades tumorales. Además de ampliar nuestros conocimientos sobre el papel de las RBPs en los tumores, los resultados destacan la importancia del splicing alternativo como mecanismo complementario en el desarrollo de cáncer, convirtiéndose en un nuevo factor a tener en cuenta en el estudio de esta enfermedad. Esta investigación abre nuevas vías para entender la biología del cáncer y buscar nuevas estrategias terapéuticas. Tal y como comentan los autores, “las alteraciones en el splicing alternativo son particularmente importantes en el contexto de tumores que no albergan mutaciones conocidas para las que se ha descrito una terapia y, por tanto, pueden abrir nuevas oportunidades para entender la biología del tumor y buscar nuevas terapias”.
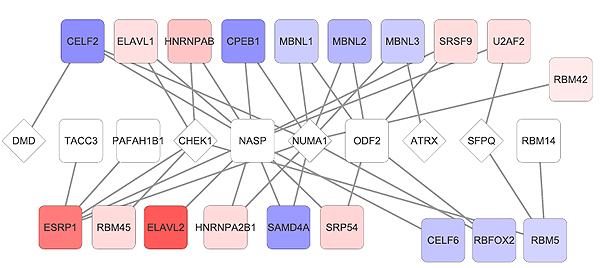
Red de regulación de splicing en genes del ciclo celular en cáncer de mama. Entre otros resultados, los autores han descrito la red de proteínas que interaccionan con el RNA (RBPs) que aumentan (rojo) o disminuyen (azul) su expresión en cáncer de mama, y controlan el splicing alternativo de genes relevantes para el ciclo celular. Algunos de estos genes se habían relacionado anteriormente con cáncer (rombos). En el caso de NUMA1, su papel en cáncer es aún desconocido. En este trabajo, los autores muestran que el splicing alternativo de NUMA1 induce propiedades tumorales en células normales de mama
Fuente: UPF
La inmunoterapia, posible alternativa en cáncer de mama triple negativo
Entre un 10 y un 15 por ciento de las pacientes con cáncer de mama pertenecen al subtipo triple negativo, el subtipo con menos porcentaje de supervivencia, tasas de respuesta y opciones de tratamiento. De media, la supervivencia de una paciente con tumor mamario triple negativo (CMTN) en estadio metastásico es inferior a dos años. Por eso, el grupo de investigación cooperativo SOLTI ha celebrado su Simposio de Primavera bajo el título ‘Cáncer de mama triple negativo: ¿dónde estamos y a dónde vamos?’. “En el subtipo HER2+ se han lanzado varios fármacos que impactan claramente en la supervivencia de las pacientes; en los tumores con receptores hormonales positivos, también hay tratamientos hormonales y fármacos capaces de revertir las resistencias; el problema en el cáncer de mama triple negativo es que no hay un tratamiento propiamente efectivo para este subgrupo”, señala la doctora Eva Muñoz, socia de SOLTI y miembro del grupo de cáncer de mama y melanoma del Hospital Universitario Vall d’Hebron de Barcelona.
Una situación que podría cambiar en los próximos años ya que, como dice Muñoz, “estamos en un momento en el que la inmunoterapia es ya una realidad para muchos tumores como el melanoma o el cáncer de pulmón y, ahora, también podría serlo para el CMTN”. De momento, la evidencia científica que empieza a emerger apunta a que el grupo triple negativo sería el que podría obtener un mayor beneficio de estas terapias, si bien todavía se están llevando a cabo ensayos, tanto en monoterapia como en combinación con quimioterapia. “Todavía tenemos que analizar los resultados de fase III en inmunoterapia para el CMTN”, subraya esta facultativa, quien destaca también que la investigación se centra ahora en “la manera de favorecer que el entorno tumoral en CMTN sea más respondedor a la inmunoterapia”.

Un instante del Simposio de Primavera
Fuente: SOLTI / Berbés Asociados
Referencias
1. Archivo de datos de Novartis
2. American Cancer Society. How do you determine the stage of breast cancer? Disponible en: http://www.cancer.org/cancer/breastcancer/detailedguide/breast-cancer-staging. Accessed May 10, 2016.
3. Dobrescu A, et al. Study of Estrogen Receptor and Progesterone Receptor Expression in Breast Ductal Carcinoma In Situ by Immunohistochemical Staining in ER/PgR-Negative Invasive Breast Cancer. International Scholarly Research Network. 2011;2011:1-5.
4. Buckley N, et al. Breast Cancer. Decision Resources. March 2011:1-301.
5. Redmond C. Breast Cancer Hormone Therapy Options. Disponible en: http://christineredmond.suite101.com/breast-cancer-hormone-therapy-options-a197304. Accessed December 1, 2014.
6. SEOM clinical guidelines in Hereditary Breast and ovarian cancer. G. Llort, I. Chirivella, R. Morales, R. Serrano, A. Beatriz Sanchez, A. Teule, E. Lastra, J. Brunet, J. Balmaña, B. Graña on behalf of the SEOM Hereditary Cancer Working Group. SEOM clinical guidelines in Hereditary Breast and ovarian cáncer
7. Endre Sebestyén, Babita Singh, Belén Miñana, et al. Large-scale analysis of genome and transcriptome alterations in multiple tumors unveils novel cancer-relevant splicing networks. Genome Research published online April 13, 2016. DOI:10.1101/gr.199935.115




