Redacción Farmacosalud.com
Un grupo de científicos ha desarrollado a partir de ingeniería genética 17T2, un agente activo frente a todas las variantes existentes del coronavirus SARS-CoV-2 (patógeno causante del COVID-19), incluidas las subvariantes de ómicron que circulan actualmente. Se trata de un anticuerpo monoclonal, una proteína del sistema inmunitario desarrollada en laboratorio, cuya efectividad ha sido probada en ratones. “En modelos in vivo, se ha probado únicamente frente a la variante ómicron BA.1, pero los resultados de estudios in vitro indican que podría tener la misma actividad frente a las subsecuentes variantes derivadas de ésta, así como contra los linajes pre-ómicron. En el modelo experimental que utilizamos, el animal desarrolla una forma leve de infección”, detalla la Dra. Giuliana Magri, líder del estudio ‘A monoclonal antibody targeting a large surface of the receptor binding motif shows pan-neutralizing SARS-CoV-2 activity’.

Dra. Giuliana Magri
Fuente: Hospital del Mar / IrsiCaixa
“Observamos, tanto en el tratamiento profiláctico como terapéutico, una reducción significativa de la carga viral en los pulmones y una disminución de las lesiones”, agrega a través de www.farmacosalud.com Magri, a su vez científica del Instituto de Investigación del Hospital del Mar (Barcelona) durante la elaboración de dicho trabajo.
Un agente con potencial para tratar a individuos inmunodeprimidos
A pesar de las capacidades profiláctico-preventivas de 17T2, este tipo de terapia no está pensada para ser una alternativa a la vacuna antiCOVID en la población general, “pero podría ser una herramienta muy valiosa para tratar a individuos inmunodeprimidos que por sí solos no pueden desarrollar una respuesta inmunitaria efectiva”, argumenta la especialista, quien agrega que el nuevo anticuerpo no ha causado ningún tipo de efecto secundario en ratones, es decir, “no tiene ninguna toxicidad en modelos murinos”.
“Contar con anticuerpos como el 17T2 es clave para poder proteger a personas inmunocomprometidas y con un riesgo elevado de desarrollar COVID-19 grave. Los resultados obtenidos nos demuestran que es posible diseñar herramientas capaces de bloquear todas las variantes de un mismo virus”, subraya el Dr. Julià Blanco, colíder del estudio e investigador IGTP en IrsiCaixa.
El nuevo ensayo ha sido realizado por el Instituto de Investigación del Hospital del Mar, el Instituto de Investigación de Sida IrsiCaixa -centro impulsado conjuntamente por la Fundación ‘la Caixa’ y el Departamento de Salud de la Generalitat de Catalunya-, el Centro Nacional de Biotecnología -perteneciente al Consejo Superior de Investigaciones Científicas (CNB-CSIC)- y la Unidad de Tecnologías de Proteínas del Centro de Regulación Genómica (CRG). El estudio, en el que también ha participado un equipo científico del CIBER de Enfermedades Infecciosas (CIBERINFEC), ha sido publicado en la revista ‘Nature Communications’.

El Dr. Julià Blanco trabajando en la nueva investigación
Fuente: Hospital del Mar / IrsiCaixa
Se escogieron defensas específicas que actuaban contra la espícula patógena
El aislamiento del nuevo anticuerpo ha sido posible gracias a las muestras de sangre de un paciente infectado por el SARS-CoV-2 en marzo de 2020, durante la primera ola de la pandemia de COVID. A partir de estas muestras, se seleccionaron algunos linfocitos B, las células de la sangre encargadas de producir los anticuerpos. En concreto, se escogieron aquellos que generaban defensas específicas contra la proteína de la espícula viral, que es la que permite al virus infectar las células humanas, multiplicarse y desencadenar el COVID-19.
El personal investigador reprodujo, utilizando técnicas de ingeniería genética, estos agentes celulares en el laboratorio. Una vez conseguido esto, evaluaron in vitro su actividad neutralizante, es decir, su capacidad de unirse al virus y bloquearlo, ante las diferentes variantes del SARS-CoV-2 existentes hasta el momento. Así, pudieron seleccionar el anticuerpo que conseguía neutralizarlas todas, incluyendo XBB.1.16 i BA.2.86, de las cuales se derivan los linajes que más preocupan actualmente. “Nuestro anticuerpo mantiene la actividad neutralizante ante todas las variantes del SARS-CoV-2”, asegura la Dra. Magri mediante un comunicado.
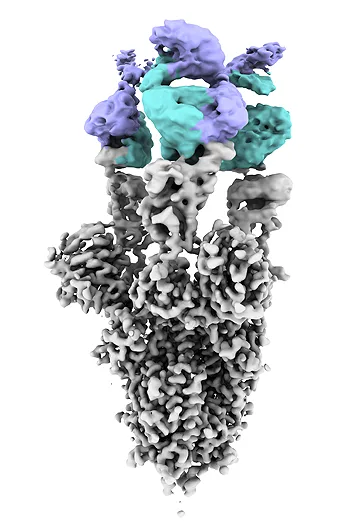
Imagen obtenida por criomicroscopía electrónica de la proteína spike del virus SARS-CoV-2 (en gris) con el nuevo anticuerpo unido (zona destacada en colores vivos)
Autoría: Andrea Modrego, CNB-CSIC
Fuente: Hospital del Mar / IrsiCaixa
Por su parte, el Dr. Benjamin Trinité, uno de los primeros autores del estudio e investigador sénior de IrsiCaixa, destaca la importancia del descubrimiento y menciona que “las últimas variantes del virus han incorporado decenas de mutaciones que dificultan el trabajo de los anticuerpos desarrollados con anterioridad, ya que no se pueden unir con tanta eficacia. Contar con un tratamiento que sea eficaz, a pesar de que aparezcan nuevas variantes del SARS-CoV-2, puede cambiar las reglas de juego a la hora de combatir la infección”.
¿Cuándo se iniciarán las pruebas en personas?
El equipo llevó a cabo un análisis detallado de la estructura del anticuerpo unido a la proteína espícula para poder entender el funcionamiento de 17T2 y, además, para determinar cómo consigue mantener su actividad neutralizante a pesar de las mutaciones acumuladas por el virus del SARS-CoV-2. Este estudio estructural, realizado en el CNB-CSIC por el equipo de la Dra. Rocío Arranz, colíder del nuevo trabajo, permite sostener -en palabras de Arranz- que "este anticuerpo tiene la capacidad de unirse a una amplia zona de la espícula del virus, lo que le confiere la habilidad de neutralizar todas las variantes y prevenir que nuevas mutaciones evadan esta neutralización. Esto sugiere que, en esta área de interacción, existe una región conservada en la espícula, la cual podría ser esencial para la capacidad del virus de infectar células humanas".
Antes de dar un uso generalizado a 17T2, habrá que llevar a cabo un ensayo clínico en humanos. De acuerdo con la Dra. Magri, por ahora se desconoce cuándo se iniciarán las pruebas en personas. Por lo pronto -remarca-, “el anticuerpo está patentado y la posibilidad de que se desarrollen ensayos clínicos en humanos depende del interés de las casas farmacéuticas en este producto”.
El proyecto de investigación que ha dado lugar al hallazgo del nuevo anticuerpo ha recibido el apoyo de las ayudas de la convocatoria COVID-19 de la Generalitat de Catalunya, así como del programa de investigación Miguel Servet, y ha sido parcialmente financiado por la campaña de mecenazgo #YoMeCorono y la Fundación Glòria Soler.
Artículo de referencia
De Campos-Mata L, Trinité B., Modrego A. Tejedor Vaquero S, Pradenas E, Pons-Grífols A, et al. A monoclonal antibody targeting a large surface of the receptor binding motif shows pan-neutralizing SARS-CoV-2 activity. Nat Commun. 2024;15(1):1051.




