Redacción Farmacosalud.com
Un equipo de investigación codirigido por el Instituto de Bioingeniería de Cataluña (IBEC) y el Hospital West China de la Universidad de Sichuan (WCHSU) en colaboración con investigadores del Reino Unido, ha demostrado una estrategia basada en nanotecnología que revierte la enfermedad de Alzheimer en ratones. A diferencia de la nanomedicina tradicional, que se basa en nanopartículas como portadoras de moléculas terapéuticas, este enfoque emplea nanopartículas que son bioactivas en sí mismas, es decir, ‘fármacos supramoleculares’. En lugar de dirigirse directamente a las neuronas, la novedosa terapia restaura la función adecuada de la barrera hematoencefálica (BBB por sus siglas en inglés), el ‘guardián vascular’ que regula el entorno del cerebro. Al reparar esta interfaz crítica, los investigadores lograron revertir la patología del Alzheimer en modelos animales.
El cerebro es el órgano más caro del cuerpo, ya que consume el 20% de la energía en adultos y hasta el 60% en niños. Esta energía llega a través de un vasto suministro de sangre, asegurado por un sistema vascular único y denso donde cada neurona se nutre de un capilar. El cerebro humano contiene aproximadamente mil millones de capilares, lo que destaca el papel vital del sistema vascular cerebral en el mantenimiento de la salud y la lucha contra las enfermedades. Estos hallazgos resaltan el papel crucial de la salud vascular, especialmente en enfermedades como la demencia y el Alzheimer, que se relacionan con un sistema vascular comprometido.
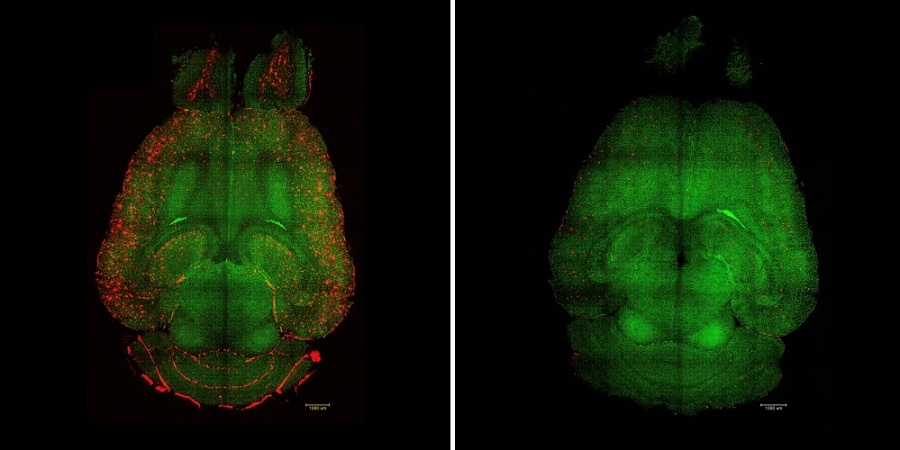
A la izquierda de la imagen, cerebro de ratón no tratado / a la derecha, cerebro tratado
Fuente: IBEC
‘Proteínas de desecho’
La BBB es una barrera celular y fisiológica que separa el órgano cerebral del flujo sanguíneo para protegerlo de peligros externos como patógenos o toxinas. El equipo de investigadores demostró que enfocar a un mecanismo específico permite que las ‘proteínas de desecho’ indeseadas producidas en el cerebro atraviesen esta barrera y se eliminen en el flujo sanguíneo correctamente. En la enfermedad de Alzheimer, la principal proteína ‘de desecho’ es la amiloide-β (Aβ), cuya acumulación perjudica el funcionamiento normal de las neuronas.
Los científicos utilizaron modelos de ratón que están programados genéticamente para producir mayores cantidades de proteína Aβ y desarrollar un deterioro cognitivo significativo que imita la patología del Alzheimer. Administraron solo 3 dosis de los fármacos supramoleculares y posteriormente monitorearon regularmente la evolución de la enfermedad. "Solo 1 hora después de la inyección observamos una reducción del 50-60% en la cantidad de Aβ dentro del cerebro", explica Junyang Chen, primer coautor del estudio, investigador del Hospital West China de la Universidad de Sichuan y estudiante de doctorado del University College London (UCL).
Éxito total en un ratón de 18 meses (comparable a un humano de 90 años)
Los datos más llamativos fueron los efectos terapéuticos. Así, se llevaron a cabo varios experimentos para analizar el comportamiento de los animales y medir el deterioro de la memoria durante varios meses, cubriendo todas las etapas de la afección. En uno de los experimentos, trataron a un ratón de 12 meses (equivalente a un humano de 60 años) con las nanopartículas y analizaron su comportamiento después de 6 meses. El resultado fue impresionante: el animal, de 18 meses (comparable a un humano de 90 años), había recuperado el comportamiento de un ratón sano.

El investigador Xiaohe Tian (a la izq. de la imagen) y el Prof. Giuseppe Battaglia
Fuente: IBEC
"El efecto a largo plazo proviene de la restauración del sistema vascular del cerebro. Creemos que funciona como una cascada: cuando se acumulan especies tóxicas como la beta amiloide (Aβ), la enfermedad progresa. Pero una vez que la vascularización puede funcionar nuevamente, empieza a eliminar Aβ y otras moléculas dañinas, lo que permite que todo el sistema recupere su equilibrio. Lo más relevante es que nuestras nanopartículas actúan como un fármaco y parecen activar un mecanismo de retroalimentación que devuelve esta vía de eliminación a niveles normales", comenta Giuseppe Battaglia, Prof. de investigación ICREA en el IBEC, investigador principal del Grupo de Biónica Molecular y líder del estudio.
Fármacos supramoleculares: actúan como un interruptor que restablece el sistema
En el Alzheimer, uno de los problemas clave es que el sistema natural de eliminación del cerebro para toxinas como la proteína amiloide-β deja de funcionar correctamente. Normalmente, la proteína LRP1 actúa como un guardián molecular: reconoce Aβ, se une a ella por ligandos y la transporta a través de la barrera hematoencefálica hacia el torrente sanguíneo, donde se puede eliminar. Pero este sistema es frágil. Si LRP1 se une a demasiada a Aβ y con demasiada fuerza, el transporte se obstruye y la proteína misma se degrada dentro de las células de barrera hematoencefálica, dejando menos LRP1 portadores disponibles. Por otro lado, si se une a muy poca Aβ, la señal es demasiado débil para activar el transporte. En ambos casos, el resultado es el mismo: la proteína Aβ se acumula dentro del cerebro.
Los fármacos supramoleculares desarrollados en el nuevo trabajo actúan como un interruptor que restablece el sistema. Al imitar los ligandos de LRP1, pueden unirse a Aβ, cruzar la barrera hematoencefálica e iniciar el proceso de eliminación de especies tóxicas del cerebro. De esta manera ayudan a restaurar el papel natural del sistema vascular como vía de limpieza de desechos y restablecen su función adecuada.
Ingeniería molecular bottom-up
En este estudio, los investigadores introducen nanopartículas que actúan como fármacos supramoleculares, agentes terapéuticos por sí solos en lugar de portadores de medicamentos. Diseñadas con un enfoque de ingeniería molecular bottom-up (de abajo arriba), estas nanopartículas combinan un control de tamaño preciso con un número definido de ligandos en la superficie, creando una plataforma multivalente capaz de interactuar con los receptores celulares de una manera muy específica. Al participar en el tráfico de receptores en la membrana celular, abren una forma única y novedosa de modular la función del receptor. Esta precisión no sólo permite la eliminación efectiva de la proteína amiloide-β del cerebro, sino que también restaura el equilibrio del sistema vascular que mantiene una función cerebral saludable.
La innovadora propuesta de terapia ofrece una vía prometedora para desarrollar intervenciones clínicas efectivas, abordar las contribuciones vasculares a la enfermedad de Alzheimer y, en última instancia, mejorar los resultados de los pacientes. “Nuestro estudio demostró una notable eficacia para lograr una rápida eliminación de Aβ, restaurar la función saludable en la barrera hematoencefálica y conducir a una sorprendente reversión de la patología del Alzheimer”, concluye la Dra. Lorena Ruiz Pérez, investigadora del grupo de Biónica Molecular del Instituto de Bioingeniería de Cataluña (IBEC) y Profª adjunta Serra Hunter de la Universidad de Barcelona (UB).

Profs. Giuseppe Battaglia y Lorena Ruiz Pérez
Fuente: IBEC
El estudio es fruto de una colaboración entre el Instituto de Bioingeniería de Cataluña (IBEC), el Hospital West China de la Universidad de Sichuan, Hospital Xiamen West China de la Universidad de Sichuan, el University College de Londres (Reino Unido), el Xiamen Key Laboratory of Psychoradiology and Neuromodulation, la Universidad de Barcelona, la Academia China de Ciencias Médicas y la Institución Catalana de Investigación y Estudios Avanzados (ICREA).
Artículo de referencia
Chen J, Xiang P, Duro-Castano A, Cai H, Guo B, Liu X, et al. Multivalent modulation of endothelial LRP1 induces fast neurovascular amyloid-β clearance and cognitive function improvement in Alzheimer’s disease models. Signal Transduction and Targeted Therapy (2025). DOI: 10.1038/s41392-025-02426-1.




