Redacción Farmacosalud.com
Guselkumab, un anticuerpo monoclonal anti-interleucina-23, tiene una eficacia significativa en comparación con el inhibidor del factor de necrosis tumoral Humira® en todos los principales criterios de valoración del estudio a lo largo de 48 semanas de tratamiento. Por otro lado, los datos preliminares a doce semanas de un estudio de extensión abierto fase 2 muestran el mantenimiento o mejora de las respuestas cutáneas en los pacientes que cambiaron de ustekinumab a risankizumab.
Nuevos datos de fase 3 de guselkumab
En el 25º Congreso de la Academia Europea de Dermatología y Venereología (EADV), se han mostrado por primera vez los resultados del primero de los tres estudios pivotales de fase 3 en los que se ha evaluado guselkumab, un anticuerpo monoclonal anti-interleucina (IL)-23 administrado por vía subcutánea, para el tratamiento de pacientes adultos con psoriasis en placas de moderada a grave. Los datos del ensayo VOYAGE 1 indican que un porcentaje significativamente mayor de pacientes tratados con guselkumab consigue el aclaramiento o mínima enfermedad en comparación con los pacientes que reciben placebo, definidos como una mejoría de al menos un 90% en la Psoriasis Area Severity Indez (PASI 90) y una puntuación IGA (Evaluación Global de Investigador) de 0 (aclaramiento) o 1 (enfermedad mínima) en semana 16, ambos objetivos primarios del estudio.[1] En el ensayo VOYAGE 1 también se incluyó un grupo de tratamiento con un fármaco comparador activo en el que se evaluaba guselkumab frente a Humira® (adalimumab), demostrándose la superioridad de guselkumab en los principales objetivos del estudio y durante las 48 semanas de tratamiento.[1]
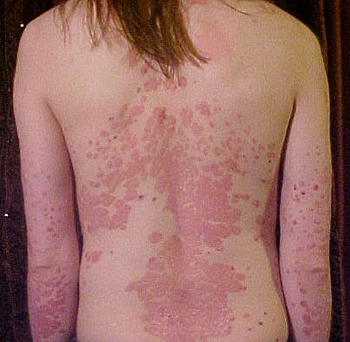
Un ejemplo de psoriasis
Autor/a de la imagen: User:The Wednesday Island (of the English Wikipedia) derivative work: James Heilman, MD (talk) - Psoriasis_on_back.jpg
Fuente: Wikimedia Commons
Guselkumab es un anticuerpo monoclonal humano con un mecanismo de acción novedoso que actúa sobre la proteína interleucina (IL)-23, y que se encuentra en fase 3 de desarrollo como un terapia administrada por vía subcutánea para la psoriasis en placas de moderada a grave. Además, está en marcha un estudio de fase 2 que evalúa guselkumab en el tratamiento de la artritis psoriásica activa de moderada a grave, informa Janssen.
"Los resultados del estudio VOYAGE 1 muestran tasas mayores de aclaramiento entre los pacientes con psoriasis en placas de moderada a grave tratados con guselkumab, y estas respuestas fueron duraderas y sostenidas hasta la semana 48", ha afirmado el Dr. Andrew Blauvelt, presidente del Centro de Investigación Médica de Oregón e investigador principal del estudio.* "Guselkumab ha mostrado también una eficacia superior en comparación con adalimumab, con una separación entre las respuestas evidente en la semana 16 y que se mantuvo durante todo el transcurso del ensayo".
Cumplidos los objetivos primarios en la semana 16
En el estudio VOYAGE 1 se cumplieron los objetivos primarios en la semana 16, habiendo conseguido aclaramiento (IGA 0) o enfermedad mínima (IGA 1) el 85,1% de los pacientes que recibieron guselkumab 100 mg las semanas 0 y 4 y posteriormente cada ocho semanas, frente al 6,9% de los pacientes tratados con placebo (P < 0,001).[1] Prácticamente tres cuartas partes de los pacientes tratados con guselkumab (73,3%) alcanzaron una respuesta PASI 90, o un aclaramiento casi completo, en comparación con el 2,9% de los pacientes que recibieron placebo (P< 0,001).[1]
Todos los objetivos secundarios fundamentales del estudio VOYAGE 1 alcanzaron significación estadística en las comparaciones establecidas entre guselkumab y adalimumab, administrado este último por vía subcutánea en las semanas 0 (80 mg) y 1 (40 mg) y después 40 mg cada dos semanas (P < 0,001 para todas las medidas).[1] En la semana 16, después de tres inyecciones de guselkumab y diez de adalimumab, un porcentaje significativamente mayor de pacientes tratados con guselkumab logró una puntuación IGA 0/1 y una respuesta PASI 90 (85,1% y 73,3%, respectivamente), en comparación con los pacientes tratados con adalimumab (65,9% y 49,7%, respectivamente) (P< 0,001).[1] En la semana 24, el porcentaje de pacientes que logró una respuesta PASI 90 fue significativamente mayor en el grupo de tratamiento con guselkumab que en el grupo de adalimumab (80,2% frente al 53,0%, respectivamente) (P< 0,001).[1]
Los niveles más altos de aclaramiento observados en el grupo de guselkumab se prolongaron hasta las semanas 24 y 48, alcanzando un número significativamente mayor de pacientes tratados con guselkumab una puntuación IGA 0/1 y una respuesta PASI 90, así como las medidas de aclaramiento completo, indicadas por una mejoría del 100% en la puntuación PASI (PASI 100) o una puntuación IGA de 0, en comparación con adalimumab (P< 0,001).[1] "Las altas y duraderas tasas de respuesta en forma de aclaramiento se asociaron a mejoras significativas de la calidad de vida en los pacientes tratados con guselkumab," señala Chris Griffiths, profesor de dermatología de la Universidad de Manchester y miembro del comité asesor del estudio.* "Los resultados del estudio VOYAGE 1 ofrecen la promesa de guselkumab como un potencial agente terapéutico para la psoriasis en placas, una enfermedad mediada por el sistema inmunitario".

Autor/a de la imagen: Derek Gavey
Fuente: Flickr / Creative Commons
El Índice de calidad de vida en dermatología (DLQI) evaluó la repercusión de la enfermedad sobre la calidad de vida de los pacientes del estudio y la mejoría de la enfermedad tras la terapia. En la semana 24, el 60,9% de los pacientes tratados con guselkumab alcanzó una puntuación de 0/1, que indica la ausencia de cualquier repercusión de la psoriasis sobre la calidad de vida relacionada con la salud, frente al 39,5% de los pacientes que recibieron adalimumab (P< 0,001).[1] Los pacientes tratados con guselkumab también mostraron una mejoría sustancial en la semana 48, obteniendo el 62,5% de ellos una puntuación DLQI de 0/1 frente al 38,9% de los pacientes tratados con adalimumab (P< 0,001).[1]
Hasta la semana 48 del estudio, los porcentajes de pacientes que refirieron al menos un efecto adverso (EA) fueron comparables entre guselkumab (73,9%) y adalimumab (74,5%); la proporción de pacientes que refirió EA graves fue también similar para guselkumab (4,9%) y adalimumab (4,5%).[1] Se produjeron infecciones graves en dos pacientes tratados con guselkumab y en tres que recibieron adalimumab.[1] Hasta la semana 48, se produjo un infarto de miocardio en cada uno de los grupos de tratamiento con guselkumab y adalimumab, y se notificaron dos neoplasias malignas sólidas (un cáncer de próstata y un cáncer de mama) en los pacientes que recibieron guselkumab.[1]
Novedades acerca de risankizumab, un inhibidor de la IL-23
La compañía AbbVie (NYSE: ABBV) ha presentado datos nuevos de risankizumab (anteriormente conocido como BI 655066), un inhibidor de la interleucina-23 (IL-23) en fase de investigación, que demuestran en un estudio de extensión abierto de fase 2 realizado en pacientes con psoriasis en placas crónica moderada a grave que habían cambiado su terapia de ustekinumab a risankizumab o que fueron retratados con risankizumab, alcanzar o mantener el 90% del aclaramiento de la piel (PASI 90) a semana 12 tras la administración de una única dosis de risankizumab 90mg. Estos datos se han presentado en el 25º Congreso de la EADV. Los datos preliminares a doce semanas de un estudio de extensión abierto fase 2 muestran el mantenimiento o mejora de las respuestas cutáneas en los pacientes que cambiaron de ustekinumab a risankizumab.

Autor/a: PublicDomainPictures
Fuente: Pixabay / Public Domain
Datos adicionales presentados en el congreso muestran que las lesiones cutáneas en los pacientes con psoriasis tratados con risankizumab fueron más marcadas y que los cambios en los perfiles molecular e histopatológico se observaron antes que en las muestras de los pacientes tratados con ustekinumab. Risankizumab bloquea selectivamente la IL-23 al unirse a su subunidad p19. La IL-23, una citoquina clave que participa en procesos inflamatorios, se ha asociado a una serie de enfermedades crónicas inmunomediadas.
Estudio de extensión abierto fase 2
-Se trata de un estudio de extensión abierto en curso fase 2 diseñado para evaluar la respuesta clínica después de la retirada y retratamiento o cambio de terapia de ustekinumab a risankizumab.
-En el estudio participan 109 pacientes procedentes del estudio original fase 2 (N=166) que completaron satisfactoriamente 48 semanas de tratamiento o cuya respuesta PASI disminuyó a menos del 50% antes de finalizar el ensayo.
-En el momento de la entrada en el estudio de extensión abierta, los porcentajes de pacientes con una respuesta PASI 90 eran los siguientes: 0% (0/22), 53,6% (15/28), 50,0% (16/32) y 14,8% (4/27) en los grupos de risankizumab (18 mg, 90 mg y 180 mg) y ustekinumab, respectivamente.
-Doce semanas después de recibir la primera inyección de 90 mg de risankizumab, los porcentajes de pacientes que presentaron una respuesta PASI 90 fueron los siguientes: 59,1% (13/22), 71,4% (20/28), 68,8% (22/32) y 66,7% (18/27) en cada grupo respectivo.
-Además, entre los no respondedores del estudio fase 2 (los pacientes que no presentaron por lo menos una mejora del 50% del PASI), casi la mitad (48,6%; 17/35) presentaron una respuesta PASI 90 después de recibir una única inyección de 90 mg de risankizumab.
-Los acontecimientos adversos fueron similares a los observados en el ensayo fase 2 anterior. La mayoría no fueron graves y sólo se comunicó un acontecimiento adverso grave.
Estudio de perfiles de lesiones psoriásicas
-En el congreso también se han presentado datos de los perfiles molecular e histopatológico de las lesiones cutáneas psoriásicas procedentes de un análisis combinado de 39 biopsias de pacientes con psoriasis tratados con risankizumab en el ensayo clínico de fase 1 y de 60 biopsias de pacientes con psoriasis tratados con risankizumab o con ustekinumab en el ensayo clínico de fase 2.
-El tratamiento con risankizumab se asoció a cambios en los perfiles molecular e histopatológico de las lesiones cutáneas ya a las cuatro semanas.
‘Besos por la psoriasis’

Imagen de la campaña
Fuente: Acción Psoriasis / Novartis
Acción Psoriasis ha impulsado, en colaboración con Novartis, la iniciativa de concienciación social ‘Besos por la psoriasis’, una campaña cuyo objetivo esencial es difundir el conocimiento en torno a esta patología y promover la concienciación de la sociedad sobre el impacto que ocasiona en la calidad de vida de los pacientes, que a menudo se ven afectados en el plano emocional, laboral y social.
La psoriasis es una patología sistémica autoinmune con afectación cutánea, que provoca la inflamación de las capas de la piel y, ocasionalmente, de las articulaciones. La enfermedad sigue un curso crónico, con exacerbaciones y remisiones, sin ser contagiosa. Su forma más común es la psoriasis en placas, que se manifiesta en forma de ronchas rojizas inflamadas cubiertas de escamas blanco nacarado de células muertas. En España, la patología afecta a más de un millón de personas, con una prevalencia del 2,3% de la población[2].
Una afección “devastadora a nivel psicológico”
La psoriasis es una enfermedad “crónica, desfigurante e incapacitante que afecta a la calidad de vida”, afirma el Dr. Pablo de la Cueva, miembro de la Academia Española de Dermatología y Venereología (AEDV). Esta patología, que sufren más de un millón de personas en España, “puede ser una enfermedad devastadora a nivel psicológico, especialmente cuando afecta a zonas visibles como la cara, las manos y zona genital”, agrega.
La psoriasis “puede aparecer a cualquier edad” y “tiene una carga física, emocional y social”, describe el Dr. De la Cueva. En cuanto a su etiología es desconocida, aunque hay una predisposición genética. Puede ser una enfermedad autoinmune, pero el posible autoantígeno no se ha identificado, incide el especialista. Así, la probabilidad de que la padezcan nuestros hijos si uno de los progenitores la tiene es del 10%, mientras que si los dos padres la padecen, la cifra aumenta al 33%, lo que quiere decir que 1 de cada 3 podría desarrollar la enfermedad, explican desde la AEDV.
Decálogo de recomendaciones socio-sanitarias
Cristina Tiemblo, vocal de dermofarmacia del Consejo General de Farmacéuticos, ha señalado la importancia de hábitos diarios tan simples como mantener una buena higiene, conocer el tipo de champú adecuado a utilizar y no aplicar perfume sobre la piel, aspectos que son fundamentales para una mejor calidad de vida. A continuación se incluye el cuadro con las normas imprescindibles del Consejo General de Colegios Oficiales de Farmacéuticos:

Decálogo de recomendaciones socio-sanitarias en casos de psoriasis
Fuente: Consejo de Colegios Oficiales de Farmacéuticos / AEDV / Idealmedia
Experiencia clínica de ustekinumab en artritis psoriásica
Durante 15 años, la terapia biológica utilizada en pacientes con artritis psoriásica se ha basado en los fármacos anti-TNF; sin embargo, y a pesar de la mejoría que producen en la enfermedad, un alto porcentaje de pacientes no obtiene una mejoría clínicamente significativa o deja de responder con el tiempo. Hasta ahora, la única posibilidad que existía era cambiar a otro anti-TNF aunque éste tuviese una eficacia inferior al primero. Sin embargo, desde hace unos años, los ensayos clínicos y la experiencia clínica de los reumatólogos han demostrado la eficacia y seguridad del uso de ustekinumab en estos pacientes.
Ustekinumab es un medicamento biológico que inhibe una cascada de inflamación (la vía de citocinas IL12/23). “Para aprovechar todo su potencial terapéutico, en la práctica real ustekinumab estaría indicado como primer tratamiento biológico o tras fallo a un primer anti-TNF en pacientes con artritis psoriásica moderada-grave que previamente han fallado al menos a un fármaco modificador de la enfermedad clásico”, explica el Dr. Juan Cañete, especialista del servicio de Reumatología del Hospital Clínic de Barcelona y miembro del comité científico del III Simposio Nacional de Artritis Psoriásica Innovara, celebrado en Málaga el 29 de octubre.

III Simposio Nacional de Artritis psoriásica Innovara
Fuente: Janssen / Berbés Asociados
*Compensado como investigador del estudio o miembro del comité directivo
Bibliografía
1. Blauvelt A, et al. Level of efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the continuous treatment of moderate-to-severe psoriasis in the phase 3 VOYAGE 1 trial. Annual European Academy of Dermatology and Venereology (EADV 2016); 28 Sept–02 Oct, 2016; Vienna, Austria; VIE16LAT-0080.
2. C. Ferrándiz, J.M. Carrascosa y M. Toro. Prevalencia de la psoriasis en España en la era de los agentes biológicos. Badalona, Barcelona, España. 2013. http://apps.elsevier.es/watermark/ctl_servlet?_f=10&pident_articulo=90326281&pident_usuario=0&pcontactid=&pident_revista=103&ty=148&accion=L&origen=zonadelectura&web=www.elsevier.es&lan=es&fichero=103v105n05a90326281pdf001.pdf




