Aunque la enfermedad de Crohn (EC) puede afectar a cualquier segmento del tubo digestivo, la región más frecuentemente afectada es el íleon terminal, bien de forma aislada (30%) o asociada a afectación del colon (40%). A pesar de las aparentes limitaciones, la colonoscopia ha sido la técnica diagnóstica de referencia tanto para el diagnóstico como para la monitorización de la enfermedad1. Sin embargo, un porcentaje significativo de pacientes con ileoscopia normal (8-50%)2,3 tiene lesiones en las pruebas de imagen (TC, RMN o ecografía), bien por no ser alcanzables con la colonoscopia o bien porque no hayan sido detectadas al tratase de alteraciones transmurales. En este último caso es posible que los hallazgos no alteren la actitud terapéutica, pero tienen un indudable valor para el diagnóstico de la enfermedad. Por este motivo, la realización de una técnica de imagen para explorar el intestino delgado es obligada ante la sospecha de una enfermedad de Crohn, bien sea una cápsula endoscópica, una resonancia o una ecografía, y así lo recogen los diferentes consensos4.

Dr. Fernando Muñoz
Fuente: Dr. Muñoz
El desarrollo de las diferentes técnicas de imagen (RMN, Ecografía, TC) se ha realizado de forma paralela; sin embargo, la difusión de la RMN ha sido mucho mayor, de forma que prácticamente cualquier hospital tiene acceso a la técnica. La TC, fuera de las situaciones de urgencia, no debe emplearse por la radiación que conlleva, aunque sea pequeña, dado que son pacientes que requerirán previsiblemente numerosas pruebas de imagen a lo largo de su vida. La implantación de la ecografía intestinal, fuera de algunos países con larga tradición en la técnica como Italia, Alemania o Canadá, ha sido limitada. En una encuesta realizada en nuestro país en 2018 y presentada en la reunión de GETECCU de ese año, sólo un 21% de los encuestados utilizaba la ecografía intestinal como primera opción antes que la RMN en la valoración del intestino delgado, y esto a pesar de que el 48% disponía de la técnica en su hospital. En esta encuesta, las principales limitaciones para la implantación de la técnica eran la falta de confianza y de experiencia. Estos son dos de los mitos por los que, probablemente, ha tardado en generalizarse este procedimiento. La falta de confianza se basa en la percepción de un peor rendimiento que la RMN; sin embargo, los distintos metaanálisis publicados muestran un rendimiento similar, tanto en el diagnóstico de la enfermedad como en la detección de complicaciones5,6.
No obstante, la mayor parte de los estudios comparan ambas técnicas de imagen con la colonoscopia o los hallazgos quirúrgicos, y hay pocos que enfrenten ambas exploraciones entre sí con una calidad adecuada. En este sentido, hay que nombrar al estudio METRIC7 realizado en Reino Unido en el que se practicaban las dos exploraciones de forma ciega a 284 pacientes con diagnóstico o sospecha de EC. La RMN fue, por poco, significativamente superior a la ecografía tanto en el diagnóstico de la EC en delgado (97% vs 92%) como en la estimación de la extensión (80% vs 70%). Sin embargo, en el colon no hubo diferencias y, de hecho, en un metaanálisis reciente la ecografía podría ser incluso superior a la RMN en esta localización8, aunque las diferencias son pequeñas. En cualquier caso, ambas exploraciones tienen una excelente sensibilidad y especificidad y, de hecho, en el consenso de la ECCO ambas exploraciones se consideran adecuadas tanto para el diagnóstico como para el seguimiento de la EC4.
Otro de los argumentos que ha contribuido a limitar la expansión de la ecografía ha sido la percepción de que es una exploración muy dependiente del explorador que la realiza. Sin embargo, la concordancia entre exploradores con experiencia es buena9 e incluso en médicos sin experiencia hay un buen grado de acuerdo tras una formación adecuada, al menos en los parámetros más importantes como son el grosor de la pared y la presencia o no de hiperemia10. Por otro lado, la variabilidad en la interpretación de la RMN tampoco es perfecta11. En cuanto a la curva de aprendizaje, se ha estimado en unas 150 exploraciones supervisadas5, cifra muy similar a la necesaria en la formación en otras técnicas como la RMN12 o la ecoendoscopia13.

(Foto modificada) Autor/a: Avij (talk • contribs)
Fuente: Wikipedia
Entonces, si tienen una aplicación similar, ¿por qué hacer ecografía intestinal? Fundamentalmente por sus 3 grandes ventajas. En primer lugar, está ampliamente disponible, incluso en consultas extrahospitalarias, siendo su coste claramente inferior al de las otras técnicas de imagen. En este sentido, de las diferentes estrategias diagnósticas evaluadas en un estudio italiano de costes, la combinación de colonoscopia y ecografía resultó ser la más coste-eficaz, tanto en escenarios de alta como de baja probabilidad pre-test14. Por otro lado, en algo que invariablemente tiene ventaja sobre el resto de las exploraciones es en la excelente tolerancia de la ecografía, que se sitúa al mismo nivel que un análisis de sangre y por encima de la recolección de heces o la RMN15, incluso en población pediátrica16, donde este punto es especialmente relevante.
Cuando se pregunta específicamente por la preferencia entre RMN y ecografía la mayoría de los pacientes se decantan por la segunda (17% vs 83%)17, siendo la técnica preferida para realizar de forma regular16. Por último, la gran ventaja que la diferencia del resto de las técnicas de imagen es la inmediatez, es decir, que puede ser realizada en el punto de atención, bien sea una consulta, una habitación o en el hospital de día; es lo que se denomina POCUS (Point of Care Ultrasound) por el acrónimo en inglés. Esto acelera la toma de decisiones contando con la información en el mismo momento en que se precisa. En este sentido, varios estudios18-20 muestran que la información ecográfica cambia la actitud del clínico en un 40-60% de las ocasiones con respecto a la decisión que se hubiera tomado sólo con la información clínica o analítica. Actualmente la existencia de dispositivos de mano con un coste sensiblemente inferior a los ecógrafos tradicionales facilita esta opción. De hecho, existe un ensayo clínico prospectivo y ciego21 que compara la rentabilidad diagnóstica de estos dispositivos con la RMN en pacientes con sospecha de EC. La RMN tenía una sensibilidad y especificidad significativamente superiores, pero las diferencias no eran grandes: 91,67% vs 87,5% y 94,6% vs 91,9% respectivamente. Estos hallazgos son sorprendentes para un dispositivo de bolsillo que puede llevarse consigo en cualquier momento.
La ecografía intestinal también tiene limitaciones que es obligado conocer. Alguna de ellas es compartida con la RMN, como es la limitada sensibilidad en la detección de lesiones proximales, siendo preferible ante la sospecha de afectación en esta localización emplear la cápsula endoscópica22. Ambas técnicas tienen también una sensibilidad limitada en caso de lesiones endoscópicas muy superficiales como aftas, aunque en este caso las consecuencias de cara al pronóstico y tratamiento son menores. La obesidad es una clara limitación de la ecografía, ya que la localización de la zona a estudiar está más profunda e impide en muchas ocasiones la utilización de sondas de alta frecuencia, con lo que la definición es peor. La localización profunda en la pelvis de la zona afectada es otra de las situaciones que empeora el rendimiento de la ecografía y, en concreto, el recto es el segmento en donde la sensibilidad es menor23. Otra de las situaciones donde la calidad de la exploración se resiente es en el último trimestre del embarazo, donde la identificación del íleon terminal y en menor medida de la sigma está dificultada por el útero gestante24. Finalmente, a la hora de elegir una u otra técnica tendremos en cuenta que, cuando la zona afectada es larga (mayor de 30 cm), la ecografía infraestima en un 30% la extensión; por tanto, en pacientes con segmentos largos o afectación pélvica la RMN podría aportar información adicional.
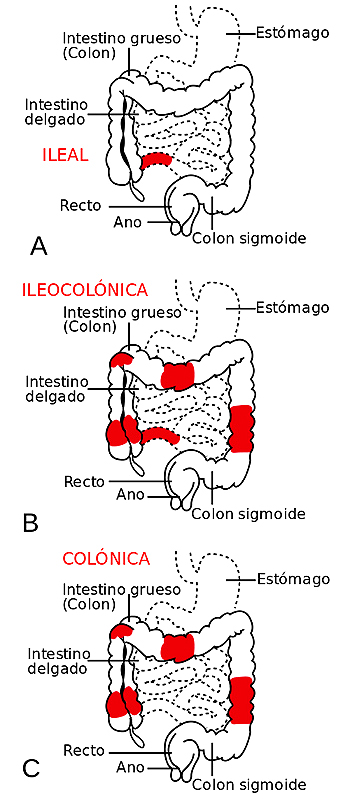
Los tres tipos más frecuentes de Crohn atendiendo a la zona afectada de los intestinos: A- ileal, B- ileocolónica y C- colónica
Autor/a de la imagen: Patterns_of_CD.svg: Samir, vectorized by Fvasconcellos derivative work: Ortisa (talk) - Patterns_of_CD.svg
Fuente: Wikipedia
¿Cómo se realiza la exploración y qué podemos ver? La exploración reglada es aconsejable que se realice en ayunas porque disminuye el gas, pero no es necesario en la que se hace sobre la marcha en la consulta. Se suele llevar a cabo un examen general y sistemático con una sonda convex abdominal de 3-5 MHz para seguir con un examen más detallado de las zonas afectadas con una sonda de mayor frecuencia (>5 MHz), realizando la técnica de compresión gradual que permite desplazar el gas intestinal y disminuir la distancia entre la sonda y el asa intestinal. Tras el examen en modo B o escala de grises se utiliza el Doppler color para evaluar la vascularización que tiene una relación directa con el grado de inflamación. Es importante que los parámetros del Doppler color estén ajustados para detectar vasos de flujo lento y velocidades bajas. El hallazgo principal es el engrosamiento de la pared intestinal que se correlaciona con la actividad inflamatoria, y es de los parámetros que menor variabilidad interobservador tiene. El valor normal se ha establecido en 3 mm tanto en intestino delgado como en colon, y se debe realizar la media de al menos dos mediciones en un corte transversal y dos en longitudinal del segmento más afectado25.
El segundo parámetro más utilizado para valorar actividad es el Doppler generalmente con una escala semicuantitativa o índice de Limberg modificado (flujo ausente (grado 0), flujo débil (grado 1), flujo fácilmente visible (grado 2), o flujo mural y vasos aumentados fuera de la pared del asa (grado 3)26. Los grados 2 y 3 de esta escala tienen una especificidad mayor del 90% para detectar actividad endoscópica grave con una sensibilidad del 67%27. Otros hallazgos que podemos encontrar en el asa afectada son la presencia de úlceras o la alteración de la estructura en capas del intestino. Las úlceras se observan como irregularidades de la pared o imágenes hiperecogénicas que profundizan en la pared intestinal. Tienen una especificidad del 100% en detectar actividad endoscópica y la sensibilidad es superior al 90%, siendo probablemente mayor que la de la RMN28. La pérdida bien sea focal (menos de 3 cm) o difusa de la estructura en capas se correlaciona con la presencia de úlceras longitudinales y tiene valor pronóstico porque predice una mayor necesidad de cirugía en la evolución29. También hay que recoger los hallazgos mesentéricos que incluyen proliferación fibrograsa, adenopatías o la presencia de complicaciones como fisuras o abscesos; todos ellos se correlacionan con actividad, aunque en el caso de la afectación de la grasa puede persistir una vez conseguido el control de la enfermedad30.
Uno de los aspectos que más progreso ha registrado en los últimos años ha sido el desarrollo de índices cuantitativos, algo que permitiría incluir a la ecografía en ensayos clínicos y cuantificar la mejoría en la monitorización de la EC. Hay varios índices validados de forma parcial; sin embargo, no hay ninguno que se utilice de forma uniforme.
Se pueden emplear varias técnicas para mejorar el rendimiento. El SICUS (Small Intestine Contrast Ultrasonography) consiste en administrar un contraste oral no absorbible, generalmente PEG, en cantidad variable (350-800 cc) para mejorar la caracterización de las estenosis. Requiere una exploración convencional inicial (interfiere con la señal Doppler) repitiéndola tras la toma del contraste a los 20-30 minutos, lo que alarga enormemente el tiempo de exploración. Por este motivo, no se realiza de rutina, pero sí en los casos en los que no se cumplen los criterios de estenosis (2 de 3 de los siguientes: engrosamiento parietal >3 mm, dilatación preestenótica ≥ 25 mm o luz intestinal <10 mm), para definir bien la longitud de la misma o cuando hay dificultades para identificar el asa afectada, sobre todo en casos de valoración de recurrencia postquirúrgica31.
La administración de contraste IV o CEUS (Contrast-Enhanced Ultrasonography) permite valorar la microvascularización y se utiliza para valorar actividad en casos de engrosamiento parietal sin señal Doppler puesto que aumenta la sensibilidad hasta un 99%, aunque a expensas de disminuir la especificidad27. También tiene utilidad para detectar áreas avasculares en caso de sospecha de absceso para confirmar su presencia y determinar su tamaño con mayor precisión. Por último, se puede realizar elastografía del segmento afectado, lo que nos proporciona información sobre la presencia de fibrosis marcada, aunque aún es una técnica que precisa de mayor investigación32.

Autor/a: Piotr Siedlecki
Fuente: www.publicdomainpictures.net
¿Cada cuánto tiempo realizarla? En las recomendaciones de la ECCO se establecen los 6-12 meses como momento para evaluar el efecto del tratamiento en las técnicas de imagen. En un consenso reciente específicamente sobre ecografía intestinal también se plantean las semanas 12-16 y 5433. Lógicamente, si persisten lesiones que condicionan ajustes del tratamiento se repetirá la ecografía o RMN a los 3 meses. En caso de normalización de los parámetros ecográficos, no está claro cada cuánto tiempo convendría realizarla. El fundamento vendría dado por la utilidad más limitada de la calprotectina fecal en la afectación del intestino delgado con respecto a la del colon. A este respecto se han publicado algoritmos que aconsejan su realización cada 6-12 meses34,35 de forma conjunta con determinación periódica de biomarcadores, en especial de la calprotectina fecal, puesto que tendrían valor pronóstico independiente36. En cualquier caso, la sola determinación de biomarcadores es insuficiente dado que tiene una baja sensibilidad (73%) y especificidad (71,4%) para la detección de lesiones ecográficas o sobre todo de complicaciones37.
Por otro lado, valorar la respuesta a un tratamiento concreto de forma precoz es fundamental, bien para optimizarlo o bien para cambiar de línea en caso de que no se observe eficacia. De hecho, en un reciente consenso los momentos más votados para la realización de la ecografía son las semanas 8, 26 y 5425. Sin embargo, no existen muchos datos sobre la rentabilidad de la ecografía de forma precoz. En el estudio Stardust con ustekinumab se hacía una valoración con ecografía a las 4 semanas en la que ya se observaba una disminución del grosor parietal significativa con respecto a los valores basales, aunque el porcentaje de respuesta ecográfico era relativamente bajo (26,7%) en relación al conseguido en la semana 48 (46,3%), con lo que no es suficiente como para tomar una actitud terapéutica concreta38. Estudios recientes39-41 confirman diferencias significativas ya en la semana 2 con respecto a los valores basales en grosor y sobre todo en parámetros de contraste IV, de forma que permitiría discriminar precozmente a los pacientes con respuesta, aunque aún está por establecer el valor clínico de la realización tan precoz de la técnica.
¿Hasta dónde tenemos que llegar? Actualmente, el objetivo de tratamiento más exigente es la curación mucosa1 y la ecografía ha demostrado una correlación excelente, con áreas bajo la curva que oscilan entre el 0,86 y el 0,9736,42-44. Sin embargo, el consenso Stride II no incluye a la curación transmural (con el problema de las múltiples definiciones existentes)29 como objetivo de tratamiento, fundamentalmente porque es un objetivo difícil de conseguir1. No obstante, no le resta valor pronóstico a este objetivo. Como ejemplo, en el estudio de Castiglione y col45 la probabilidad de cirugía, hospitalización o recidiva es significativamente superior en los pacientes que alcanzaron curación mucosa, pero con persistencia de lesiones en la ecografía que en aquellos con curación transmural. Estos hallazgos también se han confirmado en otros estudios46,47, destacando que hasta un 61% de los pacientes en remisión clínica tiene lesiones en la ecografía47, y que la curación ecográfica parcial probablemente no sea suficiente48. Sin embargo, hay un porcentaje significativo de pacientes con lesiones residuales que tienen un excelente pronóstico, por lo que quizá sería necesario establecer bien los criterios de la denominada curación transmural, más allá de la completa normalización. Por último, más que conseguir curación mucosa o transmural probablemente sea una combinación de ambas, puesto que el pronóstico aún sería mejor49,50.

Autor/a: George Hodan
Fuente: www.publicdomainpictures.net
Con objeto de estandarizar los objetivos ecográficos a alcanzar se ha publicado recientemente un consenso que establece que la RT se definiría como un grosor de 3 mm o menos junto con la ausencia de señal Doppler, mientras que la respuesta ecográfica incluye uno de los siguientes criterios: reducción de 2 mm del grosor con respecto al basal, reducción de 1 mm junto con disminución de la señal Doppler en al menos 1 grado o bien una reducción del grosor mayor del 25%33.
¿Cuál es el papel en la colitis ulcerosa (CU)? El peso de la monitorización en esta enfermedad recae sobre los biomarcadores, en especial la calprotectina fecal y la colonoscopia. No obstante, la ecografía puede tener un papel relevante de apoyo a estas técnicas. Los hallazgos ecográficos en la CU son similares a los descritos en la EC, es decir, aumento del grosor de la pared, aumento de la vascularización, pérdida de la estratificación en capas, etc51; quizás señalar la pérdida de haustración como característica propia de la afectación cólica. La ecografía ha demostrado que tiene un papel en la monitorización de esta enfermedad y quizá el estudio más relevante es el estudio TRUST&UC52 que encuentra, ya desde la semana 2, una disminución significativa en todos los parámetros ecográficos analizados. Uno de los problemas comentados y que en la CU es más relevante es la limitada sensibilidad de la ecografía en valorar el recto23. Para subsanar este problema se ha propuesto la realización de una ecografía transperineal con buenos resultados53, aunque bien es cierto que una rectoscopia también se puede llevar a cabo de forma rápida y sin preparación.
¿Cómo nos puede ayudar? El POCUS o ecografía sobre la marcha en la propia consulta nos permite hacer una valoración complementaria a la clínica o biomarcadores permitiéndonos tener más información de cara a las decisiones de tratamiento o de indicación de otras exploraciones, fundamentalmente colonoscopia o rectoscopia. También nos permitiría una valoración de la extensión de la enfermedad en situaciones donde la colonoscopia es incompleta por estenosis, falta de preparación o porque no es recomendable realizarla por la gravedad del brote54. Hay que destacar el posible papel en el brote grave de CU para predecir la respuesta al tratamiento. Ilvemark y col55 incluye a 56 pacientes en esta situación a los que realiza ecografía basal y a las 24-72 horas, encontrando que una disminución del 20% o más del grosor basal se asocia a una respuesta favorable a los corticoides endovenosos, con una sensibilidad del 84,2% y una especificidad del 78,4%. Son en todo caso estudios preliminares prometedores que necesitan ser ampliados.
Para concluir, como hemos visto, la ecografía intestinal -aun realizándose desde hace años- ha tenido un empuje importante en los últimos años fundamentalmente por su coste, tolerancia e inmediatez. Como retos futuros quedan pendientes varios aspectos, resaltando la adopción uniforme de un índice validado de forma completa, el papel de la elastografía y sobre todo la extensión de la técnica a las distintas unidades de EII (Enfermedad Inflamatoria Intestinal), con la adopción del POCUS como la forma que más rendimiento obtiene de la técnica en términos de mejorar la toma de decisiones clínicas.
Bibliografía
1. Turner D, Ricciuto A, Lewis A, et al. STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology 2021; 160: 1570-1583. 2020/12/29. DOI: 10.1053/j.gastro.2020.12.031.
2. Nehra AK, Sheedy SP, Wells ML, et al. Imaging Findings of Ileal Inflammation at Computed Tomography and Magnetic Resonance Enterography: What do They Mean When Ileoscopy and Biopsy are Negative? J Crohns Colitis 2020; 14: 455-464. 2020/01/22. DOI: 10.1093/ecco-jcc/jjz122.
3. Samuel S, Bruining DH, Loftus EV, Jr., et al. Endoscopic skipping of the distal terminal ileum in Crohn's disease can lead to negative results from ileocolonoscopy. Clin Gastroenterol Hepatol 2012; 10: 1253-1259. DOI: 10.1016/j.cgh.2012.03.026.
4. Maaser C, Sturm A, Vavricka SR, et al. ECCO-ESGAR Guideline for Diagnostic Assessment in IBD Part 1: Initial diagnosis, monitoring of known IBD, detection of complications. J Crohns Colitis 2019; 13: 144-164. 2018/08/24. DOI: 10.1093/ecco-jcc/jjy113.
5. Atkinson NS, Bryant RV, Dong Y, et al. WFUMB Position Paper. Learning Gastrointestinal Ultrasound: Theory and Practice. Ultrasound Med Biol 2016; 42: 2732-2742. 2016/10/16. DOI: 10.1016/j.ultrasmedbio.2016.08.026.
6. Panes J, Bouzas R, Chaparro M, et al. Systematic review: the use of ultrasonography, computed tomography and magnetic resonance imaging for the diagnosis, assessment of activity and abdominal complications of Crohn's disease. Aliment Pharmacol Ther 2011; 34: 125-145. 2011/05/28. DOI: 10.1111/j.1365-2036.2011.04710.x.
7. Taylor SA, Mallett S, Bhatnagar G, et al. Diagnostic accuracy of magnetic resonance enterography and small bowel ultrasound for the extent and activity of newly diagnosed and relapsed Crohn's disease (METRIC): a multicentre trial. The lancet Gastroenterology & hepatology 2018; 3: 548-558. 2018/06/20. DOI: 10.1016/s2468-1253(18)30161-4.
8. Alshammari MT, Stevenson R, Abdul-Aema B, et al. Diagnostic Accuracy of Non-Invasive Imaging for Detection of Colonic Inflammation in Patients with Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis. Diagnostics (Basel) 2021; 11 20211018. DOI: 10.3390/diagnostics11101926.
9. Fraquelli M, Sarno A, Girelli C, et al. Reproducibility of bowel ultrasonography in the evaluation of Crohn's disease. Dig Liver Dis 2008; 40: 860-866. 2008/06/28. DOI: 10.1016/j.dld.2008.04.006.
10. Carter D and Eliakim R. Feasibility of Bedside Bowel Ultrasound Performed by a Gastroenterologist for Detection and Follow-Up of Inflammatory Bowel Disease. Isr Med Assoc J 2017; 19: 139-142. 2017/05/01.
11. Bhatnagar G, Mallett S, Quinn L, et al. Interobserver variation in the interpretation of magnetic resonance enterography in Crohn's disease. Br J Radiol 2022; 95: 20210995. 20220512. DOI: 10.1259/bjr.20210995.
12. Wani S, Coté GA, Keswani R, et al. Learning curves for EUS by using cumulative sum analysis: implications for American Society for Gastrointestinal Endoscopy recommendations for training. Gastrointest Endosc 2013; 77: 558-565. 20121220. DOI: 10.1016/j.gie.2012.10.012.
13. Tielbeek JA, Bipat S, Boellaard TN, et al. Training readers to improve their accuracy in grading Crohn's disease activity on MRI. Eur Radiol 2014; 24: 1059-1067. 20140222. DOI: 10.1007/s00330-014-3111-3.
14. Maconi G, Bolzoni E, Giussani A, et al. Accuracy and cost of diagnostic strategies for patients with suspected Crohn's disease. J Crohns Colitis 2014; 8: 1684-1692. 2014/09/03. DOI: 10.1016/j.crohns.2014.08.005.
15. Buisson A, Gonzalez F, Poullenot F, et al. Comparative Acceptability and Perceived Clinical Utility of Monitoring Tools: A Nationwide Survey of Patients with Inflammatory Bowel Disease. Inflamm Bowel Dis 2017; 23: 1425-1433. 2017/06/02. DOI: 10.1097/mib.0000000000001140.
16. van Wassenaer EA, van der Klift RR, Staphorst MS, et al. The child's perception on monitoring inflammatory bowel disease activity. Eur J Pediatr 2022; 181: 1143-1149. 20211110. DOI: 10.1007/s00431-021-04315-5.
17. Allocca M, Fiorino G, Bonifacio C, et al. Comparative Accuracy of Bowel Ultrasound Versus Magnetic Resonance Enterography in Combination With Colonoscopy in Assessing Crohn's Disease and Guiding Clinical Decision-making. J Crohns Colitis 2018; 12: 1280-1287. 2018/07/10. DOI: 10.1093/ecco-jcc/jjy093.
18. Bots S, De Voogd F, De Jong M, et al. Point-of-care Intestinal Ultrasound in IBD Patients: Disease Management and Diagnostic Yield in a Real-world Cohort and Proposal of a Point-of-care Algorithm. J Crohns Colitis 2022; 16: 606-615. DOI: 10.1093/ecco-jcc/jjab175.
19. Friedman AB, Asthana A, Knowles SR, et al. Effect of point-of-care gastrointestinal ultrasound on decision-making and management in inflammatory bowel disease. Aliment Pharmacol Ther 2021; 54: 652-666. 20210622. DOI: 10.1111/apt.16452.
20. Gonen C, Surmelioglu A, Kochan K, et al. Impact of intestinal ultrasound with a portable system in the management of Crohn's disease. Gastroenterol Rep (Oxf) 2021; 9: 418-426. 20201210. DOI: 10.1093/gastro/goaa088.
21. Rispo A, de Sire R, Mainenti PP, et al. David Against Goliath: Direct Comparison of Handheld Bowel Sonography and Magnetic Resonance Enterography for Diagnosis of Crohn's Disease. Inflamm Bowel Dis 2022 20220606. DOI: 10.1093/ibd/izac116.
22. Kopylov U, Yung DE, Engel T, et al. Diagnostic yield of capsule endoscopy versus magnetic resonance enterography and small bowel contrast ultrasound in the evaluation of small bowel Crohn's disease: Systematic review and meta-analysis. Dig Liver Dis 2017; 49: 854-863. 20170427. DOI: 10.1016/j.dld.2017.04.013.
23. Sagami S, Kobayashi T, Miyatani Y, et al. Accuracy of Ultrasound for Evaluation of Colorectal Segments in Patients With Inflammatory Bowel Diseases: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol 2021; 19: 908-921.e906. 2020/08/11. DOI: 10.1016/j.cgh.2020.07.067.
24. De Voogd F, Joshi H, Van Wassenaer E, et al. Intestinal Ultrasound to Evaluate Treatment Response During Pregnancy in Patients With Inflammatory Bowel Disease. Inflamm Bowel Dis 2022; 28: 1045-1052. DOI: 10.1093/ibd/izab216.
25. Goodsall TM, Jairath V, Feagan BG, et al. Standardisation of intestinal ultrasound scoring in clinical trials for luminal Crohn's disease. Aliment Pharmacol Ther 2021 2021/03/01. DOI: 10.1111/apt.16288.
26. Neye H, Voderholzer W, Rickes S, et al. Evaluation of criteria for the activity of Crohn's disease by power Doppler sonography. Dig Dis 2004; 22: 67-72. DOI: 10.1159/000078737.
27. Ripolles T, Martinez-Perez MJ, Paredes JM, et al. The Role of Intravenous Contrast Agent in the Sonographic Assessment of Crohn's Disease Activity: Is Contrast Agent Injection Necessary? J Crohns Colitis 2019; 13: 585-592. 2018/12/12. DOI: 10.1093/ecco-jcc/jjy204.
28. Wilkens R, Hagemann-Madsen RH, Peters DA, et al. Validity of Contrast-enhanced Ultrasonography and Dynamic Contrast-enhanced MR Enterography in the Assessment of Transmural Activity and Fibrosis in Crohn's Disease. J Crohns Colitis 2018; 12: 48-56. 2017/10/06. DOI: 10.1093/ecco-jcc/jjx111.
29. Helwig U, Fischer I, Hammer L, et al. Transmural Response and Transmural Healing Defined by Intestinal Ultrasound: New Potential Therapeutic Targets? J Crohns Colitis 2022; 16: 57-67. DOI: 10.1093/ecco-jcc/jjab106.
30. Maconi G, Greco S, Duca P, et al. Prevalence and clinical significance of sonographic evidence of mesenteric fat alterations in Crohn's disease. Inflamm Bowel Dis 2008; 14: 1555-1561. 2008/06/04. DOI: 10.1002/ibd.20515.
31. Pallotta N, Vincoli G, Montesani C, et al. Small intestine contrast ultrasonography (SICUS) for the detection of small bowel complications in crohn's disease: a prospective comparative study versus intraoperative findings. Inflamm Bowel Dis 2012; 18: 74-84. 2011/03/26. DOI: 10.1002/ibd.21678.
32. Dal Buono A, Faita F, Peyrin-Biroulet L, et al. Ultrasound elastography in inflammatory bowel diseases a systematic review of accuracy compared to histopathological assessment. J Crohns Colitis 2022 20220613. DOI: 10.1093/ecco-jcc/jjac082.
33. Ilvemark J, Hansen T, Goodsall TM, et al. Defining Transabdominal Intestinal Ultrasound Treatment Response and Remission in Inflammatory Bowel Disease: Systematic Review and Expert Consensus Statement. J Crohns Colitis 2022; 16: 554-580. DOI: 10.1093/ecco-jcc/jjab173.
34. Lega S and Dubinsky MC. What Are the Targets of Inflammatory Bowel Disease Management. Inflamm Bowel Dis 2018; 24: 1670-1675. DOI: 10.1093/ibd/izy064.
35. Munoz F, Ripolles T, Poza Cordon J, et al. Recommendations of the Spanish Working Group on Crohn's Disease and Ulcerative Colitis (GETECCU) on the use of abdominal ultrasound in inflammatory bowel disease. Gastroenterol Hepatol 2021; 44: 158-174. 2020/12/15. DOI: 10.1016/j.gastrohep.2020.05.009.
36. Allocca M, Craviotto V, Bonovas S, et al. Predictive value of bowel ultrasound in Crohn's disease: a 12-month prospective study. Clin Gastroenterol Hepatol 2021 2021/04/26. DOI: 10.1016/j.cgh.2021.04.029.
37. Paredes JM, Ripollés T, Algarra Á, et al. Intestinal ultrasonography and fecal calprotectin for monitoring inflammation of ileal Crohn's disease: two complementary tests. Intestinal research 2022 20220315. DOI: 10.5217/ir.2021.00126.
38. Kucharzik T, Wilkens R, D'Agostino MA, et al. Early Ultrasound Response and Progressive Transmural Remission After Treatment With Ustekinumab in Crohn's Disease. Clin Gastroenterol Hepatol 2022 20220714. DOI: 10.1016/j.cgh.2022.05.055.
39. Laterza L, Ainora ME, Garcovich M, et al. Bowel contrast-enhanced ultrasound perfusion imaging in the evaluation of Crohn's disease patients undergoing anti-TNFα therapy. Dig Liver Dis 2021; 53: 729-737. 20200906. DOI: 10.1016/j.dld.2020.08.005.
40. Chen YJ, Chen BL, Liang MJ, et al. Longitudinal Bowel Behavior Assessed by Bowel Ultrasound to Predict Early Response to Anti-TNF Therapy in Patients With Crohn's Disease: A Pilot Study. Inflamm Bowel Dis 2022; 28: S67-s75. DOI: 10.1093/ibd/izab353.
41. de Voogd F, Bots S, Gecse K, et al. Intestinal ultrasound early on in treatment follow-up predicts endoscopic response to anti-TNFα treatment in Crohn's Disease. J Crohns Colitis 2022 20220526. DOI: 10.1093/ecco-jcc/jjac072.
42. Moreno N, Ripolles T, Paredes JM, et al. Usefulness of abdominal ultrasonography in the analysis of endoscopic activity in patients with Crohn's disease: changes following treatment with immunomodulators and/or anti-TNF antibodies. J Crohns Colitis 2014; 8: 1079-1087. 2014/03/13. DOI: 10.1016/j.crohns.2014.02.008.
43. Saevik F, Eriksen R, Eide GE, et al. Development and Validation of a Simple Ultrasound Activity Score for Crohn's Disease. J Crohns Colitis 2021; 15: 115-124. 2020/06/07. DOI: 10.1093/ecco-jcc/jjaa112.
44. Ripolles T, Poza J, Suarez Ferrer C, et al. Evaluation of Crohn's Disease Activity: Development of an Ultrasound Score in a Multicenter Study. Inflamm Bowel Dis 2021; 27: 145-154. 2020/06/09. DOI: 10.1093/ibd/izaa134.
45. Castiglione F, Imperatore N, Testa A, et al. One-year clinical outcomes with biologics in Crohn's disease: transmural healing compared with mucosal or no healing. Aliment Pharmacol Ther 2019; 49: 1026-1039. 2019/03/12. DOI: 10.1111/apt.15190.
46. Grandmougin A, D'Amico F, Remen T, et al. Role of Cross-Sectional Imaging in Pediatric Inflammatory Bowel Disease. Dig Dis Sci 2022; 67: 2462-2470. 20210622. DOI: 10.1007/s10620-021-07016-z.
47. Vaughan R, Tjandra D, Patwardhan A, et al. Toward transmural healing: Sonographic healing is associated with improved long-term outcomes in patients with Crohn's disease. Aliment Pharmacol Ther 2022; 56: 84-94. 20220328. DOI: 10.1111/apt.16892.
48. Zorzi F, Ghosh S, Chiaramonte C, et al. Response Assessed by Ultrasonography as Target of Biological Treatment for Crohn's Disease. Clin Gastroenterol Hepatol 2020; 18: 2030-2037. 2019/12/24. DOI: 10.1016/j.cgh.2019.10.042.
49. Lafeuille P, Hordonneau C, Vignette J, et al. Transmural healing and MRI healing are associated with lower risk of bowel damage progression than endoscopic mucosal healing in Crohn's disease. Aliment Pharmacol Ther 2021; 53: 577-586. 2020/12/29. DOI: 10.1111/apt.16232.
50. Oh K, Oh EH, Noh SM, et al. Combined Endoscopic and Radiologic Healing Is Associated With a Better Prognosis Than Endoscopic Healing Only in Patients With Crohn's Disease Receiving Anti-TNF Therapy. Clin Transl Gastroenterol 2022; 13: e00442. 20220120. DOI: 10.14309/ctg.0000000000000442.
51. Bezzio C, Vernero M, Ribaldone DG, et al. Insights into the role of gastrointestinal ultrasound in ulcerative colitis. Therap Adv Gastroenterol 2021; 14: 17562848211051456. 20211022. DOI: 10.1177/17562848211051456.
52. Maaser C, Petersen F, Helwig U, et al. Intestinal ultrasound for monitoring therapeutic response in patients with ulcerative colitis: results from the TRUST&UC study. Gut 2020; 69: 1629-1636. 2019/12/22. DOI: 10.1136/gutjnl-2019-319451.
53. Sagami S, Kobayashi T, Aihara K, et al. Early improvement in bowel wall thickness on transperineal ultrasonography predicts treatment success in active ulcerative colitis. Aliment Pharmacol Ther 2022; 55: 1320-1329. 20220225. DOI: 10.1111/apt.16817.
54. Smith RL, Taylor KM, Friedman AB, et al. Systematic Review: Clinical Utility of Gastrointestinal Ultrasound in the Diagnosis, Assessment and Management of Patients With Ulcerative Colitis. J Crohns Colitis 2020; 14: 465-479. 2019/09/29. DOI: 10.1093/ecco-jcc/jjz163.
55. Ilvemark J, Wilkens R, Thielsen P, et al. Early intestinal ultrasound predicts intravenous corticosteroid response in hospitalized patients with severe ulcerative colitis. J Crohns Colitis 2022 20220613. DOI: 10.1093/ecco-jcc/jjac083.




