Redacción Farmacosalud.com
Bajo la organización de la Fundación ECO (Fundación para la Excelencia y la Calidad de la Oncología), el patrocinio de Pfizer y el aval científico de la Sociedad Española de Oncología Médica (SEOM), recientemente tuvo lugar el webinar ‘6 preguntas prácticas sobre… Biosimilares en oncología: una nueva forma de innovación en cáncer’. Tres de las seis preguntas formuladas fueron contestadas por el Dr. Joan Albanell, jefe del Servicio de Oncología Médica del Hospital del Mar (Barcelona), mientras que las otras tres fueron atendidas por el Dr. José Antonio Marcos, profesional de Farmacia Hospitalaria del Hospital Virgen Macarena (Sevilla). Por su parte, la Dra. Ruth Vera, jefa del Servicio de Oncología Médica del Complejo Hospitalario de Navarra, se ocupó de moderar la sesión, cuyo cierre fue a cargo del Dr. Carlos Camps, jefe del Servicio de Oncología Médica del Hospital General de Valencia. El Dr. Albanell destacó que la incorporación de los biosimilares a la práctica clínica está siendo “muy general y bastante importante”.
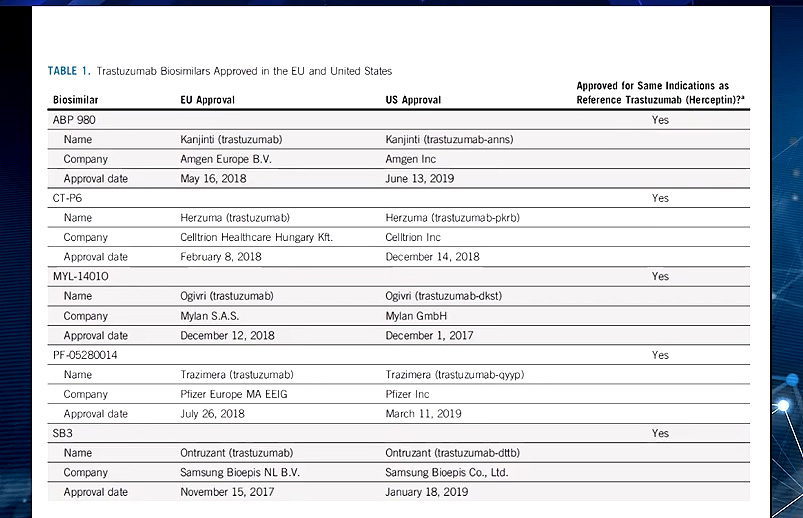
La Dra. Vera recordó que en noviembre de 2017 llegó la primera aprobación de un biosimilar para el tratamiento de un tumor sólido, el biosimilar de trastuzumab. A su juicio, los más de tres años transcurridos desde esta aprobación no eximen de la necesidad de “seguir ampliando conocimiento” sobre unos medicamentos que están teniendo -y van a tener- una gran difusión en el ámbito de la oncología.

Difusión: www.farmacosalud.com
1. ¿Cuál es la percepción actual y grado de confianza del oncólogo médico en relación con el uso de los biosimilares?
La aparición de los medicamentos biosimilares de anticuerpos monoclonales -los biosimilares ya existían para otro tipo de fármacos- fue bienvenida porque, “sin duda”, esas nuevas terapias “iban a tener un impacto en el sistema sanitario al reducir el precio de los fármacos”, ya fuera el biosimilar o bien el medicamento de referencia (el original al que versiona el biosimilar), algo que ayudaría a fomentar la innovación en oncología, explicó Dr. Joan Albanell. “El biosimilar, por definición, es parecido pero no idéntico al fármaco original y, en el caso de los anticuerpos, esto puede impactar en la glucosilación del anticuerpo y esto, a su vez, afectar en la respuesta inmune. Por lo tanto, de ahí la importancia de entender bien todo lo que hay detrás de los biosimilares”, señaló Albanell.
El facultativo dijo que la incorporación de los biosimilares a la práctica clínica está siendo “muy general y bastante importante”. En lo relativo al concepto de trazabilidad, es decir, si surgen efectos adversos o complicaciones asociadas a su uso y se puede trazar el fármaco, por ahora queda claro que los servicios de farmacia garantizan aspectos como la identificación de lotes y la fecha de caducidad, por lo que, en este sentido, “podemos estar tranquilos” ya que, de hecho, todos estos requisitos constituyen “una condición asociada a la aprobación del biosimilar”, detalló. En cuanto a la seguridad, por el momento “no ha habido ningún evento que nos haya llamado la atención”, aseguró el Dr. Albanell, quien también comentó que, para medir la actividad de estos medicamentos en comparación con los fármacos de referencia, se parte de un modelo distinto de desarrollo. Así, en el caso del biosimilar, una vez llevado a cabo un ensayo crítico de eficacia, si no hay diferencias clínicamente significativas “se acepta esa similar eficacia” en relación al medicamento original o de referencia, precisó.

Difusión: www.farmacosalud.com
2. ¿Cuál es su grado de fiabilidad relativo a la extrapolación de indicaciones?
Hay que tener en cuenta que no todos los anticuerpos monoclonales son iguales, dado que el mecanismo de acción de algunos son más sencillos (por ejemplo, bevacizumab), y otros más complejos (trastuzumab). Por ello, de entrada parece más fácil extrapolar bevacizumab en comparación con el otro tratamiento. Tampoco es lo mismo una enfermedad metastásica que una enfermedad precoz asociada a intención curativa; por lo tanto, a priori y en general, “es mucho más fácil extrapolar en enfermedad metastásica”, afirmó el oncólogo.
En el caso concreto de trastuzumab, y a pesar de su mayor complejidad, los diferentes biosimilares desarrollados en estudios y endpoints distintos “han ido siendo aprobados y extrapolados” en todas sus indicaciones al trastuzumab de referencia, sostuvo Albanell. En un estudio desarrollado en un entorno curativo, el biosimilar SB3 de trastuzumab demostró, en un seguimiento a 4 años y comparado con el trastuzumab de referencia, que había biosimilitud entre el biosimilar y el original en cuanto a la seguridad cardíaca a largo plazo y la supervivencia a 4 años. Son datos, en definitiva, que apoyan esta similitud a largo plazo, recalcó el especialista.
Difusión: www.farmacosalud.com
3. ¿Son necesarios los estudios de equivalencia para la autorización de biosimilares?
Según Albanell, “si la similitud analítica y preclínica es muy fuerte, realmente es difícil pensar que los resultados clínicos van a ser también muy dispares. Y, de hecho, hay una revisión en la cual ya se concluye que ningún biosimilar que se haya visto que es altamente similar al producto de referencia, tanto por criterios analíticos como por estudios farmacocinéticos en humanos, nunca ha dejado de aprobarse porque luego en un ensayo de eficacia se haya visto que no fuera equivalente. Por lo tanto, si la base analítica y farmacocinética es muy similar, es razonable plantear en un futuro dejar de hacer estos estudios de equivalencia”.
Pero una cosa es pensar en un futuro a largo plazo y otra pensar en uno a corto plazo o más próximo. Así, agregó, “la visión general, y me parece adecuada a día de hoy, es que los ensayos comparativos de eficacia serán probablemente necesarios en un futuro próximo (a corto plazo); quizás en un futuro (a largo plazo) no -cuando haya mayor evidencia de esta correlación analítica/clínica-, pero hoy en día, sobre todo cuando hay entorno curativo, pienso que sí, que son necesarios”.

Difusión: www.farmacosalud.com
Para acceder a toda la intervención del Dr. Albanell, clicar al siguiente video:




