INTRODUCCIÓN
El cáncer de próstata es uno de los tumores más frecuentes en los hombres, ya que uno de cada 6 hombres lo presentará en algún momento de su vida, aunque solo uno de cada 30 morirá por este tumor. En España es la tercera causa de muerte por tumor en varones tras el cáncer de pulmón y el colo-rectal1.
Se ha demostrado que hombres de la misma raza y etnia que viven en diferentes países presentan diferencias en la incidencia y en la mortalidad del cáncer de próstata, lo que sugiere que existen factores como la dieta y los hábitos de vida implicados en estas diferencias2.

Dr. Gilberto Chéchile
Fuente: Dr. Chéchile
Se ha observado que cuando un hombre proveniente de un país donde la incidencia del cáncer de próstata es baja como los países de Oriente (Japón, India, Pakistán, etc.) migra a un país de Occidente (USA) y adopta los hábitos alimentarios (dietas ricas en grasas, carnes procesadas, harina y azúcar refinados y alcohol, y bajas en fibras) y el estilo de vida del nuevo país, el riesgo de desarrollar cáncer de próstata aumenta considerablemente llegando a ser hasta 4 veces superior al de los hombres que no han migrado3,4.
El cáncer de próstata se desarrolla muy lentamente y tiene una fase preclínica muy larga. En estudios necrópsicos de hombres fallecidos por causas no tumorales se han identificado focos de cáncer de próstata en varones muy jóvenes5. A los 30 años, el 5% de los hombres ya tenían focos de carcinoma mientras que a los 80 años se detectó en un 60% de los casos. Con el paso de los años la mayoría de estos focos no crecen ni se extienden fuera de la próstata6.
Por otro lado, está ampliamente demostrado que la dieta y los estilos de vida tienen un importante papel en la aparición y en el desarrollo del cáncer de próstata7. Por ello se ha considerado que, junto con la dieta, el mantenimiento de un peso corporal normal y la disminución de la masa grasa pueden ser determinantes en la disminución de la mortalidad por este tumor y por otras enfermedades crónicas8.
Aproximadamente el 70% de los hombres con cáncer de próstata presentan sobrepeso u obesidad y muchos de ellos no cumplen con las recomendaciones sobre el consumo de frutas y vegetales.
Los sujetos con cáncer de próstata que cambian su alimentación y su estilo de vida pueden cambiar la evolución del tumor. En la Universidad de California se realizó un estudio con varones con tumor prostático de bajo riesgo que decidieron no realizar tratamiento activo contra tumor9. Los pacientes se aleatorizaron en dos grupos; uno realizó cambios importantes en el estilo de vida incluyendo: dieta vegetariana, bajo consumo de grasas, dietas ricas en soja, ejercicio físico, disminución del estrés y soporte psicosocial (grupo experimental), mientras que los pacientes del otro grupo no cambiaron su estilo de vida (grupo control). En los 12 meses que duró el estudio, ninguno de los pacientes que cambiaron radicalmente su dieta y su estilo de vida debió ser tratado por el cáncer; por el contrario, el 14% de los casos que no realizaron cambios presentaron progresión del tumor (elevación del PSA, cambios en la resonancia magnética) y recibieron tratamiento para el cáncer. El PSA descendió en un 4% de los casos del grupo experimental mientras que ascendió un 6% en el grupo control y la diferencia fue estadísticamente significativa (p=0,016). Con el suero de los pacientes se realizó un estudio ‘in vitro’ en el que se observó que las células de cáncer de próstata hormono sensibles LNCaP se inhibían 8 veces más con el suero del grupo experimental (70%) frente al suero del grupo control (9%). El descenso del PSA y la inhibición de las células LNCaP eran más evidentes en los casos que habían realizado cambios más intensos en la dieta y en el estilo de vida.
FACTORES DE RIESGO DE CÁNCER DE PRÓSTATA
Los hombres con factores de riesgo específicos tienen mayor probabilidad de desarrollar cáncer de próstata. Los factores de riesgo pueden ser modificables o no modificables y la combinación de ellos pone al individuo en mayor o menor riesgo de desarrollar esta enfermedad10.
Factores de riesgo no modificables: a- raza (el cáncer de próstata es más frecuente en los hombres de raza negra); b- edad avanzada; c- antecedentes familiares de cáncer de próstata (familiares de primer grado diagnosticados de cáncer de próstata antes de los 60 años) y d- mutaciones genéticas.
Factores de riesgo modificables: a- obesidad; b- consumo de tabaco; c- consumo de alcohol; d- elevado consumo de grasas animales; e- consumo de productos lácteos enteros y f- baja actividad física. Un bajo nivel socioeconómico y la dificultad de acceso a la atención sanitaria por vivir en áreas remotas son factores de riesgo adicionales que aumentan la mortalidad por cáncer de próstata.
Obesidad e índice de masa corporal (IMC). Los hombres obesos tienen mayor riesgo de desarrollar cáncer de próstata, los tumores son más agresivos y la mortalidad por cáncer es superior11,12. Los hombres con elevado índice de masa corporal (≥ 30 kg/m2), que se calcula dividiendo el peso corporal por la altura en metros cuadrados, tienen mayor riesgo de cáncer de próstata, lo que sugiere que la obesidad es un factor de riesgo independiente que se asocia con progresión del tumor y mayor mortalidad13. Incrementos de IMC de 5 kg/m2 aumentan un 20% la mortalidad por cáncer de próstata y un 21% la recidiva bioquímica (elevación del PSA tras un tratamiento inicial)14.

Fuente: IMOP-Berbés / Berbés Asociados (ARCHIVO)
También se ha correlacionado la circunferencia de la cintura y de la cadera con la incidencia de cáncer de próstata. En el estudio EPIC (European Prospective Investigation into Cancer and Nutrition) realizado en 8 países de Europa se asoció la altura del individuo, la circunferencia de la cintura y el índice entre la circunferencia de la cintura y la de la cadera con el riesgo de desarrollar esta enfermedad. Se controlaron 129.502 hombres sin cáncer de próstata15. Tras un seguimiento medio de 8,5 años, se diagnosticó cáncer de próstata a 2.446 hombres. La circunferencia de la cintura y el índice entre la cintura y la cadera se asociaron significativamente con el riesgo de presentar cáncer avanzado, lo que sugiere que el aumento de la grasa abdominal se asocia a cáncer de próstata avanzado. En otro estudio realizado en USA, la altura de los hombres se asoció con aumento del riesgo de cáncer avanzado. Los hombres que medían más de 189 cm. tenían mayor riesgo que los que medían 174 centímetros o menos16.
Los obesos también son más propensos a presentar niveles elevados de insulina y de glucosa en sangre. El consumo excesivo de carbohidratos refinados y con alto valor glucémico (azúcar, miel, harinas refinadas en panes y pastas, bebidas azucaradas, bollería industrial) condicionan obesidad, hiper-insulinemia e inflamación crónica17.
La inflamación crónica se ha asociado con varios tipos de cánceres como el cáncer de hígado, estómago, esófago, colon y próstata a través de la mutación del ADN producida por el daño oxidativo18. Las causas que producen inflamación crónica en la próstata son múltiples: desde la prostatitis por bacteria o química por el reflujo de orina, hasta factores ambientales o los hábitos dietéticos. La inflamación crónica se ha asociado también con la progresión del cáncer de próstata en las etapas finales de la enfermedad19.
Tabaquismo. Los fumadores tienen mayor riesgo de cáncer de próstata agresivo, de recidiva del tumor, de metástasis, y de morir por el cáncer frente a los no fumadores20.
En el estudio HPFS (Health Professionals Follow-up Study) con 5.366 hombres con cáncer de próstata seguidos entre 1986 y 2006, se observó que los sujetos que siguieron fumando presentaron un 60% más de probabilidades de que el tumor recidivara y de que murieran por el cáncer frente a los que no fumaban21. Los hombres que habían dejado de fumar más de 10 años antes o que habían dejado de fumar menos de 10 años antes, pero habían fumado menos de 20 cajas de cigarrillos por año, mostraron la misma mortalidad por cáncer de próstata que los que nunca habían fumado. Por el contrario, los que habían fumado más de 20 cajas por año presentaban riesgo similar al de los fumadores, aunque hubieran dejado de fumar menos de 10 años antes. En otro estudio se observó que, en el momento del diagnóstico, el tumor en los fumadores era más avanzado que en los no fumadores22.
Consumo de alcohol. Recientes estudios han mostrado que el elevado consumo de alcohol se asocia con la aparición de cáncer de próstata23,24. En un trabajo de meta-análisis se ha observado que el riesgo de desarrollar cáncer de próstata se incrementa significativamente al incrementarse el volumen de alcohol consumido a partir de 24 gramos por día, comparado con los hombres abstemios25. Recientemente se ha demostrado que los hombres diagnosticados de cáncer de próstata que consumen entre 15 y 30 gramos de alcohol por día en forma de vino tinto presentan menor riesgo de morir por este cáncer que los que no consumen nada de alcohol, lo que sugiere que el consumo de algo de vino tinto puede proteger contra la aparición del cáncer26.
Dieta rica en grasas animales. Dentro de los factores de riesgo más importantes para desarrollar cáncer de próstata se encuentran: a- el contenido de grasa animal en la dieta; b- la elevada ingesta calórica; c- la relación entre ácidos grasos omega 6 y omega 3; d- el consumo de carnes rojas o procesadas (embutidos, ahumados, etc.).

Autor/a: Liz Jones
Fuente: Flickr / Creative Commons
Una de las características de las dietas occidentales es el alto contenido de grasas animales saturadas y de grasas hidrogenadas poli-insaturadas (margarinas) como los ácidos grasos omega 6 que tienen propiedades pro-inflamatorias. El consumo de este tipo de dieta se ha asociado con el desarrollo de cáncer de próstata27-29. En un estudio realizado en el área de Barcelona se observó que el consumo de grasas animales se asociaba con mayor incidencia de cáncer de próstata30.
Los mecanismos exactos por los que la grasa incrementa el riesgo de tener un tumor prostático no son claros, pero se especula que todo ello puede estar relacionado con los niveles de testosterona, el stress oxidativo o el aumento del factor de crecimiento insulínico (IGF-1), dado que los individuos que consumen dietas ricas en grasas presentan valores elevados de IGF-131. En otro estudio, el consumo de grasa saturada se asoció solamente con cáncer de próstata avanzado32. Las grasas saturadas probablemente no son carcinógenos per se; sin embargo, al existir muchos productos químicos tóxicos en los procesos de cría de los animales (pesticidas, herbicidas), las toxinas que son cancerígenas alcanzan niveles elevados en la grasa de los animales. Del mismo modo, se observan elevadas concentraciones de estas toxinas en los productos lácteos y derivados (queso, yogurt, etc.).
Antes de la introducción en las dietas occidentales de los alimentos altamente procesados, la proporción de ácidos grasos omega 6 y omega 3 era de 2-3:1. En la actualidad, la proporción llega a ser de 30:1 y en Estados Unidos de 40:1 por el desmedido aumento de las grasas saturadas (carnes rojas, carnes procesadas, yema de huevo, leche entera y derivados), grasas trans (aceites vegetales que se producen de forma industrial al convertir aceite líquido en grasa sólida (margarinas) por un proceso de hidrogenación, y los ácidos grasos omega 6 poli insaturados (aceite de girasol).
La proporción recomendada es 4:1 o menor. Las grasas trans (margarinas) presentes en todos los alimentos procesados (bollería industrial) deberían ser eliminados de la dieta. Por el contrario, el consumo de ácidos grasos omega 3 (aceite de linaza, aceite de pescado, nueces) se asocia con un menor riesgo de desarrollar cáncer de próstata, probablemente porque disminuye los procesos inflamatorios. El aceite de oliva, que es una fuente de ácidos grasos omega 9, también posee efectos protectores contra varios cánceres, incluido el cáncer de próstata33.
Consumo de carne. Existen múltiples evidencias que muestran que, a mayor consumo de carnes rojas, mayor riesgo de desarrollar cáncer de próstata. Por otro lado, el consumo frecuente de carne vacuna cocinada a altas temperaturas en barbacoa, grill o frita, o el consumo frecuente de carnes curadas o ahumadas también incrementan el riesgo de cáncer de próstata34,35. Sin embargo, en otros estudios no se detectó correlación entre el consumo de carne y el cáncer de próstata36,37.
Con la cocción de la carne a altas temperaturas se producen aminas heterocíclicas e hidrocarbonos aromáticos poli-cíclicos, que son sustancias altamente carcinógenas que se generan cuando el músculo de vaca, pollo, cerdo o pescado recibe altas temperaturas. Así las cosas, la grasa y los jugos gotean sobre el fuego produciéndose llamas que contienen las aminas heterocíclicas, que quedan sobre la superficie de las carnes38,39.
Las carnes curadas o ahumadas contienen nitrosaminas (aminas y nitritos) utilizadas como conservantes que también son carcinógenas. Por el contrario, el consumo de carnes rojas poco hechas no se asocia con cáncer de próstata agresivo, lo que sugiere que el riesgo se relaciona más con la forma de cocinar la carne que con el consumo absoluto de la misma.
Consumo de calcio, leche y derivados. El consumo de leche entera se ha relacionado con riesgo de morir por cáncer de próstata40.
Varios estudios han mostrado que consumir más de 1.000 mg de calcio por día se asocia con riesgo elevado de desarrollar cáncer de próstata. Igualmente, los hombres diagnosticados de tumor prostático que consumían más de 200 ml de leche entera por día tenían mayor riesgo de que el tumor progresara que los que tomaban menos de 100 ml de leche entera por día. Por el contrario, los hombres que consumían leche desnatada no presentaban esa evolución negativa.
En un estudio realizado en España, se observó que el desarrollo de cáncer de próstata se relacionaba con el consumo de productos lácteos41. No obstante, en una investigación realizada en Estados Unidos no se ha demostrado relación entre el consumo de leche y el cáncer de próstata42.

Autor/a: congerdesign
Fuente: Pìxabay (free photo)
El consumo de leche entera se ha relacionado con la recidiva del cáncer de próstata. En un estudio se observó que los hombres que consumían leche entera más de 4 veces por semana tenían un 73% más de probabilidades de presentar recidiva del cáncer de próstata que los que consumían menos. Estos resultados no se producían en los hombres que consumían leche desnatada43.
Sueño. En 2007 la Agencia Internacional para la Investigación del Cáncer calificó al trabajo en turnos como probablemente carcinógeno para los humanos, por la alteración que produce en el ritmo circadiano (Grupo 2A)44.
El insomnio y otros problemas del sueño se asocian con riesgo aumentado de desarrollar cáncer de próstata. En un estudio se observó que los hombres que no se encontraban descansados al levantarse tenían mayor riesgo de morir por cáncer de próstata que los que referían que se encontraban descansados45.
Los hombres con mayor dificultad para dormir presentan el doble de posibilidades de cáncer de próstata frente a los hombres que duermen bien. Además, el riesgo de cáncer de próstata avanzado fue dos o tres veces superior en los hombres con problemas muy severos para dormir. Obviamente, si la alteración del sueño se mantiene pocos meses no aumenta el riesgo de cáncer o de otras enfermedades; ésta se debe mantener 10-20 años para que aumente el riesgo.
En un estudio realizado en Islandia con 2.100 hombres a los que se les interrogó sobre su forma de dormir, se observó que en los sujetos que presentaban problemas severos para dormir el riesgo de desarrollar cáncer de próstata aumentaba un 70% comparado con los que dormían normalmente. El riesgo global de cáncer de próstata era 2 veces mayor en los hombres con problemas muy severos para dormir. El riesgo de desarrollar cáncer avanzado era 2 veces superior si el problema para dormir era severo o 3 veces superior si el problema para dormir era muy severo46. Cuando se midieron los niveles de melatonina matinal, los hombres que tenían los niveles más bajos eran los que presentaban mayores problemas para dormir. Estos hombres tenían de media 4 veces más riesgo de presentar cáncer de próstata avanzado comparado con los casos que tenían niveles de melatonina superiores a la media46.
En un estudio realizado en 164 países en el que se relacionó la exposición a luz durante la noche con la aparición de cáncer de próstata, se observó una asociación positiva. No se observó esta asociación en otros cánceres como el de pulmón o el colo-rectal47. Se especula que la causa sea la supresión de la melatonina producida por la exposición a la luz eléctrica durante la noche48. La melatonina se produce por la noche en oscuridad y en estudios experimentales se ha demostrado que tiene propiedades antitumorales en el cáncer de próstata49-52.
La disrupción del sueño y la exposición a la luz durante la noche afectan negativamente el sistema inmunitario. En los países con mayor exposición a luz nocturna, la incidencia de cáncer de próstata es superior que en los países menos desarrollados que tienen menor exposición a la luz nocturna. En un estudio realizado en Barcelona y Madrid se observó que la exposición a luz de espectro azul se asociaba con mayor incidencia de cáncer de próstata y de mama53. Además, los hombres que dormían en oscuridad total tenían menor riesgo de cáncer de próstata que los hombres que dormían con el dormitorio algo iluminado.
Respecto al trabajo diurno o nocturno, se ha observado que los trabajadores en turnos nocturnos presentan mayor incidencia de cáncer de próstata que los trabajadores en turnos diurnos54. En un trabajo de meta-análisis con cerca de 2 millones y medio de individuos, se demostró que los trabajadores del turno de noche presentaban mayor riesgo de tener cáncer de próstata55.
En un estudio de meta-análisis se observó que los pilotos de aviación tenían mayor riesgo de presentar cáncer de próstata56. Por el contrario, en otros estudios no se observó relación entre el riesgo de desarrollar cáncer de próstata y el turno de trabajo o las alteraciones del sueño57, 58.
¿QUÉ DEBEMOS HACER?

Autor/a: Yintan [at en.wikipedia]
Fuente: Transferred from en.wikipedia; transferred to Commons by User:Bobamnertiopsis using CommonsHelper. / Wikimedia Commons
Luego del diagnóstico y tratamiento del cáncer de próstata, los cambios que se realicen en el estilo de vida pueden tener repercusiones en la recidiva del tumor y en la sobrevida, ya que por ejemplo el tabaquismo y la obesidad afectan negativamente. Por el contrario, el inicio de actividad física diaria intensa o moderada y los cambios en la dieta incorporando frutas, verduras, pescado con elevado contenido de ácidos grados omega 3, legumbres y aceite de oliva, y limitando el consumo de grasas saturadas, productos procesados y ultra-procesados (margarinas, bollería industrial, harina y azúcares refinados, embutidos), la mejoran59.
Cambios en el estilo de vida. Varios estudios han mostrado que llevar un estilo de vida saludable consistente en no fumar, mantener un peso corporal normal, dormir con un sueño de buena calidad un mínimo de 6-8 horas, y realizar una actividad física intensa y una dieta equilibrada puede disminuir el riesgo de cáncer de próstata9, 60.
Ejercicio. Todas las guías oncológicas sugieren que los individuos con cáncer deben realizar una combinación de ejercicios aeróbicos y de resistencia (pesas y aparatos) 3-5 veces por semana de intensidad moderada durante 20-30 minutos. Lamentablemente, sólo entre un 15% y un 50% de los hombres con cáncer de próstata cumplen las recomendaciones relacionadas con el ejercicio, lo que significa que la mayoría de los pacientes con cáncer de próstata no se están beneficiando de la realización de ejercicio físico.
En un meta-análisis con 53 estudios en los que se compararon los resultados de la actividad física en pacientes con cáncer, se observó que los que practicaban actividad física en diferentes formas (ciclismo, caminata, yoga, pesas y aparatos, etc.) presentaban mejoría en varios aspectos como la calidad de vida, disminución de la fatiga, disminución de la ansiedad y depresión, y mejoría de las alteraciones del sueño61. Los efectos positivos del ejercicio eran más intensos si la intensidad era alta o moderada frente a los de baja intensidad. Los efectos positivos del ejercicio se producen tanto durante como posteriormente a los tratamientos oncológicos, por lo que deberían estar incluidos en todos los procesos terapéuticos62.
El ejercicio aeróbico (correr, ciclismo, caminar rápido, natación, etc.), sobre todo si es vigoroso, puede reducir la progresión del cáncer de próstata y la mortalidad por el tumor a través de varios mecanismos como la reducción de la inflamación o del estrés oxidativo. Los hombres que caminaban más de 90 minutos a paso rápido tenían un 46% de menor mortalidad comparado con los que caminaban menos. La mortalidad se reducía un 49% en los que hacían más de 3 horas de actividad física por semana63.
En un estudio observacional realizado entre 1998 y 2010 con 2.299 hombres diagnosticados de cáncer próstata sin metástasis dentro del Health Professionals Follow-up Study, se relacionó la actividad física realizada con el riesgo de mortalidad a 10 años, que globalmente era del 15,4%64. Se observó que la mortalidad era del 13% y 11% en los hombres que realizaban ≥1,25 y ≥ 2,5 horas por semana respectivamente de ejercicio vigoroso y del 14% y 12,6% si realizaban ≥ 2,5 o ≥5 horas por semana de ejercicio moderado. Los resultados del trabajo sugieren que, a mayor intensidad de la actividad física, mayor sobrevida.
Por otro lado, la actividad física es muy importante para evitar la aparición de cáncer de próstata65. Los hombres que realizan más ejercicio físico presentan menor incidencia de esta enfermedad comparado con los que realizan poco ejercicio. Además, el ejercicio ayuda a mantener un peso corporal normal, mientras que la obesidad es un factor de riesgo de presentar cáncer de próstata.
Dormir bien. No hay un número mágico de horas de sueño ideal. El individuo debe sentirse descansado cuando se levanta y debe desarrollar sus actividades normales durante el día sin sentirse cansado. Se debe considerar que dormir no es una pérdida de tiempo y deberíamos darle la misma importancia que al ejercicio o a lo que comemos. Dormir poco o dormir mucho son contraproducentes para nuestra salud. La Academia Americana de Medicina del Sueño recomienda dormir al menos 7 horas cada noche66. Otro de los elementos muy importantes a tener en cuenta es que se debe dormir en oscuridad total, ya que la luz eléctrica durante el sueño altera, por un lado, el reloj biológico, y por otro impide la liberación de melatonina, que regula los ciclos circadianos y tiene propiedades anticáncer67.

Autor/a: Free-Photos
Fuente: Pixabay (free photo)
Dieta. Los pacientes con cáncer de próstata o mama que recidivan presentan niveles elevados de marcadores pro inflamatorios como las interleucinas 6 y 8 (IL-6, IL-8), o el factor de necrosis tisular (TNF-alfa)68. Una ingesta alta de alimentos con propiedades antiinflamatorias y antioxidantes disminuye la probabilidad de que el cáncer de próstata o de mama recidive comparado con los casos con ingesta baja de esos alimentos69.
Si se modifica la dieta aumentando el consumo de frutas, vegetales, cereales y pescados con alto contenido de ácidos grasos omega 3 (salmón, sardinas, etc.) se reduce significativamente la recidiva del cáncer70.
La dieta mediterránea -consistente en un consumo elevado de frutas y vegetales, cereales, frutos secos (almendras, nueces), semillas, aceite de oliva virgen extra como fuente principal de grasas, consumo moderado de quesos y yogurt, bajo consumo de azúcares o harinas refinadas y de carnes rojas o procesadas y elevado consumo de pescado- ha mostrado su beneficio para disminuir el riesgo de padecer cáncer de próstata o para reducir la aparición de recidiva en los casos que lo han desarrollado71.
El principal componente de la dieta mediterránea es el aceite de oliva, que es rico en ácidos grasos omega 9 y tiene propiedades antiinflamatorias. Además, los polifenoles de los vegetales y las frutas poseen propiedades antioxidantes que frenan el crecimiento de las células tumorales y la progresión de los tumores. El efecto protector de la dieta mediterránea contra el cáncer de próstata está dado también por el elevado consumo de tomates en salsa con elevadas concentraciones de licopeno, que es un producto con propiedades anticáncer72.
La dieta mediterránea posee una alta capacidad antiinflamatoria, en tanto que reduce los niveles en sangre de los marcadores pro-inflamatorios (IL-6, IL-8 y TNF alfa) tras 3-12 meses de iniciar su consumo73. La dieta japonesa también es anticáncer, ya que se basa en un elevado consumo de pescados, soja, jengibre, setas con propiedades medicinales, algas y un bajo consumo de carnes rojas74.
En el estudio EPIC (European Prospective Investigation into Cancer) realizado en 8 países europeos con 142.239 hombres se observó que, tras un seguimiento medio de 13,9 años, se detectaron 7.036 casos de cáncer de próstata. Los hombres con un consumo total de frutas más alto presentaban menor riesgo de cáncer de próstata75. No se observó asociación con el tipo de fruta consumida excepto con el consumo de cítricos.
Otros estudios han mostrado que la dieta más efectiva para reducir el riesgo de cáncer de próstata consiste en un bajo consumo de lácteos y de carnes rojas o procesadas y un alto consumo de frutas, vegetales, granos, pescados, cúrcuma, jengibre y té verde76-78. La fruta y los vegetales tienen un alto contenido de fitoquímicos con propiedades antioxidantes que no solo tienen propiedades para la prevención del cáncer, sino que también son importantes en la sobrevida de los individuos que lo presentan79.
¿QUÉ SE DEBE COMER?
Frutas y vegetales.
Los individuos que consumen una dieta vegetariana presentan menor incidencia de cáncer de próstata, por lo que este tipo de dieta protege contra la aparición del tumor80.

Unas nueces
Fuente: Archivo
Los alimentos ricos en sustancias antioxidantes son: granada, tomates, vegetales de hojas verdes (espinacas, acelgas, kale), frutas de colores oscuros (arándanos, moras, frambuesas, fresas), nueces, semillas y verduras crucíferas (brócoli, coliflor, repollos de Bruselas)81. En los vegetales de hojas verdes se pueden encontrar al menos 13 diferentes tipos de flavonoides con propiedades anticáncer82. La neoxantina es un carotenoide presente en la espinaca y otros vegetales de hojas verdes; se ha observado que reduce la viabilidad de las células de cáncer de próstata humano y disminuye la incidencia de cáncer de próstata agresivo83.
Soja.
Los alimentos ricos en isoflavonas (genisteina y daidzeina) como la soja, miso, tofu, natto, alubias, lentejas, guisantes… poseen propiedades para la prevención del cáncer de próstata e impiden la invasión de los tejidos y la formación de metástasis84. En un reciente estudio de meta-análisis se ha demostrado que el consumo de soja de forma natural (leche, tofu) o fermentada (natto) reduce de forma estadísticamente significativa el riesgo de cáncer de próstata, lo que corrobora los resultados de estudios previos in vivo e in vitro que mostraban que las isoflavonas de la soja inhiben el desarrollo y el crecimiento tumoral85.
En los países asiáticos donde se consumen elevadas cantidades de soja y derivados la incidencia de cáncer de próstata es significativamente más baja que en los países occidentales en los que el consumo es muy reducido86.
En un estudio realizado con pacientes con cáncer de próstata programados para cirugía radical, los que consumían 50 gramos de soja por día mostraban, a las 3 semanas, disminución de las cifras de PSA comparados con los que no la consumían87.
Tomates y otros alimentos ricos en licopeno.
El licopeno es un carotenoide muy abundante en el tomate y en sus productos (salsas, concentrado, etc.) Otras fuentes de licopeno son la sandía, papaya y el pomelo rosa. La mayor absorción a nivel intestinal del licopeno y de otros carotinoides se consigue cocinándolo en un medio aceitoso (son muy lipofílicos), ya que se rompen las membranas celulares y se libera el licopeno. Por ello, las salsas de tomate o el tomate frito contienen más licopeno que los tomates al natural en ensaladas.
En estudios en animales se ha observado que el licopeno ejerce efectos antiproliferativos y detiene el ciclo celular, y produce la muerte de las células tumorales por apoptosis88. Además, el licopeno reduce el factor de crecimiento insulínico (IGF-1), que se asocia con un incremento del riesgo de cáncer de próstata89.
Varios estudios han demostrado que el consumo de licopeno puede ayudar a prevenir el cáncer de próstata y a disminuir la progresión en los pacientes que tienen cáncer90-92.

Autor/a: mojzagrebinfo
Fuente: Pixabay (free photo)
En una investigación con 40 pacientes con neoplasia intraepitelial de alto grado (PIN), que es una lesión premaligna de cáncer de próstata, los sujetos se dividieron en 2 grupos: uno recibió cápsulas con 4 mg de licopeno dos veces por día durante un año, mientras que el otro grupo no recibió nada93. Al repetir la biopsia al año, se observó que el licopeno retrasaba o prevenía la transformación del PIN en cáncer de próstata.
En otro estudio con pacientes con PIN, que fueron tratados diariamente durante 6 meses con cápsulas con 30 mg de licopeno o placebo se observó, en una nueva biopsia, que el PIN era menos extenso en los que habían recibido licopeno94.
En una investigación con 79 pacientes con cáncer de próstata que estaban esperando para someterse a tratamiento curativo, los individuos se aleatorizaron en 3 grupos: uno recibió diariamente productos del tomate con 30 milígramos de licopeno; otro grupo recibió productos del tomate, selenio, ácidos grasos omega-3, isoflavonas de soja, zumo de granada y de uva y té verde y negro, y el tercer grupo consumió una dieta control durante 3 semanas95. Globalmente (todas las categorías de cáncer) no se observaron diferencias en los valores de PSA de los 3 grupos. Sin embargo, considerando los pacientes con cáncer de riesgo intermedio (según el grado de Gleason), el PSA descendió significativamente en el grupo que consumió licopeno (grupos 1 y 2) comparado con el grupo control. El PSA descendió más en los pacientes que consumieron más licopeno.
En pacientes con cáncer de próstata metastásico, se observó que en los que se asoció licopeno a la orquiectomía, el PSA era más bajo que en los casos tratados solo con orquiectomía96. En los que recibieron licopeno, el PSA estaba por debajo de 4 ng/ml en un mayor porcentaje de casos frente a los que no lo consumieron (78% frente a un 40%). La mortalidad fue menor en los que consumieron licopeno (13% versus 22%).
El efecto preventivo del licopeno es mayor si el consumo se hace en base a salsa de tomate frente a tomate crudo, dado que el calor rompe las membranas celulares liberándose el licopeno, que al ser una molécula lipofílica se potencia con el aceite97.
Fibra y lignanos.
Los lignanos se encuentran en las semillas, granos, vegetales, frutas y legumbres, pero el mayor contenido se encuentra en las semillas de lino y en segundo lugar en las semillas de sésamo98. Otras fuentes ricas en lignanos son: arroz rojo, arroz salvaje, quinoa, avena, espelta, cebada, salvado, centeno, aceite de oliva virgen extra, vegetales de hoja verde, pimientos, zanahoria y calabacín. Las frutas tienen menor contenido de lignanos que las semillas o los vegetales. El consumo de alimentos ricos en lignanos previene la aparición de enfermedades crónicas como algunos cánceres y las enfermedades cardiovasculares. Los efectos antitumorales de los lignanos se ejercen a través de sus propiedades antioxidantes y antiinflamatorias99.
Las dietas ricas en lignanos se han asociado con un riesgo reducido de cáncer de próstata100. En un estudio realizado en la Universidad de Duke (USA) se agregaron 30 gramos de semillas de lino a 25 pacientes en espera para realizar cirugía radical por cáncer de próstata. Durante el estudio se observó un descenso de la testosterona y de la proliferación de las células, así como un aumento de la muerte celular por apoptosis101. Se aconseja a los pacientes con cáncer de próstata suplementar su dieta con 3 cucharadas de semillas de lino por día incorporándolas a sopas, cereales o yogurt desnatado.
Pescado y ácidos grasos omega 3.
Los ácidos grasos omega-3 se encuentran en alimentos como el pescado y la linaza obtenida de las semillas de lino, y en suplementos dietéticos como el aceite de pescado. Los más importantes son el ácido alfa-linoleico (ALA), cuya principal fuente son los aceites vegetales como el aceite de linaza, de soja y de canola; el ácido eicosapentaenoico (EPA) y el ácido docosahexaenoico (DHA). Los dos últimos son más abundantes en pescados de agua fría (salmón, trucha, anchoa, sardina, caballa, arenque, atún), crustáceos y en algunas algas. Para garantizar la ingesta recomendada de EPA y DHA se deben consumir al menos 200 gramos o dos raciones por semana de pescados grasos (salmón, trucha) o pescados azules (atún, caballa, sardinas, etc.). El ALA es un ácido graso esencial, lo que significa que solo se puede obtener con el consumo diario de nueces y semillas (lino, chía, sésamo). Los suplementos dietéticos de Omega-3 incluyen el aceite de pescado, el aceite de krill y el aceite de hígado de bacalao.

Sardinas
Autor/a de la imagen: José Antonio Gil Martínez (originally posted to Flickr as Sardinas)
Fuente: Wikimedia Commons
En estudios de experimentación se ha observado que los ácidos grasos omega-3 impiden la iniciación y la proliferación de muchos cánceres, incluido el cáncer de próstata, e inducen la muerte de las células tumorales por apoptosis102. El EPA y el DHA impiden el crecimiento, la invasión y la migración de células de cáncer de próstata resistente a las hormonas103.
Los omega-3 presentes en las semillas de lino y en las nueces también poseen propiedades en la prevención del cáncer, ya que son antiinflamatorios.
En un estudio realizado en España se observó que el consumo de nueces y pescado protege contra el cáncer de próstata y reduce su agresividad104.
Varios trabajos epidemiológicos han mostrado que el consumo de pescado 3-4 veces por semana reducía significativamente la aparición de cáncer de próstata105-107. Estos resultados son más evidentes cuando se reduce el consumo de carnes rojas, de productos lácteos, de grasas hidrogenadas (margarinas) y de aceites vegetales no saturados (palma, girasol) con alto contenido de ácidos grasos omega 6 típicos de la comida procesada de la dieta americana108,109.
En un estudio de meta-análisis que incluyó 44 estudios caso control o de cohorte, se analizó la utilidad del consumo de suplementos de aceite de pescado en hombres con cáncer de próstata110. Se observó descenso de marcadores de inflamación u otros marcadores tumorales, aunque no se observó descenso en las cifras de PSA. La mortalidad por cáncer de próstata fue inferior en los que consumían suplemento de ácidos grasos omega-3.
Los pacientes con cáncer de próstata se pueden beneficiar del suplemento de 1-3 gramos por día de omega-3 en forma de cápsulas de aceite de pescado.
Té verde.
El té verde contiene polifenoles con potentes propiedades antioxidantes. La sustancia más abundante es epigalocatequina-3-galate (EGQG). Los mecanismos a través de los cuales se producen los efectos antitumorales son: detención del ciclo celular y la muerte por apoptosis de las células malignas; inhibición de NF-ĸβ y de la ciclooxigenasa-2 (COX-2) relacionadas con la inflamación y modulación de IGF y del receptor de andrógenos111-114.
En un meta-análisis se demostró que al incrementarse el consumo de té verde por encima de 7 tazas por día se reducía el riesgo de cáncer de próstata, por lo que las catequinas eran efectivas para prevenirlo115.
En otro estudio se observó que el consumo de té verde podía proteger contra el cáncer de próstata de bajo grado, pero no contra el cáncer avanzado116.
En un modelo de cáncer prostático en ratones se observó que la administración oral de extracto de té verde durante 24 semanas disminuía en un 40% la aparición de cáncer de próstata. Además, se evitaba la aparición de metástasis y mejoraba la sobrevida un 70% comparado con los animales utilizados como controles. Similares resultados se observaron con otros modelos de cáncer de próstata en ratones.
En un estudio clínico con 60 varones a los que se les había diagnosticado con biopsia una lesión premaligna de cáncer de próstata (PIN) se analizó el resultado del tratamiento con 600 mg de catequinas de té verde o placebo117. Tras un año de tratamiento, se realizó biopsia de próstata y se observó que solo uno de los 30 casos que recibieron catequinas desarrolló cáncer, mientras que se detectó cáncer en 9 de los 30 casos tratados con placebo. Estos resultados sugieren que las catequinas del té verde son efectivas para prevenir el cáncer de próstata en hombres con alto riesgo de desarrollarlo. A los 2 años se realizó otra biopsia de próstata y se encontró cáncer en 2 de 9 casos que habían sido tratados con placebo y en uno de los 13 casos que habían sido tratados con catequinas, aunque habían suspendido el tratamiento un año antes118.
En otra investigación con varones diagnosticados de cáncer de próstata que se trataron con 800 mg de catequinas de té verde durante el intervalo entre la biopsia y la prostatectomía radical, se observó un descenso significativo del PSA y de varios factores de crecimiento.

Detalle de una granada
Autor/a de la imagen: Diego Delso
Fuente: Wikipedia
Cuando se analizaron diferentes tipos de té, se constató que los efectos protectores del té verde no se observaban con el té negro, ya que al ser fermentado el contenido de catequinas es muy inferior119.
En una revisión de la biblioteca Cochrane, cuando se comparó el consumo más alto de té con el más bajo se encontró menor incidencia de cáncer de próstata. Por el contrario, no se encontró asociación entre el consumo de té verde y la mortalidad por cáncer120.
Granada.
Utilizada desde hace miles de años por sus efectos beneficiosos sobre la salud, la granada posee múltiples propiedades antitumorales demostradas en estudios de experimentación y con animales121. Los constituyentes de la granada con mayores propiedades antioxidantes y antiinflamatorias son los taninos hidrolizables ácido elágico y púnicalaginos, que son los responsables del 92% de los efectos beneficiosos de la granada122. Varios estudios de experimentación han mostrado que diferentes partes de la granada (fruta, pieles, cáscara, semillas, etc.) al natural o fermentadas poseen efectos antitumorales123-126. Los mecanismos a través de los cuales se ejercen son: 1- efectos antiproliferativos y pro-apoptosis; 2- inhibición del factor nuclear κB (NF-κB); 3- bloqueo de angiogénesis (formación de nuevos vasos sanguíneos); 4- detiene la invasión del tumor; 5- efectos antiinflamatorios.
Recientemente, en un estudio con ratones se observó que el extracto de granada puede ser efectivo en el tratamiento del cáncer de próstata metastásico resistente a las hormonas127.
La utilidad clínica del zumo de granada en pacientes con cáncer de próstata que habían fracasado al tratamiento inicial (cirugía, radioterapia) se demostró con un estudio clínico en fase II128. Se trataron 46 pacientes con 240 mL de zumo de granada por día hasta la progresión de la enfermedad. El PSA inicial era menor de 5 ng/mL. Ningún paciente tenía metástasis ni había recibido tratamiento hormonal. El seguimiento se realizó cada 3 meses con determinación de PSA. El objetivo final del estudio fue la variación en las cifras de PSA, como por ejemplo el tiempo de duplicación. En 16 casos (35%) se observó disminución del PSA, que en 4 casos fue mayor del 50%. El tiempo de duplicación del PSA (PSADT), que al inicio era de 15 meses de media, se incrementó significativamente hasta los 54 meses (p<0,001).
En un ensayo fase II, aleatorizado y multicéntrico, se trataron 104 pacientes con cáncer de próstata que mostraron elevación del PSA después del tratamiento inicial129. El tratamiento consistió en 1 o 3 gramos de extracto de granada durante 18 meses. Globalmente, el tiempo de duplicación del PSA aumentó más de 6 meses al final del estudio (de 11,9 meses a 18,5 meses) y la diferencia fue estadísticamente significativa. El aumento del tiempo de duplicación del PSA fue similar entre las dos dosis de extracto de granada. En un 43% de los casos el tiempo de duplicación del PSA se incrementó en más de un 100% con respecto al valor inicial. Al final del estudio, en un 13% de los casos el PSA había descendido. Como efecto secundario, los casos que recibieron 3 gramos de extracto de granada presentaron más diarrea que los que recibieron 1 gr (13,5% frente a 1,9%).
Las diferencias observadas entre los 2 estudios en la duplicación del PSA pueden ser explicadas porque, en el primer estudio, los pacientes debían tener un PSA inicial menor de 5 ng/mL, mientras que en el segundo estudio el 32% de los casos tenían un PSA mayor de 5 ng/mL, llegando hasta 32 ng/mL, lo que indica que la población del segundo estudio tenía enfermedad más avanzada, por lo que podía responder menos130.
En otro ensayo clínico fase IIb con pacientes con cáncer de próstata avanzado con PSA por encima de 5 ng/mL se comparó el tratamiento con 500 ml de zumo de granada o un líquido placebo durante 4 semanas131. Posteriormente, todos los casos recibieron 250 ml de zumo de granada durante 4 semanas más. El PSA se determinó al inicio, a los 14, 28 y 56 días. El objetivo fue detectar diferencias significativas en el PSA entre los dos tratamientos. Se incluyeron 102 casos y el 68% de ellos tenían cáncer de próstata resistente al tratamiento hormonal (cánceres muy avanzados). Al final del estudio no se observaron diferencias en los niveles de PSA entre los 2 grupos; lo que puede tener dos explicaciones: que el zumo de granada no es efectivo en los casos con tumor muy avanzado, o que el período de tratamiento fue demasiado corto como para observar diferencias.

Unos rábanos
Autor/a de la imagen; © Benoît Prieur / Wikimedia Commons
Fuente: Wikimedia Commons
En un ensayo clínico con 183 casos se estudió el tiempo de duplicación del PSA en pacientes con cáncer de próstata que habían recidivado tras un tratamiento inicial132. En 102 pacientes se utilizó extracto de granada, en 64 casos se utilizó placebo y en 17 casos zumo de granada. La mediana del tiempo de duplicación de PSA aumentó de 11 meses a 15,6 meses en el grupo placebo. En los que recibieron extracto de granada aumentó de 3 meses a 14,5 meses, mientras que en los casos que recibieron zumo de granada aumentó de 12,7 a 20,3 meses. Los cambios no fueron significativos entre los 3 grupos. Solo se observaron diferencias significativas en los pacientes tratados con extracto de granada que tenían el genotipo AA (alanina-alanina) de la enzima manganeso superóxido dismutasa (MnSOD), que es la principal enzima antioxidante en el interior de la mitocondria. En esos casos el tiempo de duplicación del PSA pasó de 13,6 meses al inicio a 25,6 meses al final del estudio. Los portadores del genotipo AA pueden ser más sensibles a los efectos antitumorales de la granada. El genotipo AA se ha asociado con cáncer de próstata más agresivo y con más sensibilidad a los antioxidantes que los genotipos AV (alanina-valina) y VV (valina-valina).
Verduras crucíferas.
El consumo de verduras crucíferas (brócoli, coliflor, repollo, coles de Bruselas, grelos, berza, lombarda, kale, rúcula, mostaza, rábanos) se asocia con menor incidencia de enfermedades crónicas como la diabetes, las enfermedades cardiovasculares y el cáncer133. Los efectos beneficiosos de las verduras crucíferas se deben a la presencia de glucosinolato, que se activa al ponerse en contacto con una enzima llamada mirosinasa que se encuentra en la misma planta. Ello sucede cuando masticamos o cortamos cualquiera de las verduras crucíferas. La acción de la mirosinasa produce indol-3-carbinol y sulforafano, este último el desintoxicador natural más potente. Además, es antioxidante, antiinflamatorio e inhibe la producción de citocinas, que son sustancias que favorecen la inflamación. El efecto antioxidante se realiza a través de la activación de genes que mejoran la respuesta al estrés oxidativo.
El sulforafano y el indol-3-carbinol han mostrado propiedades antitumorales en varios tipos de cáncer (próstata, mama, páncreas, pulmón, colo-rectal y cuello uterino)134. Sus efectos se ejercen a través de la desintoxicación de carcinógenos y de la inhibición de la proliferación de las células malignas al bloquear el ciclo celular. Además, promueven la apoptosis y bloquean la formación de nuevos vasos por el tumor (angiogénesis)135. También se ha demostrado que potencian la actividad de varios agentes quimioterápicos como los taxanos (docetaxel y paclitaxel) y la gemcitabina136.
Al cocinar las crucíferas debemos tener en cuenta que el glucosinolato se inactiva por el calor y se pierde en el agua de la cocción, por lo que no se deben hervir, sino que se debe preparar al vapor (3-5 minutos), rehogadas con un poco de aceite de oliva o al microondas (en recipiente tapado sin agua). La mirosinasa se inactiva completamente tras cocinarla a 60ºC durante 10 minutos.
El brócoli crudo proporciona 10 veces más sulforafano que el hervido y 3 veces más que el cocinado al vapor137. Las crucíferas cocinadas se pueden suplementar con mostaza porque contiene grandes cantidades de mirosinasa, por lo que la absorción del sulforafano se puede aumentar hasta cuatro veces. También se pierde mirosinasa al congelar el brócoli, por lo que agregando mostaza la sustituimos. La fermentación del repollo en salmuera para producir chucrut también reduce la concentración de sulforafano y mirosinasa. Mantener las crucíferas en nevera a 4ºC durante 7-8 días produce la inactivación del sulforafano en un porcentaje que oscila entre el 12% y el 27% dependiendo del tipo de crucífera.
Las personas con hipotiroidismo deben moderar el consumo de crucíferas, puesto que los glucosinolatos pueden interferir en la incorporación de yodo al tiroides. Los suplementos comerciales de glucosinolatos generalmente no contienen mirosinasa, por lo que sus efectos beneficiosos son muy inferiores a los producidos por el brócoli natural138.
En estudios clínicos se ha observado que el brócoli ayuda a prevenir la aparición de cáncer139,140. En un meta-análisis con 13 estudios de cohorte o caso-control analizando la asociación entre el consumo de verduras crucíferas y el riesgo de desarrollar cáncer de próstata, se observó en todos los estudios que el consumo elevado de crucíferas se asociaba con un descenso del 10% en el riesgo de cáncer de próstata, mientras que el descenso fue del 21% en los estudios caso-control141.

Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
En un ensayo clínico con 78 pacientes con cáncer de próstata tratados con cirugía radical en los que se elevó el PSA tras la cirugía (recidiva bioquímica), se realizó tratamiento con 60 mg de sulforafano o placebo durante 6 meses. El PSA se elevó más del 20% en un 72% de los casos tratados con placebo, mientras que en los tratados con sulforafano el incremento se observó en un 44% de los casos. El tiempo de duplicación del PSA fue un 86% más largo en los tratados con sulforafano comparado con los tratados con placebo (28.9 y 15.5 meses, respectivamente)142.
En un estudio en el que 20 pacientes con recidiva de cáncer de próstata fueron tratados con 200 µmoles por día de sulforafano durante 20 semanas se observó que el tiempo de duplicación del PSA, que era de 6,1 meses antes del tratamiento, pasó a 9,6 meses al final del tratamiento143.
En Europa se realizó un estudio caso-control con 1.294 pacientes con cáncer de próstata y 17.000 casos de control144. Se observó que los que consumían más crucíferas presentaban menos cáncer que los que consumían menos.
Un estudio con 1.560 casos de cáncer de próstata mostró que el consumo de crucíferas se asociaba con una disminución del 59% en el riesgo de progresión del cáncer145.
En un trabajo experimental con células de cáncer de próstata resistente a las hormonas (PC-3 y DU 145) se observó que los productos de degradación del glucosinolato presente en las crucíferas sensibilizan a las células malignas a la acción del quimioterápico docetaxel, lo que abre las puertas a que la asociación pueda ser utilizada en humanos en el futuro146.
Cúrcuma.
La cúrcuma, conocida como turmeric, se obtiene de las raíces de la planta cúrcuma longa. Es una especie de color amarillo utilizada en la gastronomía asiática y constituye el principal componente del curry. Su consumo es seguro incluso a grandes dosis (hasta 12 gramos). La cúrcuma se utiliza desde hace cientos de años en la medicina ayurvédica por sus múltiples propiedades curativas para varias enfermedades. Los efectos medicinales se deben a la presencia de unos polifenoles conocidos como curcominoides, siendo el más frecuente el curcumino147.
Uno de los inconvenientes de la cúrcuma es su baja biodisponibilidad debido a que se metaboliza muy rápidamente en el hígado. La utilización conjunta con pimienta potencia su absorción. Se están desarrollando curcominoides sintéticos para superar esta limitación.
La cúrcuma posee efectos anticáncer a través de sus propiedades antiinflamatorias y antioxidantes. Además, detiene el crecimiento de las células malignas induciendo a apoptosis, y bloquea la invasión del tumor148. Sus efectos antitumorales se ejercen a través de varias vías, entre las cuales se encuentra la inhibición del factor de crecimiento vascular (VEGF), por lo que bloquea la formación de nuevos vasos sanguíneos. También inhibe el NF‐κB, el oncogén Bcl-2 y la COX-2, por lo cual reduce la aparición de metástasis149. Además, inhibe las interleucinas IL-1b, IL-6, FNT-alfa. Éstas parecen estar relacionadas con algunos cánceres cuando hay una mala regulación.
Varios estudios epidemiológicos han correlacionado su consumo con una disminución de la incidencia de varios cánceres, entre los cuales se encuentra el cáncer de próstata150. En estudios de experimentación se ha observado que detiene el crecimiento de células de cáncer de próstata hormono sensibles y hormono resistentes151.

Una fresa
Autor/a de la imagen: Theo Crazzolara – Erdbeere
Fuente. Wikipedia
La cúrcuma asociada a isoflavonas ha mostrado que reduce el PSA en pacientes con cifras superiores a 10 ng/ml152. En un estudio clínico aleatorizado y doble ciego, a los pacientes con cáncer de próstata se les administró cúrcuma o placebo una semana antes de iniciar el tratamiento con radioterapia153. Se midieron en sangre los niveles de marcadores del estado oxidativo antes de iniciar la radioterapia y 3 meses después de haberla finalizado. Se observó un incremento significativo de la capacidad anti-oxidativa total en los casos tratados con cúrcuma.
Si se asocia cúrcuma a un agente quimioterápico como el 5-fluoracilo o el paclitaxel, se potencia la actividad antitumoral de los mismos154. La utilización de cúrcuma puede potenciar el efecto de los anticoagulantes, por lo que se debe vigilar su uso en los pacientes que deben ser operados.
Frutos rojos.
Los frutos rojos (frambuesas, arándanos, fresas, moras) contienen productos fitoquímicos con propiedades biológicas como antioxidantes, anticáncer, antineurodegenerativas y antiinflamatorias. Contienen variadas concentraciones de fenoles (antocianinas, flavonoles, proantocianidinas, ácido elágico, etc.) que actúan en varias etapas del proceso de la carcinogénesis155.
Antocianinas: los arándanos son las frutas que presentan mayores concentraciones de antocianinas. Debido a su gran capacidad antioxidante, las antocianinas de los arándanos inhiben los procesos oxidativos relacionados con la tumorogénesis, como se ha observado en líneas celulares de cáncer de próstata156. Además, sus propiedades anti-angiogénicas impiden que los tumores desarrollen nuevos vasos sanguíneos. Sus propiedades antiinflamatorias se ejercen al inhibir la sobreexpresión de las ciclooxigenasas 1 y 2 (COX1 y COX2).
Proantocianidinas: son sustancias que inhiben más intensamente el crecimiento de células de cáncer de próstata hormono sensible que el de células hormono resistentes157.
Quercetin: se ha mostrado que el quercetin presenta efectos antitumorales en varias líneas celulares de cánceres humanos.
Los frutos rojos contienen una mezcla de productos que afectan los niveles de expresión de una amplia gama de genes relacionados con el cáncer, previniendo de esta forma la conversión de células premalignas en malignas con dosis que pueden causar mínima o ninguna toxicidad en los humanos.
Resveratrol.
El resveratrol es un flavonoide polifenólico que se encuentra en las semillas y en la piel de las uvas, en el vino tinto, en las moras y en los cacahuetes. El resveratrol interfiere en las tres fases de la formación de los tumores158. Los mecanismos de acción incluyen: 1- antioxidante; 2- antiangiogénesis; 3- antiproliferativo; 4- inducción de apoptosis; 5- inhibición del factor de transcripción NF-ĸ; 6- aceleración de la reparación del ADN; 7- activación del gen supresor p53; 8- inhibición de las enzimas proinflamación COX 1, COX 2 y lipooxigenasa. El efecto antioxidante del resveratrol se ejerce a través de la inducción de genes que codifican proteínas detoxificantes como superóxido dismutasa, catalasa y glutation peroxidasa159.
El resveratrol revierte la resistencia de las células malignas a la quimioterapia y además las sensibiliza a la acción de esos tratamientos160. En estudios con ratones se ha observado que el resveratrol puede tener efectos positivos en la formación y progresión del cáncer de próstata. Sin embargo, existen pocas evidencias que demuestren su utilidad una vez que el tumor se ha formado161.
Café.
Muchos estudios observacionales han mostrado que el consumo de café disminuye el riesgo de desarrollar cáncer de próstata, la progresión y la recidiva del tumor. En un estudio con 48.000 hombres se observó que en los que consumían más de 6 tazas de café por día, el riesgo de desarrollar cáncer de próstata disminuía un 60% comparado con los que consumían menos tazas por día162. Los resultados fueron similares con café normal o con café descafeinado. Los efectos se explican por las propiedades antioxidantes que presenta el café. En otro estudio realizado con hombres que tenían cáncer de próstata, los que consumían más de 4 tazas por semana presentaban un 59% de menor riesgo de presentar recidiva o progresión del tumor frente a los que consumían menos de una taza por semana163. En un trabajo realizado en Suecia se observó que, por cada taza de café que se consumía de más cada día, se reducía un 3% el riesgo de desarrollar cáncer de próstata de bajo riesgo164. No se observó esa asociación en los cánceres avanzados. Sin embargo, estos resultados no fueron confirmados en otros estudios165.
Ajo y cebollas.
Todos los integrantes de esta especie (ajo, cebolla, cebollino, puerro, chalota) poseen propiedades antiinflamatorias, antioxidantes, anticancerígenas y antibacterianas. La mayoría de esos efectos se deben a la allicina, que es un compuesto azufrado producido por la acción de la enzima allinasa sobre la aliina.
Al cortar el ajo se libera alicina, que es la responsable junto con el sulfuro de alilo del fuerte olor que se despende. Otros compuestos presentes son el ajoene y tiosulfinatos. En estudios experimentales se observó que los compuestos presentes en el ajo tienen efectos sobre las células de cáncer de próstata a través de diferentes mecanismos como inducción de la apoptosis, y bloqueo del ciclo celular y de la migración celular166-168.
En un estudio en humanos se observó que los hombres que consumían más de 10 gramos de ajo por día presentaban menor riesgo de desarrollar cáncer de próstata que los que consumían menos de 2,2 gramos por día169. En una revisión de 9 estudios caso-control o de cohorte, se vio correlación significativa entre el consumo de ajo y el riesgo de cáncer de próstata170. No se observó asociación con el consumo de cebollas.
Vino tinto.
Aunque el elevado consumo de alcohol aumenta significativamente la incidencia de cáncer de próstata, el consumo moderado de vino tinto (dos copas al día) protege contra la aparición de dicho tumor25,26.
En un estudio de meta-análisis se observó que, mientras que el consumo moderado de vino blanco aumentaba el riesgo de cáncer de próstata, el consumo moderado de vino tinto reducía el riesgo un 12%171.
Las sustancias responsables del efecto protector del vino tinto son los flavonoides como las antocianinas y los no flavonoides como el resveratrol, que se encuentra en la cáscara de la uva negra, y el ácido gálico, que se encuentra también en las hojas de té y en la granada. El vino tinto contiene entre 1,2 y 2 gramos por litro de resveratrol, lo que representa una concentración 10 veces superior a la del vino blanco172.
Jengibre.
Es una planta medicinal utilizada en India y China desde hace varios siglos para el tratamiento de problemas digestivos y respiratorios, artrosis y como antiinflamatorio natural.
Los efectos beneficiosos se atribuyen a la presencia de más de 20 sustancias fitoquímicas como los polifenoles gingerol, paradol, shogaol y gingerona, con potentes propiedades antiinflamatorias y antioxidantes y para la prevención del cáncer173.

Jengibre
Autor/a de la imagen: Forest & Kim Starr
Fuente: Wikimedia Commons
Los efectos sobre las células de cáncer de próstata se consiguen modulando el ciclo celular, produciendo la muerte de las células malignas por apoptosis pero sin afectar a las células prostáticas normales, e inhibiendo la expresión de ciclinas174. En modelos animales de cáncer de próstata la administración oral de jengibre inhibe un 56% el crecimiento y la progresión del tumor sin afectar los tejidos normales175.
Cardo mariano (Silibinin).
El silibinin es un flavonoide presente en las semillas del cardo mariano. Posee propiedades antiinflamatorias, ya que regula la expresión de mediadores de la inflamación como el factor de necrosis tumoral (TNF), las interleucinas 1,4, 6 y 10 y el interferón gamma. En las células tumorales produce detención del ciclo celular, disminución de la proliferación e induce apoptosis176. En investigaciones realizadas con modelos animales de cáncer de próstata se ha observado que puede ser efectivo en todas las etapas del tumor: desde disminuir la incidencia del mismo y reducir el tamaño de los tumores establecidos, hasta disminuir la aparición de metástasis177. Estos efectos se consiguen a través de: inducir apoptosis de las células tumorales, disminuir los niveles del factor de crecimiento vascular (VEGF) y su receptor, y reducir los niveles de metaloproteinasas responsables de la invasión tumoral y de la aparición de metástasis. En ensayos en fase I se observó que el silibinin es seguro incluso a dosis muy altas de 13 gramos por día178.
En Europa y en Asia el silibinin se ha utilizado en el tratamiento de la toxicidad hepática causada por el envenenamiento con setas y como suplemento dietético para prevenir la hepato-toxicidad179.
En un estudio en pacientes con cáncer de próstata que fueron tratados con silibinin entre 15 y 30 días antes de la cirugía radical se vio que los niveles en sangre eran elevados, mientras que no se detectó silibinin en el interior de la próstata, lo que puede ser explicado por su corta vida media180.
Pimienta.
Los efectos antitumorales los ejerce la piperina. En estudios experimentales se observó que la pimienta inhibe la proliferación de células de cáncer de próstata hormono sensible y hormono resistente181. En modelos animales se observó que la pimienta inhibía la proliferación de las células malignas al detener el ciclo celular y bloquear las ciclinas. Además, al asociarla con el quimioterápico docetaxel aumentaba considerablemente el efecto antitumoral182. Otro de los efectos beneficiosos de la pimienta es que potencia la acción de la cúrcuma al aumentar su absorción y biodisponibilidad.
Pimientos picantes.
Las guindillas producen potentes efectos antitumorales sobre varios cánceres por la presencia de capsaicina. En animales con cáncer de próstata tratados con capsaicina, los tumores tendían a ser menos agresivos en comparación con los animales utilizados como controles183. En otros estudios experimentales se observó que la capsaicina reducía la capacidad de las células de cáncer de próstata hormono resistente para invadir y producir metástasis184.
La capsaicina sensibiliza las células malignas a los efectos de la radioterapia. La utilización de capsaicina por vía oral asociada a radioterapia produce mayor retraso en el crecimiento de las células malignas que si se utiliza la radioterapia sola185. La administración de capsaicina oral en ratones a los que se les habían implantado células de cáncer de próstata retrasaba el crecimiento de los tumores186.
En células de tumores prostáticos hormono sensibles y hormono resistentes la administración de capsaicina potencia el efecto del quimioterápico docetaxel187. La asociación de capsaicina y piperina (pimienta) aumenta los efectos citotóxicos del quimioterápico doxorubicina en células tumorales188.
Romero.
Es un condimento muy utilizado en la dieta mediterránea, con propiedades beneficiosas en enfermedades cardiovasculares, diabetes y varios cánceres. Los componentes con propiedades antitumorales y antioxidantes del romero son: carnasol, rosmanol y ácido carnósico189.

Azafrán
Autor/a de la imagen: Henna - Este archivo deriva de: Saffron-spice.jpg (This is a brightness-, color-, contrast-, and gamma-adjusted version of File:Saffron-spice.jpg.) saffron spice
Fuente: Wikipedia
El extracto de romero frena el crecimiento de las células de cáncer de próstata y reduce el tamaño de los tumores implantados en ratones190. El carnasol presente en el romero modula la actividad del receptor de andrógenos y de estrógenos, lo que sugiere que puede ser utilizado para el tratamiento del cáncer de próstata. En ratones a los que se les implantaron células de cáncer de próstata se observó que la administración oral de 30 mg/kg de carnasol disminuía un 36% el tamaño de los tumores y descendía un 26% el PSA en sangre comparado con los animales utilizados como controles191.
Azafrán.
Los productos activos más abundantes en el azafrán son la crocina y la crocetina. Presentan efectos contra varios tumores, incluido el cáncer de próstata. Los mecanismos a través de los cuales actúan son: inhibición de la proliferación, promoción de la apoptosis y modulación del efecto de enzimas detoxificantes192. La crocina posee efectos antiproliferativos, dado que actúa sobre la apoptosis inhibiendo el gen anti-apoptosis Bcl-2 y estimulando el gen pro-apoptosis Bax193.
Además, en un modelo animal -ratones- en el que se implantaron células de cáncer de próstata muy agresivo, la crocina y la crocetina inhibieron la invasión tumoral y la formación de metástasis, lo que sugiere que los fitoquímicos del azafrán poseen potentes efectos antitumorales194.
Setas.
Entre las numerosas sustancias activas que contienen las setas, destacan los compuestos fenólicos y distintos tipos de polisacáridos como betaglucanos, lectinas, lentinianos, ergosterol y eritadenina195. Los glucanos estimulan el sistema inmunitario al activar los linfocitos T, las células natural killer y los macrófagos. Las cualidades nutricionales y medicinales de las setas se conocen desde hace miles de años, consumiéndose en los países asiáticos en forma natural o en polvo. Las más estudiadas por sus efectos anticáncer son: Shiitake, Maitake, Champiñón del Sol, Champiñón, Reishi, Coriolus versicolor (cola de pavo) y Agaricus. Los mecanismos implicados en los efectos antitumorales de las setas son: regulación de genes, disminución de la creación de nuevos vasos sanguíneos, y enlentecimiento del crecimiento tumoral196. En estudios in vivo e in vitro se ha demostrado que las setas son útiles en la prevención del cáncer de próstata197.
En un estudio de cohorte realizado en Japón se observó que los individuos que consumían setas más de un día a la semana presentaban menor riesgo de desarrollar cáncer de próstata que los que las consumían menos de una vez por semana. Esta relación inversa fue más significativa en los individuos mayores de 50 años de edad198. Si bien se desconoce el mecanismo exacto por el que las setas ejercen su efecto antitumoral, se especula que tal efecto se debe a la abundante presencia de sustancias antioxidantes y antiinflamatorias como la ergotionina y el glutation. La seta con mayor contenido de ergotionina es el boletus. Le siguen shitake, maitake y champiñón. Se ha demostrado que el cocinado no afecta el contenido de ergotionina de las setas.
En un trabajo epidemiológico realizado en Estados Unidos con personal sanitario femenino (Nurses Health Study) y masculino (Health Professionals Follow-up Study), se observó que los participantes que consumían cinco o más raciones de setas por semana no presentan diferencias en el riesgo de cáncer frente a los que no las consumían casi nunca199.
En un estudio con pacientes con recidiva bioquímica de cáncer de próstata (elevación de PSA), se vio que el tratamiento con extracto de setas durante 3 meses lograba que las cifras de PSA descendieran en el 36% de los casos y que en algunos de ellos se hiciera indetectable, lo que sugiere que las setas podrían controlar los niveles de PSA en los pacientes con recidiva tumoral bioquímica200.
Se llevó a cabo otro estudio en el que pacientes con recidiva bioquímica tras el tratamiento radical fueron tratados durante 6 meses con extracto de Reishi o de Agaricus. El objetivo del trabajo fue lograr descensos del PSA superiores al 50%. Al final del tratamiento no se había conseguido el objetivo del estudio201.

Unos champiñones
Autor/a de la imagen: PublicDomainPictures
Fuente: Pixabay (free photo)
Las setas aumentan los efectos de la quimioterapia, ya que incrementan la concentración del agente en el interior de la célula tumoral. Estos efectos se han demostrado con la asociación de extracto de Agaricus y doxorrubicina, con el polisacárido K obtenido de Corolius Versicolor (cola de pavo) y docetaxel, y con extracto de Reishi y cisplatino202.
Por otro lado, las setas protegen contra los efectos de la radioterapia. En un estudio con ratones se observó que el tratamiento con glucano aislado de Reishi mejoraba la sobrevida de los animales tras ser tratados con radiación. Los tratados solo con radiación presentaban una mortalidad del 100%, mientras que sobrevivían un 66% de los tratados con radiación y el β-glucano del Reishi203.
Algas.
Las algas poseen propiedades beneficiosas para la salud, dado que están compuestas por sustancias con efectos antiinflamatorios, antivirales, antibacterianos y anticáncer. Su consumo está ampliamente distribuido en los países asiáticos. Uno de los productos más activos en las algas es el Fucoidan, que es un polisacárido que está presente en las algas de color marrón (Mozuko, Mekabu y Kombu) con propiedades antioxidantes y antitumorales204.
Los mecanismos antitumorales más importantes son: potenciación de la apoptosis, inhibición de la angiogénesis, potenciación del efecto de la quimioterapia y estimulación del sistema inmune205,206.
Chocolate negro.
El contenido de cacao debe ser superior al 70%. El chocolate negro posee una elevada cantidad de polifenoles. Cuarenta gramos de chocolate negro contienen casi la misma cantidad de polifenoles que una taza de té verde correctamente preparado y el doble que un vaso de vino tinto207. El índice glucémico de 20 gramos de chocolate negro es la mitad que el del pan blanco y similar al del zumo de naranja. Su consumo debe ser moderado, ya que tiene un elevado contenido en grasas saturadas (35% de ácido esteárico y 25% de ácido palmítico). También contiene un 35% de ácido oleico, que es un ácido graso mono insaturado encontrado también en el aceite de oliva. Los principales polifenoles encontrados en el chocolate negro son semejantes a los del té verde (catequinas). También se encuentran cantidades elevadas de proantocianidinas, que son potentes antioxidantes (3 veces superiores al té verde y dos veces superiores al vino tinto).
ESTRATEGIAS COMPLEMENTARIAS
Manejo del estrés.
El diagnóstico de cáncer produce en los individuos importantes efectos físicos, emocionales y sociales que le generan estrés208. Se deben establecer estrategias que hagan descender los niveles de depresión y ansiedad ocasionados por el diagnóstico y ayuden a superar los síntomas relacionados con el cáncer o con los tratamientos. Existen varias estrategias para ayudar al paciente a superar el estrés ocasionado por el cáncer. Las más utilizadas son psicoterapia, yoga, acupuntura, thai chi y masajes.
Psicoterapia. En un estudio de meta-análisis se analizaron los resultados del tratamiento con psicoterapia, terapia conductual y terapia de pareja a 1.067 pacientes con cáncer de próstata209. Todas las intervenciones fueron beneficiosas para los pacientes y sus parejas.
Acupuntura. Es un tratamiento de la medicina tradicional china aplicado desde hace miles de años que consiste en la colocación de agujas en puntos específicos del cuerpo que se estimulan manual o eléctricamente, con lo que se controlan síntomas producidos por el cáncer o sus tratamientos210.

Puntos de acupuntura o puntos acupunturales
Autor/a de la imagen: Dinoman88 - http://daqi.es
Fuente: Wikipedia
Las guías del National Comprehensive Cancer Network recomiendan la utilización de acupuntura para el tratamiento del dolor, náuseas, vómitos, fatiga y sofocos211. La acupuntura puede estimular la liberación de opioides endógenos, serotonina y dopamina por el cerebro. En estudios de imagen se ha observado que la acupuntura puede modular varias regiones del cerebro relacionadas con las funciones cognitivas y con las emociones. En pacientes con cáncer de próstata avanzado se observó que la acupuntura reduce el dolor y mejora la calidad de vida212. Se ha demostrado que la acupuntura reduce los sofocos producidos por el tratamiento hormonal hasta en un 43%, y que esta mejoría se mantiene al menos durante 3 meses213.
Yoga. El yoga se inició en la India hace cientos de años y está integrado dentro de la medicina ayurvédica para establecer una unión entre el cuerpo y la mente. Es ideal para que los individuos que son sedentarios comiencen a realizar actividad física. Se basa en la repetición de asanas (posturas), técnicas de respiración, meditación, cánticos y reglas de conducta. El yoga ha mostrado su eficacia en los pacientes con cáncer de próstata para reducir la incidencia de efectos secundarios producidos por los tratamientos214. En un meta-análisis se observó que el yoga reducía el estrés, la fatiga, la ansiedad y la depresión, y mejoraba la calidad de vida de los pacientes con cáncer215.
Espiritualidad. La espiritualidad se ha asociado con la calidad de vida, la evolución del cáncer y la salud psicosocial de los pacientes con cáncer de próstata216. Se observó que los hombres con menor espiritualidad mostraban peor salud física y mental y peor función sexual. En otro estudio con pacientes con cáncer de próstata metastásico se observó que los casos con menor educación tenían una espiritualidad superior y mostraban mejor calidad de vida y mejor función psicosocial217.
Thai Chi. Se trata de una secuencia de movimientos lentos coordinados con la respiración basados en las artes marciales chinas. El thai chi es de gran utilidad como forma de ejercicio en las personas ancianas, debilitadas o sedentarias que inician una actividad física. En varios estudios se ha observado que mejora el equilibrio y reduce el riesgo de caídas218. Además, disminuye la fatiga producida por el tumor o por los tratamientos, mejora la puntuación de calidad de vida y disminuye la depresión cuando se comparó con fisioterapia219.
Masajes. En oncología, los masajes son útiles para disminuir la fatiga y el dolor y mejorar las alteraciones del humor y el edema linfático. Se encuentran incluidos dentro de las guías de la National Comprehensive Cancer Network (NCCN) de Estados unidos220,221. En pacientes oncológicos se debe tener precaución en la presión ejercida en las zonas operadas o sometidas a radioterapia, o si existen metástasis en los huesos de la zona.

Tomado de 222
Principales sitios de actividad de los alimentos anticáncer
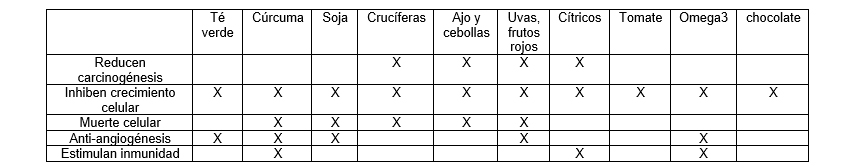
Modificado de 223
CONCLUSIONES
La incorporación de un estilo de vida saludable es beneficioso para enlentecer la progresión del cáncer de próstata, reducir los efectos secundarios del tratamiento y mejorar la calidad de vida. Muchas evidencias destacan el beneficio del ejercicio aeróbico y de resistencia, el abandono del tabaco, el consumo de una dieta equilibrada y el mantenimiento del peso corporal normal para aumentar la sobrevida de los pacientes con cáncer de próstata. Las guías clínicas de la American Cancer Society aconsejan a los pacientes con cáncer realizar al menos 150 minutos de ejercicio moderado o 75 minutos de ejercicio intenso cada semana. En lo que respecta a la alimentación:
1- Se debe aumentar el consumo de grasas saludables (omega 3 y 9) como las que se encuentran en los pescados azules, nueces, aceite de oliva, semillas de linaza, soja o aguacates.
2- Consumir abundantes vegetales (más de 5 raciones) cada día incluyendo las verduras crucíferas y tomate cocinado y legumbres (garbanzos, judías y lentejas).
3- Evitar el consumo de carnes procesadas, salsas, harinas y azúcar refinados y bollería industrial.
4- Limitar el consumo de carnes rojas y lácteos con alto contenido de grasas saturadas. En su lugar consumir pescado, pollo o pavo sin piel.
Referencias
1. Incidencia del cáncer de próstata en España. En: www.aecc.com.
2. Taitt HE. Global Trends and Prostate Cancer: A Review of Incidence, Detection, and Mortality as Influenced by Race, Ethnicity, and Geographic Location. Am J Mens Health 2018; 12:1807-23.
3. Center MM, Jemal A, Lortet-Tieulent J, et al. International variation in prostate cancer incidence and mortality rates. Eur Urol 2012; 61:1079–92.
4. Goggins WB, Wong G. Cancer among Asian Indians/Pakistanis living in the United States: low incidence and generally above average survival. Cancer Causes Control 2009; 20: 635–43.
5. Bell KJL, Del mar C , Gordon Wright G, et al. Prevalence of Incidental Prostate Cancer: A Systematic Review of Autopsy Studies. Int J Cancer 2015; 137: 1749-57.
6. Jahn JL, Giovannucci EL, Stampfer MJ. The High Prevalence of Undiagnosed Prostate Cancer at Autopsy: Implications for Epidemiology and Treatment of Prostate Cancer in the Prostate-specific Antigen-era. Int J Cancer 2015; 137: 2795-802.
7. Peisch SF, Van Blarigan EL, Chan JM, el al. Prostate cancer progression and mortality: a review of diet and lifestyle factors. World J Urol 2017; 35: 867-74.
8. Ballon-Landa E, Parsons JK. Nutrition, physical activity, and lifestyle factors in prostate cancer prevention. Curr Opin Urol 2018; 28: 55-61.
9. Ornish D, Weidner G, Fair WR. Intensive lifestyle changes may affect the progression of prostate cancer. J Urol 2005;174:1065-9.
10. Cuzick J, Thorat MA, Andriole G, et al. Prevention and early detection of prostate cancer. Lancet Oncol 2014; 15:484–92.
11. Joshu CE, Mondul AM, Menke A, Meinhold C, Han M, Humphreys EB, et al. Weight gain is associated with an increased risk of prostate cancer recurrence after prostatectomy in the PSA era. Cancer Prev Res 2011; 4: 544–51.
12. Bonn SE, Wiklund F, Sjolander A, et al. Body mass index and weight change in men with prostate cancer: progression and mortality. Cancer Causes Control 2014; 25: 933–43.
13. Dicacciati, A.; Orsini, N.; Andersson, et al. Body mass index in early and middle-late adulthood and risk of localised, advanced and fatal prostate cancer: A population-based prospective study. Br J Cancer 2011; 105: 1061–1068.
14. Cao Y, Ma J. Body mass index, prostate cancer-specific mortality, and biochemical recurrence: a systematic review and meta-analysis. Cancer Prev Res 2011; 4: 486–501.
15. Pischon T, Boeing H, Weikert S, et al. Body size and risk of prostate cancer in the European prospective investigation into cancer and nutrition. Cancer Epidemiol Biomarkers Prev 2008; 17: 3252-61.
16. Möller, E, Wilson, KM, Batista, JL, et al. Body size across the life course and prostate cancer in the Health Professionals Follow-up Study. Int J Cancer 2016; 138: 853–865.
17. Freedland SJ, Mavropoulos J, Wang A, et al. Carbohydrate restriction, prostate cancer growth, and the insulin-like growth factor axis. Prostate. 2008; 68:11-9.
18. Weitzman SA, Gordon, LI. Inflammation and cancer: Role of phagocyte-generated oxidants in carcinogenesis. Blood 1990; 76: 655–663.
19. Fujita K, Hayashi T, Matsushita M, et al. Obesity, Inflammation, and Prostate Cancer. J Clin Med 2019; 8(2).
20. Daniell HW. A worse prognosis for smokers with prostate cancer. J Urol 1995; 154:153–157.
21. Kenfield SA, Stampfer MJ, Chan JM, Giovannucci E. Smoking and prostate cancer survival and recurrence. JAMA 2011; 305:2548–2555.
22. Gong Z, Agalliu I, Lin DW, Stanford JL, Kristal AR. Cigarette smoking and prostate cancer-specific mortality following diagnosis in middle-aged men. Cancer Causes Control 2008; 19:25–31.
23. Bagnardi V, Blangiardo M, La Vecchia C, Corrao G. A meta-analysis of alcohol drinking and cancer risk. Brit J Cancer 2001; 85:1700–5.
24. Fillmore KM, Chikritzhs T, Stockwell T, et al. Alcohol use and prostate cancer: A meta-analysis. Mol Nutr Food Res 2009; 53: 240–55.
25. Zhao J, Stockwell T, Roemer A, Chikritzhs T. Is alcohol consumption a risk factor for prostate cancer? A systematic review and meta-analysis. BMC Cancer 2016; 16: 845.
26. Downer MK, Kenfield SA, Stampfer MJ, et al. Alcohol Intake and Risk of Lethal Prostate Cancer in the Health Professionals Follow-Up Study. J Clin Oncol 2019; 37:1499-1511
27. Pelser C, Mondul AM, Hollenbeck AR, Park Y. Dietary fat, fatty acids, and risk of prostate cancer in the NIH-AARP diet and health study. Cancer Epidemiol Biomarkers Prev 2013; 22: 697–707.
28. Brasky TM, Till C, White E, et al. Serum phospholipid fatty acids and prostate cancer risk: results from the prostate cancer prevention trial. Am J Epidemiol 2011; 173:1429–39.
29. Williams CD, Whitley BM, Hoyo C, et al. A high ratio of dietary n-6/n-3 polyunsaturated fatty acids is associated with increased risk of prostate cancer. Nutr Res 2011; 31:1–8.
30. Ramon JM, Bou R, Romea S, et al. Dietary fat intake and prostate cancer risk: a case-control study in Spain. Cancer Causes Control 2000; 11:679-85.
31. Rowlands MA, Gunnell, Harris R, et al. Circulating insulin-like growth factor peptides and prostate cancer risk: A systematic review and meta-analysis. Int J Cancer 2009; 124: 2416–2429.
32. Pelser C, Mondul AM, Hollenbeck AR, Park Y. Dietary fat, fatty acids, and risk of prostate cancer in the NIH-AARP diet and health study. Cancer Epidemiol Biomarkers Prev 2013; 22: 697-707.
33. Psaltopoulou T, Kosti RI, Haidopoulos D, Dimopoulos M, Panagiotakos DB. Olive oil intake is inversely related to cancer prevalence: a systematic review and a metaanalysis of 13800 patients and 23340 controls in 19 observational studies. Lipids Health Dis 2011;10:127.
34. Punnen S, Hardin J, Cheng I et al. Impact of Meat Consumption, Preparation, and Mutagens on Aggressive Prostate Cancer. PLoS One 2011.
35. Sinha R, Park Y, Graubard BI, et al. Meat and meat-related compounds and risk of prostate cancer in a large prospective cohort study in the United States. Am J Epidemiol 2001; 170:1165-77.
36. Bylsma LC, Alexander DD. A review and meta-analysis of prospective studies of red and processed meat, meat cooking methods, heme iron, heterocyclic amines and prostate cancer. Nutr J 2015; 14:125.
37. Alexander DD, Mink PJ, Cushing CA, Sceurman B. A review and meta-analysis of prospective studies of red and processed meat intake and prostate cancer. Nutr J 2010; 9:50.
38. Zheng W, Lee SA. Well-done meat intake, heterocyclic amine exposure, and cancer risk. Nutr Cancer 2009; 61: 437–46.
39. Khan IA, Yiqun C, Zongshuai Z, et al. Occurrence of Heterocyclic Amines in Commercial Fast-Food Meat Products Available on the Chinese Market and Assessment of Human Exposure to these Compounds. J Food Sci 2019; 84:192-200.
40. Lu W, Chen H, Niu Y et al. Dairy products intake and cancer mortality risk: a meta-analysis of 11 population-based cohort studies. Nutr J 2016; 15: 91.
41. López-Plaza B, Bermejo LM, Santurino C, et al. Milk and Dairy Product Consumption and Prostate Cancer Risk and Mortality: An Overview of Systematic Reviews and Meta-analyses. Adv Nutr 2019; 10(suppl 2):S212-S223.
42. Preble I, Zhang Z, Kopp R, et al. Dairy Product Consumption and Prostate Cancer Risk in the United States. Nutrients 2019;11.
43. Tat D, Kenfield SA, Cowan J et al. Milk and other dairy foods in relation to prostate cancer recurrence: Data from the cancer of the prostate strategic urologic research endeavor (CaPSURE™). Prostate 2018; 78:32-39.
44. Straif K, Baan R, Grosse Y, et al. Carcinogenicity of shift-work, painting, and fire-fighting. Lancet Oncol 2007; 8:1065–6.
45. Markt SC, Flynn-Evans EE, Valdimarsdottir UA, et al. Sleep Duration and Disruption and Prostate Cancer Risk: a 23-Year Prospective Study. Cancer Epidemiol Biomarkers Prev 2016; 25:302-8.
46. Sigurdardottir LG, Markt SC, Rider JR, et al. Urinary Melatonin Levels, Sleep Disruption, and Risk of Prostate Cancer in Elderly Men. Eur Urol 2015: 67: 191-94.
47. Kloog I, Haim A, Stevens RG, Portnov BA. Global co-distribution of light at night (LAN) and cancers of prostate, colon, and lung in men. Chronobiol Int 2009; 26:108-25.
48. Arendt J. Melatonin and the pineal gland: influence on mammalian seasonal and circadian physiology. Rev Reprod 1998; 3:13–22.
49. Park JW, Hwang MS, Suh SI, Baek WK. Melatonin down-regulates HIF-1 alpha expression through inhibition of protein translation in prostate cancer cells. J Pineal Res 2009; 46: 415-21.
50. Kim CH, Yoo YM. Melatonin induces apoptotic cell death via p53 in LNCaP cells. Korean J Physiol Pharmacol 2010; 14: 365-69.
51. Tam CW, Shiu SY. Functional interplay between melatonin receptor-mediated antiproliferative signalling and androgen receptor signalling in human prostate ephitelial cells: potential implications for therapeutic strategies against prostate cancer. J Pineal Res 2011; 51: 297-312.
52. Jung-Hynes B, Huang W, Reiter RJ, Ahmad N. Melatonin resynchronizes dysregulated circadian rhythm circuity in human prostate cancer cells. J Pineal Res 2010; 49: 60-8.
53. Garcia-Saenz A, Sánchez de Miguel A, Espinosa A , et al. Evaluating the Association between Artificial Light-at-Night Exposure and Breast and Prostate Cancer Risk in Spain (MCC-Spain Study). Environ Health Perspect 2018;126: 047011.
54. Sigurdardottir LG, Valdimarsdottir UA, Fall K, et al. Circadian disruption, sleep loss, and prostate cancer risk: A systematic review of epidemiologic studies. Cancer Epidemiol Biomarkers Prev 2012; 21:1002–11.
55. Rao D, Yu H, Bai Y, et al. Does night-shift work increase the risk of prostate cancer? a systematic review and meta-analysis. Onco Targets Ther 2015; 8: 2817-26.
56. Ballard T, Lagorio S, De Angelis G, Verdecchia A. Cancer incidence and mortality among flight personnel: a meta-analysis. Aviat Space Environ Med 2000; 71:216–24.
57. Wendeu-Foyet MG, Bayon V, Cénée S, et al. Night work and prostate cancer risk: results from the EPICAP Study. Occup Environ Med 2018; 75:573-81.
58. Tan X, Cedernaes J, Forsberg LA. Self-reported sleep disturbances and prostate cancer morbidity and mortality in Swedish men: A longitudinal study over 40 years. J Sleep Res 2018; 27:e12708.
59. Chan JM, Van Blarigan EL, Kenfield SA. What should we tell prostate cancer patients about (secondary) prevention? Curr Opin Urol 2014; 24:318-23.
60. Zuniga KB, Chan JM, Ryan CJ, Kenfield SA. Diet and lifestyle considerations for patients with prostate cancer. Urol Oncol 2020; 38:105-17.
61. Mishra SI, Scherer RW, Snyder C. et al. Exercise interventions on health-related quality of life for people with cancer during active treatment. Cochrane Database Syst Rev 2012; 8: CD008465.
62. Gerritsen JK, Vincent AJ. Exercise improves quality of life in patients with cancer: a systematic review and meta-analysis of randomised controlled trials. Br J Sports Med 2016; 50:796-803.
63. Kenfield SA, Stampfer MJ, Giovannucci E, Chan JM. Physical activity and survival after prostate cancer diagnosis in the health professionals follow-up study. J Clin Oncol 2011; 29:726-32.
64. Dickerman BA, Giovannucci E, Pernar CH, et al. Guideline-Based Physical Activity and Survival Among US Men With Nonmetastatic Prostate Cancer. Am J Epidemiol 2019; 188: 579-86.
65. Friedenreich CM, Neilson HK, Farris MS, Courneya KS. Physical Activity and Cancer Outcomes: A Precision Medicine Approach. Clin Cancer Res 2016; 22: 4766-75.
66. Chaput JP, Dutil C, Sampasa-Kanyinga H. Sleeping hours: what is the ideal number and how does age impact this? Nat Sci Sleep 2018; 10: 421-30.
67. Reiter RJ, Tan DX, Korkmaz A, et al. Light at night, chronodisruption, melatonin suppression, and cáncer risk: A review. Crit Rev Oncog 2007:13: 303-28.
68. Nguyen DP, Li J, Tewari AK. Inflammation and prostate cancer: the role of interleukin 6 (IL-6). BJU Int 2014; 113:986-92.
69. Philippou Y, Hadjipavlou M, Khan H; Rane A. Complementary and alternative medicine (CAM) in prostate and bladder cáncer. BJU Int 2013; 112: 1073–79.
70. van Die MD, Bone KM, Emery J, et al. Phytotherapeutic interventions in the management of biochemically recurrent prostate cancer: a systematic review of randomised trials. BJU Int 2016; 117: 17–34.
71. Capurso C, Vendemiale G. The Mediterranean Diet Reduces the Risk and Mortality of the Prostate Cancer: A Narrative Review. Front Nutr 2017; 4: 38.
72. Ferrís-Tortajada J, Berbel-Tornero O, García-Castell J, et al. Factores dietéticos asociados al cáncer de próstata. Beneficios de la dieta mediterránea. Actas Urol Esp 2012; 36: 239-245.
73. Galland L. Diet and Inflammation. Nutr Clin Pract. 2010; 25: 634-40.
74. Mori M, Masumori N, Fukuta F, et al. Traditional Japanese Diet and Prostate Cancer. Mol Nutr Food Res 2009; 53: 191-200.
75. Perez-Cornago A, Travis RC, Appleby PN, et al. Fruit and vegetable intake and prostate cancer risk in the European Prospective Investigation into Cancer and Nutrition (EPIC). Int J Cancer 2017; 141: 287-97.
76. Lin PH, Aronson W, Freedland SJ. Nutrition, dietary interventions and prostate cancer: the latest evidence. BMC Med 2015; 13:3.
77. Hardin J, Cheng I, Witte JS. Impact of consumption of vegetable, fruit, grain, and high glycemic index foods on aggressive prostate cancer risk, Nutr Cancer 2011; 63: 860–72.
78. Godos J, Bella F, Sciacca S, et al. Vegetarianism and breast, colorectal and prostate cancer risk: an overview and meta-analysis of cohort studies. J Hum Nutr Diet 2017; 30: 349-59.
79. Hackshaw-McGeagh LE, Perry RE, Leach VA et al. A systematic review of dietary, nutritional, and physical activity interventions for the prevention of prostate cancer progression and mortality. Cancer Causes Control 2015; 26:1521–50.
80. Tantamango-Bartley Y, Knutsen SF, Knutsen R, et al. Are strict vegetarians protected against prostate cancer? Am J Clin Nutr 2016; 103:153-60.
81. Cheetham PJ, Katz AE. Diet and prostate cáncer. A holistic approach to managemnt. Arch Esp Urol 2011; 64: 720-35.
82. Victoria A Kirsh VA, Peters U, Mayne ST, et al. Prospective Study of Fruit and Vegetable Intake and Risk of Prostate Cancer. J Natl Cancer Inst 2007; 99: 1200-9.
83. Livingstone TL, Beasy G, Mills RD, et al Plant Bioactives and the Prevention of Prostate Cancer: Evidence from Human Studies. Nutrients 2019; 11: 2245.
84. Lin Yan , Edward L Spitznag. Soy Consumption and Prostate Cancer Risk in Men: A Revisit of a Meta-Analysis. Am J Clin Nutr 2009; 89: 1155-63.
85. Applegate CC, Rowles JL, Ranard KM, et al. Soy Consumption and the Risk of Prostate Cancer: An Updated Systematic Review and Meta-Analysis. .Nutrients 2018; 10:40.
86. Hwang YW, Kim SY, Jee SH, Kim YN, Nam CM. Soy food consumption and risk of prostate cancer: a meta-analysis of observational studies. Nutrition and Cancer 2009; 61:598–606.
87. Bosland MC, Kato I, Zeleniuch-Jacquotte A, et al. Effect of soy protein isolate supplementation on biochemical recurrence of prostate cancer after radical prostatectomy: a randomized trial. JAMA 2013; 310:170–8.
88. Leonard A Cohen. A Review of Animal Model Studies of Tomato Carotenoids, Lycopene, and Cancer Chemoprevention. Exp Biol Med 2002; 227: 864-8.
89. Diener A, Rohrmann S. Associations of Serum Carotenoid Concentrations and Fruit or Vegetable Consumption With Serum Insulin-Like Growth Factor (IGF)-1 and IGF Binding protein-3 Concentrations in the Third National Health and Nutrition Examination Survey (NHANES III). J Nutr Sci 2016; 5: e13.
90. Chen P , Zhang W, Wang X, et al. Lycopene and Risk of Prostate Cancer: A Systematic Review and Meta-Analysis. Medicine 2015; 94: e1260.
91. Wang Y, Jacobs EJ, Newton CC, McCullough ML. Lycopene, tomato products and prostate cancer-specific mortality among men diagnosed with nonmetastatic prostate cancer in the cancer prevention study II nutrition cohort. Int J Cancer 2016; 138: 2846-55.
92. Rowles JL 3rd, Ranard KM, Smith JW, Erdman JW Jr. Increased dietary and circulating lycopene are associated with reduced prostate cancer risk: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis 2017; 20: 361-77.
93. Lycopene as a chemopreventive agent in the treatment of high-grade prostate intraepithelial neoplasia. Mohanty NK, Saxena S, Singh UP, et al. Urol Oncol 2005; 23: 383-5.
94. Gann PH, Deaton RJ, Rueter EE, et al. A Phase II Randomized Trial of Lycopene-Rich Tomato Extract Among Men with High-Grade Prostatic Intraepithelial Neoplasia. Nutr Cancer 2015; 67:1104-12.
95. Paur I, Lilleby W, Bøhn SK, et al. Tomato-based randomized controlled trial in prostate cancer patients: Effect on PSA. Clin Nutr 2017; 36:672-79.
96. Ansari MS, Gupta NP. A Comparison of Lycopene and Orchidectomy vs Orchidectomy Alone in the Management of Advanced Prostate Cancer. BJU Int 2003; 92: 375-8.
97. Gartner C, Stahl W, Sies H. Lycopene is more bioavailable from tomato past than fresh tomatoes. Am J Clin Nutr 1997;66:116–22.
98. Rodríguez-García C, Sánchez-Quesada C, Estefanía Toledo E, et al. Naturally Lignan-Rich Foods: A Dietary Tool for Health Promotion? Molecules 2019; 24: 917.
99. Wallstrom P, Drake I, Sonestedt E, et al. Plasma enterolactone, risk of prostate cancer in middle-aged Swedish men. Eur J Nutr 2018; 57:2595–2606.
100. McCann MJ, Gill CI, McGlynn H, et al. Role of mammalian lignans in the prevention and treatment of prostate cancer. Nutr Cancer 2005; 52:1–14.
101. Azrad M, Vollmer RT, Madden J, et al. Flaxseed-derived enterolactone is inversely associated with tumor cell proliferation in men with localized prostate cancer. J Med Food 2013; 16:357-60.
102. Liang P, Henning SM, Schokrpur S, et al. Effect of Dietary Omega-3 Fatty Acids on Tumor-Associated Macrophages and Prostate Cancer Progression. Prostate 2016; 76:1293-302.
103. Oono K, Takahashi K, Sukehara S,et al. Inhibition of PC3 human prostate cancer cell proliferation, invasion and migration by eicosapentaenoic acid and docosahexaenoic acid. Mol Clin Oncol 2017; 7:217-20.
104. Pascual-Geler M, Urquiza-Salvat N, Cozar JM, et al. The influence of nutritional factors on prostate cancer incidence and aggressiveness. Aging Male 2018; 21:31-9.
105. Mohseni R, Abbasi S, Mohseni F, et al. Association between Dietary Inflammatory Index and the Risk of Prostate Cancer: A Meta-Analysis. Nutr Cancer 2019; 71: 359-66.
106. Leitzmann MF, Stampfer MJ, Michaud DS, et al. Dietary intake of n-3 and n-6 fatty acids and the risk of prostate cancer. Am J Clin Nutr 2004; 80: 204–16.
107. Terry P, Lichtenstein P, Feychting M, et al. Fatty fish consumption and risk of prostate cancer. Lancet. 2001; 357: 1764–66.
108. Wilson KM, Mucci LA, Drake BF, et al. Meat, Fish, Poultry, and Egg Intake at Diagnosis and Risk of Prostate Cancer Progression. Cancer Prev Res 2016; 9: 933-41.
109. Catsburg C, Joshi AD, Corral R, et al. Polymorphisms in carcinogen metabolism enzymes, fish intake, and risk of prostate cancer. Carcinogenesis 2012; 33:1352-9.
110. Aucoin M, Cooley K, Knee C, et al. Fish-Derived Omega-3 Fatty Acids and Prostate Cancer: A Systematic Review. Integr Cancer Ther 2017; 16: 32-62.
111. Adhami VM, Malik A, Zaman N, et al. Combined inhibitory effects of green tea polyphenols and selective cyclooxygenase-2 inhibitors on the growth of human prostate cancer cells both in vitro and in vivo. Clin Cancer Res 2007; 13: 1611–19.
112. Chung LY, Cheung TC, Kong SK, et al. Induction of apoptosis by green tea catechins in human prostate cancer DU145 cells. Life Sci 2001; 68: 1207–14.
113. Hastak K, Gupta S, Ahmad N, et al. Role of p53 and NF-kappaB in epigallocatechin-3-gallate-induced apoptosis of LNCaP cells. Oncogene 2003; 22: 4851–59.
114. Chuu CP, Chen RY, Kokontis JM, et al. Suppression of androgen receptor signaling and prostate specific antigen expression by (-)-epigallocatechin-3-gallate in different progression stages of LNCaP prostate cancer cells. Cancer Lett 2009; 275: 86–92.
115. Guo Y, Zhi F, Chen P, et al. Green tea and the risk of prostate cancer: A systematic review and meta-analysis. Medicine 2017; 96: e6426.
116. Fei X, Shen Y, Li X, Guo H (2014). The association of tea consumption and the risk and progression of prostate cancer: a meta-analysis. Int J Clin Exp Med 2014; 7: 3881–91.
117. Bettuzzi S, Brausi M, Rizzi F, et al. Chemoprevention of human prostate cancer by oral administration of green tea catechins in volunteers with high-grade prostate intraepithelial neoplasia: A preliminary report from a one-year proof-of-principle study. Cancer Res 2006; 66:1234–40.
118. Brausi M., Rizzi F., Bettuzzi S. Chemoprevention of human prostate cancer by green tea catechins: Two years later. A follow-up update. Eur Urol 2008; 54: 472–73.
119. Zheng J, Yang B, Huang T, et al. Green tea and black tea consumption and prostate cancer risk: an exploratory meta-analysis of observational studies. Nutr Cancer 2011; 63: 663-72
120. Filippini T, Malavolti M, Borrelli F, et al. Green tea (Camellia sinensis) for the prevention of cancer. Cochrane Database Syst Rev 2020; 3:CD005004.
121. Sharma P, McClees SF, Afaq F. Pomegranate for Prevention and Treatment of Cancer: An Update. Molecules 2017; 22.
122. Cerda B, Ceron JL, Tomas-Barberan FA, Espin JC. Repeated oral administration of high doses of pomegranate ellagitannin punicalagin to rats for 37 days is not toxic. J Agric Food Chem 2003; 51: 3493-501.
123. Albrecht M, Jiang W, Kumi-Diaka J, et al. Pomegranate extracts potentially suppress proliferation xenograft growth, and invasion of human prostate cancer cells. J Med Food 2004; 7: 274-83.
124. Seeram N, Aronson W, Zhang Y, et al. Pomegranate ellagitannin-derived metabolites inhibit prostate cancer growth and localize to the mouse prostate gland. J Agric Foof Chem 2007; 55: 7732-7.
125. Domingo-Domenech J, Mellado B, Ferrer B et al. Activation of nuclear factor-κB in human prostate carcinogenesis and association to biochemical relapse. Br J Cancer 2005; 93: 1285-94.
126. Sartippour MR, Seeram NP, Rao JY, et al. Ellagitannin-rich pomegranate extract inhibits angiogenesis in prostate cancer in vitro and in vivo. Int J Oncol 2008; 32: 475-80.
127. Wang Y, Zhang S, Iqbal S, et al. Pomegranate extract inhibits the bone metastatic growth of human prostate cancer cells and enhances the in vivo efficacy of docetaxel chemotherapy. Prostate 2013; doi: 10.1002/pros.22769.
128. Pantuck AJ, Leppert JT, Zomorodian N, et al. Phase II study of pomegranate juice for men with rising prostate-specific antigen following surgery or radiation for prostate cancer. Clin Cancer Res 2006; 12: 4018-26.
129. Paller CJ, Ye X, Wozniak PJ, et al. A randomized phase II study of pomegranate extract for men with rising PSA following initial therapy for localized prostate cancer. Prostate Cancer Prostatic Dis 2013; 16:50-5.
130. Paller CJ, Pantuck A, Carducci MA. A review of pomegranate in prostate cancer. Prostate Cancer Prostatic Dis 2017 ; 20:265-70.
131. Stenner-Liewen F, Liewen H, Cathomas R, et al. Daily Pomegranate Intake Has No Impact on PSA Levels in Patients with Advanced Prostate Cancer - Results of a Phase IIb Randomized Controlled Trial. J Cancer 2013; 4:597-605.
132. Pantuck AJ, Pettaway CA, Dreicer R, et al. A randomized, double-blind, placebo-controlled study of the effects of pomegranate extract on rising PSA levels in men following primary therapy for prostate cancer. Prostate Cancer Prostatic Dis 2015; 18:242-8.
133. Zhang Y, Kensler TW, Cho CG, et al. Anticarcinogenic activities of sulforaphane and structurally related synthetic norbornyl isothiocyanates. Proc Natl Acad Sci 1994; 91: 3147-50.
134. Kamal MM, Akter S, Lin CN, Nazzal S. Sulforaphane as an anticancer molecule: mechanisms of action, synergistic effects, enhancement of drug safety, and delivery systems. Arch Pharm Res 2020; doi: 10.1007/s12272-020-01225-2.
135. Juge N, Mithen RF, Traka M. Molecular basis for chemoprevention by sulforaphane: a comprehensive review. Cell Mol Life Sci 2007; 64: 1105–27.
136. Palliyaguru DL, Yuan JM, Kensler TW, Fahey JW . Isothiocyanates: Translating the Power of Plants to People. Mol Nutr Food Res 2018; 62: e1700965.
137. Oliveiro T, Verkerk R, Dekker M. Isothiocyanates from Brassica Vegetables—Effects of Processing, Cooking, Mastication, and Digestion. Mol Nutr Food Res 2018; 62:1701069.
138. Yagishita Y, Fahey JW, Dinkova-Kostova A, Kensler TW. Broccoli or Sulforaphane: Is it the source or dose that matters? Molecules 2019: 24:10.3390.
139. Liu B, Mao Q, Cao M, Xie L. Cruciferous vegetables intake and risk of prostate cancer: a meta-analysis. . Int J Urol 2012; 19:134-41.
140. Mokbel K, Wazir U, Mokbel K. Chemoprevention of prostate cancer by natural agents: evidence from molecular and epidemiological studies. Anticancer Res 2019; 39: 5231-59.
141. Liu B, Mao Q, Cao M, Xie L. Cruciferous vegetables intake and risk of prostate cancer: A meta-analysis. Int J Urol 2012; 19: 134-41, 2012.
142. Cipolla BG, Mandron E, Lefort JM, et al. Effect of Sulforaphane in Men with Biochemical Recurrence after Radical Prostatectomy. Cancer Prev Res 2015 ; 8:712-9.
143. Alumkal JJ, Slottke R, Schwartzman J, et al. A phase II study of sulforaphane-rich broccoli sprout extracts in men with recurrent prostate cancer. Invest New Drugs 2015, 33: 480–89.
144. Bosetti C, Filomeno M, Riso P. Cruciferous vegetables and cancer risk in a network of case-control studies. Ann Oncol 2012; 23:2198-203.
145. Richman EL, Carroll PR, Chan JM. Vegetable and fruit intake after diagnosis and risk of prostate cancer progression. Int J cancer 2012: 201-10.
146. Núñez-Iglesias MJ, Novío S, García C, et al. Glucosinolate-Degradation Products as Co-Adjuvant Therapy on Prostate Cancer in Vitro Int J Mol Sci 2019; 20: 4977.
147. Vázquez-Fresno R, Rosana ARR, Sajed T, et al. Herbs and Spices- Biomarkers of Intake Based on Human Intervention Studies - A Systematic Review. Genes Nutr 2019; 14:18.
148. Jordan BC, Mock CD, Thilagavathi R, Selvam C. Molecular mechanisms of curcumin and its semisynthetic analogues in prostate cancer prevention and treatment. Life Sci 2016;152:135-44.
149. Killian PH, Kronski E, Michalik KM, et al. Curcumin inhibits prostate cancer metastasis in vivo by targeting the inflammatory cytokines CXCL1 and -2. Carcinogenesis 2012; 33: 2507–19.
150. Shehzad A, Lee J, Lee YS. Curcumin in various cancers. BioFactors 2013; 39: 56-68.
151. Abd Wahab NA, Lajis NH, Abas F, et al. Mechanism of Anti-Cancer Activity of Curcumin on Androgen-Dependent and Androgen-Independent Prostate Cancer. Nutrients 2020; 12: E679.
152. I de H, Tokiwa S, Sakamaki Combined inhibitory effects of soy isoflavones and curcumin on the production of prostate-specific antigen. Prostate 2010; 70: 1127–33.
153. Hejazi J, Rastmanesh R, Taleban FA, et al. Effect of curcumin supplementation during radiotherapy on oxidative status of patients with prostate cancer: A double blinded, randomized, placebo-controlled study. Nutri Cancer 2016; 68, 77–85.
154. Banerjee S, Singh SK, Chowdhury I, et al. Combinatorial effect of curcumin with docetaxel modulates apoptotic and cell survival molecules in prostate cancer. Front Biosci 2017; 9: 235-45.
155. Stoner GD, Wang LS, Castro BC, et al. Laboratory and clinical studies of cancer chemoprevention by antioxidants in berries. Carcinogenesis 2008; 29: 1665-74.
156. Seeram NP, Adams LS, Hardy ML, Heber D. Total cranberry extract vs its phytochemical constituents: antiproliferative and synergistic effects against human tumor cell lines. J Agric Food Chem 2004; 52: 2512-7.
157. Schmidt BM, Erdman JW, Lila MA. Differential effects of blueberry proanthocyanidins on androgen sensitive and insensitive human prostate cancer cells lines. Cancer Lett 2006; 231: 240-6.
158. Jang M, Cai L, Udeani GO, et al. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes. Science 1997; 275: 218-20.
159. Carter LG, D'Orazio JA, Pearson KJ. Resveratrol and cancer: focus on in vivo evidence. Endocr Relat Cancer 2014; 2:R209-25.
160. Ko JH, Sethi G, Um JY, et al. The Role f Resveratrol in Cancer Therapy. Int J Mol Sci. 2017; 18: pii: E2589.
161. Dias SJ, Li K, Rimando AM, Dhar S, Mizuno CS, Penman AD & Levenson AS 2013 Trimethoxy-resveratrol and piceatannol administered orally suppress and inhibit tumor formation and growth in prostate cancer xenografts. Prostate 2013; 73: 1135–46.
162. Wilson KM, Kasperzyk JL, Rider JR, et al. Coffee consumption and prostate cancer risk and progression in the Health Professionals Follow-up Study. J Natl Cancer Inst 2011; 103: 876–84.
163. Geybels MS, Neuhouser ML, Wright JL, Stott-Miller M, Stanford JL. Coffee and tea consumption in relation to prostate cancer prognosis. Cancer Causes Control 2013; 24:1947–54.
164. Discacciati A, Orsini N, Andersson SO, et al. Coffee consumption and risk of localized, advanced and fatal prostate cancer: a population-based prospective study. Ann Oncol 2013; 24: 1912-8.
165. Sen A, Papadimitriou N, Lagiou P, et al. Coffee and Tea Consumption and Risk of Prostate Cancer in the European Prospective Investigation Into Cancer and Nutrition. Int J Cancer 2019; 144:240-50.
166. Xiao D, Lew KL, Kim YA, et al. Diallyl trisulfide suppresses growth of PC-3 human prostate cancer xenograft in vivo in association with Bax and Bak induction. Clin Cancer Res 2006; 12: 6836–43.
167. Thomson M, Ali M. Garlic [Allium sativum]: A review of its potential use as an anti-cancer agent. Curr. Cancer Drug Targets 2003; 3: 67–81.
168. Herman-Antosiewicz A, Kim YA, Kim SH et al. Diallyl trisulfide-induced G2/M phase cell cycle arrest in DU145 cells is associated with delayed nuclear translocation of cyclin-dependent kinase 1. Pharm Res 2010; 27: 1072–79.
169. Hsing AW, Chokkalingam AP, Gao YT et al. Allium vegetables and risk of prostate cancer: A population-based study. J Natl Cancer Inst 2002; 94: 1648–51.
170. Zhou XF, Ding ZS, Liu NB. Allium vegetables and risk of prostate cancer: Evidence from 132,192 subjects. Asian Pac J Cancer Prev 2013; 14: 4131–34.
171. Vartolomei MD, Kimura S, Ferro M, et al. The impact of moderate wine consumption on the risk of developing prostate cancer. Clin Epidemiol 2018; 10: 431-44.
172. Arranz S, Chiva-Blanch G, Valderas-Martínez P, et al. Wine, beer, alcohol and polyphenols on cardiovascular disease and cancer. Nutrients 2012; 4: 759–81.
173. de Lima RMT, Dos Reis AC, de Menezes APM et al. Protective and therapeutic potential of ginger (Zingiber officinale) extract and [6]-gingerol in cancer: A comprehensive review. Phytother Res 2018; 32:1885-1907.
174. Shukla Y, Singh M. Cancer preventive properties of ginger: a brief review. Food Chem Toxicol 2007; 45: 683–90.
175. Karna P, Chagani S, Gundala SR, et al. Benefits of whole ginger extract in prostate cancer. Br J Nutr 2012; 107: 473-84.
176. Agarwal R, Agarwal C, Ichikawa H, et al. Anticancer potential of silymarin: from bench to bed side. Anticancer Res 2006; 26: 4457–4498.
177. Singh RP, Raina K, Sharma G, Agarwal R. Silibinin inhibits established prostate tumor growth, progression, invasion, and metastasis and suppresses tumor angiogenesis and epithelial-mesenchymal transition in transgenic adenocarcinoma of the mouse prostate model mice. Clin Cancer Res 2008; 1: 7581-2.
178. Flaig TW, Gustafson DL, Su LJ, et al. A phase I and pharmacokinetic study of silybin-phytosome in prostate cancer patients. Invest New Drugs 2007; 25:139–146.
179. Flora K, Hahn M, Rosen H, Benner K. Milk thistle (Silybum marianum) for the therapy of liver disease. Am J Gastroenterol 1998; 93: 139–143.
180. Flaig TW, Glode M, Gustafson D, et al. A study of high-dose oral silybin-phytosome followed by prostatectomy in patients with localized prostate cancer. Prostate 2010; 70: 848–855.
181. Samykutty A, Shetty AV, Dakshinamoorthy G, et al. Piperine, a Bioactive Component of Pepper Spice Exerts Therapeutic Effects on Androgen Dependent and Androgen Independent Prostate Cancer Cells. PLoS One 2013; 8: e65889.
182. Makhov P, Golovine K, Canter D, et al. Co-administration of piperine and docetaxel results in improved anti-tumor efficacy via inhibition of CYP3A4 activity. Prostate 2012; 72: 661–67.
183. Venier NA, Yamamoto T, Sugar LM, et al. Capsaicin reduces the metastatic burden in the transgenic adenocarcinoma of the mouse prostate model. Prostate 2015; 75: 1300–11.
184. Mori A, Lehmann S, O’Kelly J, et al. Capsaicin, a component of red peppers, inhibits the growth of androgen-independent, p53 mutant prostate cancer cells. Cancer Res 2006; 66: 3222–29.
185. Venier NA, Colquhoun AJ, Sasaki H, et al. Capsaicin: a novel radio-sensitizing agent for prostate cancer. Prostate 2015; 75:113-25.
186. Mori A, Lehmann S, O'Kelly J, et al. Capsaicin, a component of red peppers, inhibits the growth of androgen-independent, p53 mutant prostate cancer cells. Cancer Res 2006; 66: 3222–29.
187. Sánchez BG, Bort A, Mateos-Gómez PA, et al. Combination of the natural product capsaicin and docetaxel synergistically kills human prostate cancer cells through the metabolic regulator AMP-activated kinase. Cancer Cell Int 2019; 19: 54.
188. Li H, Krstin S, ,Wang S, Wink M. Capsaicin and Piperine Can Overcome Multidrug Resistance in Cancer Cells to Doxorubicin. Molecules 2018; 23: pii: E557.
189. Petiwala SM, Johnson JJ. Diterpenes from rosemary (Rosmarinus officinalis): Defining their potential for anti-cancer activity. Cancer Lett 2015; 367: 93–102.
190. Petiwala SM, Puthenveetil AG, Johnson JJ. Polyphenols from the Mediterranean herb rosemary (Rosmarinus officinalis) for prostate cancer. Front Pharmacol 2013 Mar 25;4:29.
191. Johnson JJ, Syed DN, Suh Y, et al. Disruption of androgen and estrogen receptor activity in prostate cancer by a novel dietary diterpene carnosol: implications for chemoprevention. Cancer Prev Res (Phila) 2010; 3:1112–23.
192. Khorasanchi Z, Shafiee M, Kermanshahi, et al. Crocus sativus a natural food coloring and flavoring has potent anti-tumor properties. Phytomedicine 2018; 43: 21-27.
193. D’Alessandro AM, Mancini A, Lizzi AR et al. Crocus sativus stigma extract and its major constituent crocin possess significant antiproliferative properties against human prostate cancer. Nutr Cancer 2013; 65: 930–42.
194. Festuccia C, Mancini A, Gravina GL, et al. Antitumor effects of saffron-derived carotenoids in prostate cancer cell models. Biomed Res Int 2014; 2014: 135048.
195. Kidd PM. The use of mushroom glucans and proteoglycans in cancer treatment. Altern Med Rev 2000; 5: 4-27.
196. PDQ Integrative, Alternative, and Complementary Therapies Editorial Board. Medicinal Mushrooms (PDQ®): Health Professional Version. PDQ Cancer Information Summaries. Bethesda: National Cancer Institute (US); 2002-2020.
197. Adams LS, Phung S, Wu X, Ki L, Chen S. White button mushroom (Agaricus bisporus) exhibits antiproliferative and proapoptotic properties and inhibits prostate tumor growth in athymic mice. Nutr Cancer 2008; 60: 744–56
198. Zhang S, Sugawara Y, Chen S, et al. Mushroom Consumption and Incident Risk of Prostate Cancer in Japan: A Pooled Analysis of the Miyagi Cohort Study and the Ohsaki Cohort Study. Int J Cancer 2020; 146: 2712-20.
199. Lee DH, Yang M, Keum N, et al. Mushroom Consumption and Risk of Total and Site-Specific Cancer in Two Large U.S. Prospective Cohorts. Cancer Prev Res (Phila). 2019; 12: 517-26.
200. Twardowski P, Kanaya N, Frankel P, et al. A Phase I Trial of Mushroom Powder in Patients With Biochemically Recurrent Prostate Cancer: Roles of Cytokines and Myeloid-Derived Suppressor Cells for Agaricus Bisporus-Induced Prostate-Specific Antigen Responses. Cancer 2015; 121: 2942-50.
201. Yoshimura K, Kamoto T, Ogawa O, et al. Medical mushrooms used for biochemical failure after radical treatment for prostate cancer: an open-label study. Int J Urol 2010;17: 548-54
202. Wenner CA, Martzen MR, Lu H, et al. Polysaccharide-K augments docetaxel-induced tumor suppression and antitumor immune response in an immunocompetent murine model of human prostate cancer. Int J Oncol 2012; 40: 905-13.
203. Pillai TG, Uma Devi P. Mushroom beta glucan: potential candidate for post irradiation protection. Mutat Res 2013; 751:109-15.
204. Chandini SK, Ganesan P, Bhaskar N. In vitro antioxidant activities of three selected brown seaweeds of India. Food Chem 2008; 107: 707–13.
205. Luthuli S, Wu S, Cheng Y, et al. Therapeutic Effects of Fucoidan: A Review on Recent Studies. Mar Drugs 2019; 17: pii: E487.
206. Wang Y, Xing M, Cao Q, et al. Biological Activities of Fucoidan and the Factors Mediating Its Therapeutic Effects: A Review of Recent Studies. Mar Drugs 2019; 17: pii: E183.
207. Russnes KM, Möller E, Wilson KM, et al. Total antioxidant intake and prostate cancer in the Cancer of the Prostate in Sweden (CAPS) study. A case control study. BMC Cancer 2016; 16: 438.
208. Latte-Naor S, Mao JJ. Putting Integrative Oncology Into Practice: Concepts and Approaches. J Oncol Pract 2019;15:7-14.
209. Vartolomei L, Shariat SF, Vartolomei MD. Psychotherapeutic Interventions Targeting Prostate Cancer Patients: A Systematic Review of the Literature. Eur Urol Oncol 2018; 1:283-291.
210. Wang J, Lei Y, Bao B, et al. Acupuncture for pain caused by prostate cancer: Protocol for a systematic review. Medicine 2019; 98: e13954.
211. Zia FZ, Olaku O, Bao T, et al: The National Cancer Institute’s conference on acupuncture for symptom management in oncology: State of the science, evidence, and research gaps. J Natl Cancer Inst Monogr 2017; 68-73.
212. He Y, Liu Y, May Brian H, et al. Effectiveness of acupuncture for cancer pain: protocol for an umbrella review and meta-analyses of controlled trials. BMJ Open 2017; 7: e018494.
213. Frisk JW, Hammar ML, Ingvar M, Spetz Holm AC. How long do the effects of acupuncture on hot flashes persist in cancer patients? Support Care Cancer 2014; 22:1409-15.
214. Abrams DI. An Integrative Approach to Prostate Cancer. J Altern Complement Med 2018; 24: 872-80.
215. Buffart LM, van Uffelen JG, Riphagen II, et al: Physical and psychosocial benefits of yoga in cancer patients and survivors, a systematic review and metaanalysis of randomized controlled trials. BMC Cancer 2012; 12: 559.
216. Krupski TL, Kwan L, Fink A, et al. Spirituality influences health related quality of life in men with prostate cancer. Psychooncology 2006; 15:121-31.
217. Zavala MW, Maliski SL, Kwan L, et al. Spirituality and quality of life in low-income men with metastatic prostate cancer. Psychooncology 2009; 18:753-61.
218. Gillespie LD, Robertson MC, Gillespie WJ, et al: Interventions for preventing falls in older people living in the community. Cochrane Database Syst Rev 2012; 9: CD007146.
219. Wang C, Schmid CH, Iversen MD, et al: Comparative effectiveness of tai chi versus physical therapy for knee osteoarthritis: A randomized trial. Ann Intern Med 2016; 165: 77-86.
220. National Comprehensive Cancer Network (NCCN): NCCN guidelines for supportive care: Cancer-related fatigue. Version 1. January 17, 2018. https://www. nccn.org/professionals/physician_gls/default.aspx#supportive
221. National Comprehensive Cancer Network (NCCN): NCCN guidelines for supportive care: Adult cancer pain. Version 1, January 22, 2018. https://www.nccn. org/professionals/physician_gls/default.aspx#supportive.
222. Béliveau R, Gingras D. Role of nutrition in preventing cancer. Can Fam Physician 2007; 53:1905-11.
223. Béliveau R, Gringas D. Food to Fight Cancer. DK, New York, 2006.





