Dras. Irene Bretón Lesmes / Clara Serrano Moreno
Introducción
La etiología de la Enfermedad Inflamatoria Intestinal (EII) no es del todo conocida; actualmente se cree que se debe a una interacción entre factores genéticos, microbiológicos y ambientales, que causan una reacción inflamatoria exagerada sobre el tubo digestivo, provocando una serie de complicaciones típicas de la inflamación intestinal (diarrea, estenosis intestinales, fístulas, abscesos, etc.). Entre los factores ambientales, la microbiota intestinal y la dieta parecen tener un papel especialmente relevante.
Epidemiología: ¿Influye la dieta en la incidencia de la EII?
La prevalencia global de la EII es mayor en los países occidentales, con una prevalencia >0.3% en Estados Unidos, Oceanía y Europa. En estas regiones, parece que la incidencia se ha estabilizado, y sin embargo en los últimos años ha aumentado en países de África, Asia y Sudamérica1. Además, se observa que la población inmigrante en países occidentalizados tiene una mayor incidencia de EII que la población de sus países nativos, cuando adquiere los hábitos de vida del nuevo país2,3. Esto podría tener relación con la adquisición de unos nuevos hábitos de vida menos saludables como la “western diet”, basada en altas cantidades de grasa y carbohidratos, y baja en fibra dietética. Este patrón dietético podría tener un papel etiopatogénico relevante en el desarrollo de la EII, ya que estudios retrospectivos basados en encuestas a pacientes muestran que este patrón dietético es más frecuente entre los pacientes con EII comparado con la población general4.

(de izq. a dcha): Dras. Irene Bretón Lesmes y Clara Serrano Moreno
Fuente: Dras. Bretón y Serrano
Muchos estudios observacionales han evaluado el efecto de la dieta en el desarrollo de la EII. Destacan los estudios prospectivos poblacionales como la cohorte del Nurse Health Study II5-7, que relacionó la dieta alta en fibra y pescado con un papel protector sobre la incidencia de EII. También un metaanálisis de 20158 dio un papel protector al consumo de fruta y verdura. Zeng et al.9, en 2017, presentan un metaanálisis en el que se asocia la dieta alta en fibra con un papel protector en la Enfermedad de Crohn (EC), sin encontrar ninguna relación con el consumo total de grasa, proteína o hidratos de carbono de la dieta. En un estudio observacional sobre población europea, se relacionó el consumo de omega6 con un mayor riesgo de padecer la enfermedad10, y un papel protector del consumo de omega311.
Sin embargo, esta asociación no está del todo clara en otros estudios. En 2016, Racine et al. muestran un estudio prospectivo sobre la cohorte europea (EPIC study)12, sin encontrar un patrón dietético asociado a una mayor incidencia de EII, aunque sí se relacionó el consumo de azúcares y refrescos con un mayor riesgo de colitis ulcerosa (CU). También un metaanálisis de 201713 encontró que el único factor dietético asociado al desarrollo de CU fue el consumo de sacarosa. Tampoco un estudio publicado recientemente sobre la gran cohorte francesa Nutrinet-Santé Cohort14 halló ninguna asociación entre distintos patrones dietéticos, el consumo de ultraprocesados, y la incidencia de EII.
En resumen, parece que ningún patrón dietético completo ha demostrado una asociación con el desarrollo de la EII, si bien el consumo alto en fibra y omega3 podría tener un papel protector en su desarrollo, mientras que el consumo de azúcares se asocia con un mayor riesgo de desarrollar la enfermedad, según estudios observacionales prospectivos.
Etiopatogenia: ¿Qué mecanismos implican a la dieta en la patogénesis de la EII?
El mecanismo por el cual la dieta influye en el desarrollo de la EII no está bien establecido. Se cree que algunos componentes de la dieta con potencial proinflamatorio pueden provocar cambios en la inmunidad y en la microbiota intestinal, desencadenando daños sobre la mucosa, y provocando las lesiones propias de la EII.
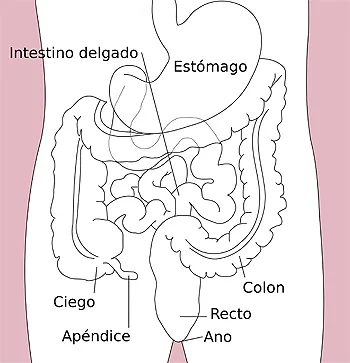
Autor/a: Kordas This SVG image was created by Medium69. Cette image SVG a été créée par Medium69. Please credit this : William Crochot - Image:Stomach_colon_rectum_diagram.svg
Fuente: Wikipedia
La barrera intestinal está compuesta por una capa mucosa, un epitelio intestinal formado por células unidas por proteínas de unión (tight-juntions), y células del sistema inmunitario. Constituye la primera barrera física y química que protege al intestino de bacterias, patógenos y antígenos alimentarios. Estos componentes pueden verse alterados por factores ambientales, y la dieta constituye uno de ellos. Estudios epidemiológicos han asociado algunos componentes de la dieta con la incidencia de EII, como hemos comentado anteriormente, y modelos animales han demostrado que un patrón dietético similar a la western-diet puede provocar cambios en la microbiota intestinal, adelgazamiento de la capa mucosa y finalmente daño en el epitelio intestinal. La disminución de esta capa mucosa provoca un aumento de la permeabilidad intestinal, con los cambios estructurales e inflamatorios propios de la EII15.
Distintos mecanismos etiopatogénicos han relacionado la composición de la dieta con la alteración de la barrera intestinal. La western-diet, basada en un alto consumo de carne, grasas, azúcares y productos procesados, y un bajo consumo de fibra, reúne distintos factores que desencadenan la inflamación, por distintos mecanismos:
Consumo de carne: La carne contiene aminoácidos con grupos sulfuro, que son fermentados en la luz intestinal, produciendo sulfuro de hidrógeno. Altas dosis de este componente se han relacionado directamente con el desarrollo de colitis en modelos animales16, y contribuye a la patogénesis de la EII inhibiendo la oxidación de butirato y reduciendo los puentes disulfuro de la barrera intestinal17. Un mayor consumo de carne se ha relacionado con un mayor riesgo de EII en estudios observacionales18-21.
Consumo de grasas: La dieta alta en grasas puede alterar en modelos experimentales la funcionalidad de las proteínas de unión entre enterocitos, modificando la composición de la capa mucosa y la microbiota intestinal, pudiendo estar relacionado también en este proceso el aumento de la secreción de ácidos biliares22. Parece importante destacar que los resultados varían no sólo por la ingesta total de grasa de la dieta, sino también según el tipo de grasa que predomine, puesto que un ratio omega3:omega6 elevado podría tener un papel protector en estudios observacionales23. Los ácidos grasos omega3 tienen un papel conocido inmunoregulador, y precursor de citoquinas antiinflamatorias, pudiendo disminuir la inflamación en la EII por este mecanismo24. Sin embargo, los ácidos grasos omega6 y las grasas saturadas (propios de la western-diet) se han relacionado con la producción de citoquinas proinflamatorias y aumento de la inflamación25.

(Imagen modificada) Autor/a del original: Hans
Fuente: Pixabay (free photo)
Consumo de hidratos de carbono: Distintas dietas utilizan la modificación de los hidratos de carbono para el tratamiento de la EII (FODMAP -pauta dietética baja en carbohidratos fermentables-, Dieta específica de Carbohidratos, Dieta sin gluten o sin lactosa, etc). La teoría etiopatogénica está basada en que tanto los disacáridos como los polisacáridos no son completamente digeridos en la luz intestinal. Estos hidratos no digeridos son fermentados por las bacterias intestinales, lo que produce sobrecrecimiento bacteriano, lesión de capa mucosa y daño epitelial, con activación de la cascada inflamatoria, causando finalmente disfunción del epitelio intestinal. La malabsorción de estos carbohidratos complejos sería la causa de la alteración de la microbiota intestinal y la perpetuación de la inflamación26. Eliminar estos compuestos de la dieta podría evitar el desarrollo de síntomas o brotes de la enfermedad. No obstante, existe controversia sobre el papel de los hidratos de carbono en la inflamación en estudios observacionales, ya que algunos encuentran asociación entre el consumo de azúcares y la incidencia de EII12,13, mientras que otros estudios poblacionales no han demostrado ninguna relación27.
Bajo consumo de fibra: La fibra dietética posee una función protectora sobre la barrera intestinal. Se postulan varios mecanismos por los cuales ejerce su función: mantenimiento de la microbiota intestinal protectora, fomentando su proliferación y evitando el sobrecrecimiento bacteriano, y manteniendo la barrera mucosa y la integridad del epitelio intestinal mediante la formación de ácidos grasos de cadena corta (AGCC)28,29. Estos AGCC son el sustrato fundamental del colonocito, y la cantidad adecuada ayuda a mantener su correcta función celular y absortiva. Debido a que la fibra es un sustrato nutricional fundamental para la microbiota, la disminución de la fibra podría provocar el crecimiento de bacterias patógenas, con daño en la barrera mucosa y el epitelio intestinal, como veremos más adelante30,31.
Restricción dietética y desnutrición
La restricción dietética es una práctica muy habitual entre los pacientes con EII. La mayoría de los pacientes creen que la alimentación tiene una relación directa con la aparición de brotes o el control de síntomas32, y esto tiene un impacto directo sobre su calidad de vida33. La exclusión de alimentos tiene una prevalencia en la EII que varía entre el 30-40% en la fase de remisión, y alcanza más de un 70% en la fase de brote, según las series34-36. Además, parece que esta restricción es más frecuente entre pacientes con EC que con CU37.

Vino blanco
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Numerosos estudios observacionales han evaluado la ingesta dietética habitual de los pacientes con EII. En comparación con la población general, parece que las personas con EII realizan una dieta más rica en proteína de origen animal e hidratos de carbono, y más baja en fibra y lácteos que los controles sanos38,39. De modo general, los datos epidemiológicos coinciden en que los alimentos evitados con más frecuencia son los lácteos, los alimentos ricos en fibra (fruta, verdura), la carne roja, el alcohol y los alimentos con aditivos o picantes39-42. Estos patrones dietéticos se han asociado con desnutrición y déficits de micronutrientes en estudios observacionales43,44.
La prevalencia de desnutrición en la EII es de al menos un 16% en España, aunque estas cifras varían según el método de diagnóstico utilizado. Además, la restricción dietética es el factor de riesgo más importante para desarrollar desnutrición en la EII45. Según un estudio multicéntrico realizado en España en 2017 sobre la prevalencia de desnutrición en la EII, el riesgo de desnutrición aumenta hasta diez veces si se realizan dietas restrictivas, siendo éste el factor de riesgo más importante45. En la mayoría de las ocasiones, la restricción dietética es consecuencia de pautas excesivamente estrictas impuestas por el propio paciente, por miedo a la aparición de nuevos brotes o síntomas digestivos (diarrea, distensión abdominal, etc.), pero en otras ocasiones estas pautas son dadas por el propio personal sanitario, sin una evidencia científica firme que las avale. La eliminación parcial o completa de algunos componentes de la dieta puede ocasionar déficits nutricionales y empeorar la desnutrición y la calidad de vida de nuestros pacientes, si no se realizan de forma controlada43,46.
Conclusión
La dieta parece tener un papel relevante en el tratamiento de la EII, no sólo por el alto riesgo de desnutrición de estos pacientes, sino por el papel que tiene en el control de síntomas y del curso de la enfermedad. Aunque la evidencia actual no nos permite dilucidar la dieta idónea para el tratamiento de la EII, con los datos disponibles parece razonable evitar el patrón de la western diet, que se ha relacionado con efectos deletéreos para la EII, y para la salud general.
El posible beneficio de la fibra dietética y del consumo de grasas con un perfil “antinflamatorio” como el aceite de oliva y el aceite de pescado, postula a la dieta mediterránea como el patrón de dieta equilibrada que podría ser más beneficioso para los pacientes con EII, si bien son necesarios estudios de intervención.
Es llamativo que las recomendaciones dietéticas más extendidas en la práctica clínica habitual no se acompañen de una evidencia científica sólida. Por ejemplo, la restricción de fibra dietética es una práctica muy habitual, y sin embargo apenas existen estudios de intervención que demuestren un beneficio clínico. La adición de fibra a la dieta sí ha obtenido beneficio clínico, incluso en fases de brote, como vimos en el caso de la dieta semivegetariana. Otra de las recomendaciones más extendidas en el tratamiento de la EII es la restricción de los lácteos, y como se ha visto, el beneficio clínico no está claro e incluso podría ser perjudicial para la salud ósea de los pacientes. Debemos ser cautelosos a la hora de eliminar totalmente un alimento o grupo de alimentos de la dieta, dado que la restricción dietética puede empeorar el estado nutricional, y las dietas de exclusión no son recomendadas por las sociedades científicas.
Fuente: Archivo
Además, no debemos olvidar la importancia que tiene la experiencia de los pacientes con EII. Son ellos los que nos cuentan qué alimentos toleran en su dieta habitual y cuáles no. Con la ayuda de una encuesta dietética detallada, podremos ayudar a los pacientes a diferenciar qué alimentos no son tolerados y cuáles son evitados fruto del prejuicio o la falta de información. Hemos visto que los alimentos más frecuentemente evitados son los lácteos y la fibra dietética. Parece prudente disminuir estos alimentos en fase activa de la enfermedad si el paciente presenta un empeoramiento subjetivo de los síntomas cuando los consume, sobre todo si existe diarrea severa. Las guías clínicas también recomiendan prudencia en el caso de enfermedad estructural.
La presentación clínica heterogénea propia de la EII, con afectación de distintos tramos intestinales, cirugías de resección, etc., hace necesario que las recomendaciones dietéticas sean individualizadas en la mayoría de los casos. El seguimiento nutricional estrecho y la prevención de déficits nutricionales son probablemente la clave del éxito para mantener el estado nutricional y la calidad de vida de estos pacientes.
Bibliografía
1. Ng SC, Shi HY, Hamidi N, Underwood FE, Tang W, Benchimol EI, et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. Lancet Lond Engl. 23 de 2018;390(10114):2769-78.
2. Ng SC, Bernstein CN, Vatn MH, Lakatos PL, Loftus EV, Tysk C, et al. Geographical variability and environmental risk factors in inflammatory bowel disease. Gut. abril de 2013;62(4):630-49.
3. Damas OM, Estes D, Avalos D, Quintero MA, Morillo D, Caraballo F, et al. Hispanics Coming to the US Adopt US Cultural Behaviors and Eat Less Healthy: Implications for Development of Inflammatory Bowel Disease. Dig Dis Sci. 2018;63(11):3058-66.
4. Sigall-Boneh R, Levine A, Lomer M, Wierdsma N, Allan P, Fiorino G, et al. Research Gaps in Diet and Nutrition in Inflammatory Bowel Disease. A Topical Review by D-ECCO Working Group [Dietitians of ECCO]. J Crohns Colitis. 4 de diciembre de 2017;11(12):1407-19.
5. Ananthakrishnan AN, Khalili H, Song M, Higuchi LM, Richter JM, Nimptsch K, et al. High School Diet and Risk of Crohn’s Disease and Ulcerative Colitis. Inflamm Bowel Dis. octubre de 2015;21(10):2311-9.
6. Ananthakrishnan AN, Khalili H, Konijeti GG, Higuchi LM, de Silva P, Korzenik JR, et al. A prospective study of long-term intake of dietary fiber and risk of Crohn’s disease and ulcerative colitis. Gastroenterology. noviembre de 2013;145(5):970-7.
7. Ananthakrishnan AN, Khalili H, Konijeti GG, Higuchi LM, de Silva P, Fuchs CS, et al. Long-term intake of dietary fat and risk of ulcerative colitis and Crohn’s disease. Gut. mayo de 2014;63(5):776-84.
8. Li F, Liu X, Wang W, Zhang D. Consumption of vegetables and fruit and the risk of inflammatory bowel disease: a meta-analysis. Eur J Gastroenterol Hepatol. junio de 2015;27(6):623-30.
9. Zeng L, Hu S, Chen P, Wei W, Tan Y. Macronutrient Intake and Risk of Crohn’s Disease: Systematic Review and Dose-Response Meta-Analysis of Epidemiological Studies. Nutrients. 15 de mayo de 2017;9(5).
10. IBD in EPIC Study Investigators, Tjonneland A, Overvad K, Bergmann MM, Nagel G, Linseisen J, et al. Linoleic acid, a dietary n-6 polyunsaturated fatty acid, and the aetiology of ulcerative colitis: a nested case-control study within a European prospective cohort study. Gut. diciembre de 2009;58(12):1606-11.
11. Chan S. Docosahexanoeic acid in the aetiology of Crohn’s disease-data from a European prospective cohort study (EPIC). Gut. 2012;61((Chan S.) Department of Gastroenterology, Norfolk and Norwich University Hospitals NHS Foundation Trust, Norwich, United Kingdom):A399.
12. Racine A, Carbonnel F, Chan SSM, Hart AR, Bueno-de-Mesquita HB, Oldenburg B, et al. Dietary Patterns and Risk of Inflammatory Bowel Disease in Europe: Results from the EPIC Study. Inflamm Bowel Dis. febrero de 2016;22(2):345-54.
13. Wang F, Feng J, Gao Q, Ma M, Lin X, Liu J, et al. Carbohydrate and protein intake and risk of ulcerative colitis: Systematic review and dose-response meta-analysis of epidemiological studies. Clin Nutr Edinb Scotl. 2017;36(5):1259-65.
14. Vasseur P, Dugelay E, Benamouzig R, Savoye G, Lan A, Srour B, et al. Dietary Patterns, Ultra-processed Food, and the Risk of Inflammatory Bowel Diseases in the NutriNet-Santé Cohort. Inflamm Bowel Dis. 14 de febrero de 2020;
15. Birchenough G, Schroeder BO, Bäckhed F, Hansson GC. Dietary destabilisation of the balance between the microbiota and the colonic mucus barrier. Gut Microbes. 2019;10(2):246-50.
16. Le Leu RK, Young GP, Hu Y, Winter J, Conlon MA. Dietary red meat aggravates dextran sulfate sodium-induced colitis in mice whereas resistant starch attenuates inflammation. Dig Dis Sci. diciembre de 2013;58(12):3475-82.
17. Ijssennagger N, Belzer C, Hooiveld GJ, Dekker J, van Mil SWC, Müller M, et al. Gut microbiota facilitates dietary heme-induced epithelial hyperproliferation by opening the mucus barrier in colon. Proc Natl Acad Sci U S A. 11 de agosto de 2015;112(32):10038-43.
18. Ge J, Han TJ, Liu J, Li JS, Zhang XH, Wang Y, et al. Meat intake and risk of inflammatory bowel disease: A meta-analysis. Turk J Gastroenterol Off J Turk Soc Gastroenterol. noviembre de 2015;26(6):492-7.
19. Sakamoto N, Kono S, Wakai K, Fukuda Y, Satomi M, Shimoyama T, et al. Dietary risk factors for inflammatory bowel disease: a multicenter case-control study in Japan. Inflamm Bowel Dis. febrero de 2005;11(2):154-63.
20. Bernstein CN, Rawsthorne P, Cheang M, Blanchard JF. A population-based case control study of potential risk factors for IBD. Am J Gastroenterol. mayo de 2006;101(5):993-1002.
21. Hou JK, Abraham B, El-Serag H. Dietary intake and risk of developing inflammatory bowel disease: a systematic review of the literature. Am J Gastroenterol. abril de 2011;106(4):563-73.
22. Rohr MW, Narasimhulu CA, Rudeski-Rohr TA, Parthasarathy S. Negative Effects of a High-Fat Diet on Intestinal Permeability: A Review. Adv Nutr Bethesda Md. 1 de enero de 2020;11(1):77-91.
23. de Silva PSA, Luben R, Shrestha SS, Khaw KT, Hart AR. Dietary arachidonic and oleic acid intake in ulcerative colitis etiology: a prospective cohort study using 7-day food diaries. Eur J Gastroenterol Hepatol. enero de 2014;26(1):11-8.
24. Innis SM, Jacobson K. Dietary lipids in early development and intestinal inflammatory disease. Nutr Rev. diciembre de 2007;65(12 Pt 2):S188-193.
25. de Silva PS, Korzenik JR. Inflammatory bowel disease: A focus on the involvement of dietary fats. Int J Interferon Cytokine Mediat Res. 2014;6(1):19-25.
26. McCormick N.M., Logomarsino J.V. The specific carbohydrate diet in the treatment of Crohn’s disease: A systematic review. J Gastroenterol Hepatol Res. 2017;6(4):2392-9.
27. Chan SSM, Luben R, van Schaik F, Oldenburg B, Bueno-de-Mesquita HB, Hallmans G, et al. Carbohydrate intake in the etiology of Crohn’s disease and ulcerative colitis. Inflamm Bowel Dis. noviembre de 2014;20(11):2013-21.
28. Pituch-Zdanowska A, Banaszkiewicz A, Albrecht P. The role of dietary fibre in inflammatory bowel disease. Przeglad Gastroenterol. 2015;10(3):135-41.
29. Celiberto LS, Graef FA, Healey GR, Bosman ES, Jacobson K, Sly LM, et al. Inflammatory bowel disease and immunonutrition: novel therapeutic approaches through modulation of diet and the gut microbiome. Immunology. 2018;155(1):36-52.
30. McGuckin MA, Lindén SK, Sutton P, Florin TH. Mucin dynamics and enteric pathogens. Nat Rev Microbiol. abril de 2011;9(4):265-78.
31. Desai MS, Seekatz AM, Koropatkin NM, Kamada N, Hickey CA, Wolter M, et al. A Dietary Fiber-Deprived Gut Microbiota Degrades the Colonic Mucus Barrier and Enhances Pathogen Susceptibility. Cell. 17 de 2016;167(5):1339-1353.e21.
32. Limdi JK, Aggarwal D, McLaughlin JT. Dietary Practices and Beliefs in Patients with Inflammatory Bowel Disease. Inflamm Bowel Dis. enero de 2016;22(1):164-70.
33. Guadagnoli L, Mutlu EA, Doerfler B, Ibrahim A, Brenner D, Taft TH. Food-related quality of life in patients with inflammatory bowel disease and irritable bowel syndrome. Qual Life Res Int J Qual Life Asp Treat Care Rehabil. agosto de 2019;28(8):2195-205.
34. Bergeron F, Bouin M, D’Aoust L, Lemoyne M, Presse N. Food avoidance in patients with inflammatory bowel disease: What, when and who? Clin Nutr Edinb Scotl. 2018;37(3):884-9.
35. Macedo C., Portela F., Ferreira A.M., Lopes S., Mendes S., Ferreira M., et al. Dietary restrictions on inflammatory bowel disease. J Crohns Colitis. 2019;13((Macedo C.; Portela F.; Ferreira A.M.; Lopes S.; Mendes S.; Ferreira M.; Tomé L.) Coimbra Hospital and University Centre, Gastroenterology, Coimbra, Portugal):S342.
36. Tomar SK, Kedia S, Upadhyay AD, Bopanna S, Yadav DP, Goyal S, et al. Impact of dietary beliefs and practices on patients with inflammatory bowel disease: An observational study from India. JGH Open Open Access J Gastroenterol Hepatol. septiembre de 2017;1(1):15-21.
37. Bergeron F., D’Aoust L., Lemoyne M., Bouin M. Dietary restrictions in inflammatory bowel disease. Can J Gastroenterol Hepatol [Internet]. 2016;2016((Bergeron F.; D’Aoust L.; Lemoyne M.; Bouin M.) Université De Montréal, Montreal, QC, Canada). Disponible en: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L72284898
38. Pieczyńska J, Prescha A, Zabłocka-Słowińska K, Neubauer K, Smereka A, Grajeta H, et al. Occurrence of dietary risk factors in inflammatory bowel disease: Influence on the nutritional status of patients in clinical remission. Adv Clin Exp Med Off Organ Wroclaw Med Univ. 2019;28(5):587-92.
39. Opstelten JL, de Vries JHM, Wools A, Siersema PD, Oldenburg B, Witteman BJM. Dietary intake of patients with inflammatory bowel disease: A comparison with individuals from a general population and associations with relapse. Clin Nutr Edinb Scotl. 2019;38(4):1892-8.
40. Crooks B., Limdi J.K., McLaughlin J.T. Dietary practices and beliefs of patients with inactive ulcerative colitis: A prospective study from the United Kingdom. Proc Nutr Soc [Internet]. 2020;79(OCE1). Disponible en: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L630723143
41. Crooks B., Limdi J.K., McLaughlin J.T. Dietary practices and beliefs of patients with older-onset inflammatory bowel disease: A prospective study from the United Kingdom. Proc Nutr Soc. 2020;79(OCE1):E21.
42. Cohen AB, Lee D, Long MD, Kappelman MD, Martin CF, Sandler RS, et al. Dietary patterns and self-reported associations of diet with symptoms of inflammatory bowel disease. Dig Dis Sci. mayo de 2013;58(5):1322-8.
43. Lim H-S, Kim S-K, Hong S-J. Food Elimination Diet and Nutritional Deficiency in Patients with Inflammatory Bowel Disease. Clin Nutr Res. enero de 2018;7(1):48-55.
44. Walton M, Alaunyte I. Do patients living with ulcerative colitis adhere to healthy eating guidelines? A cross-sectional study. Br J Nutr. 28 de noviembre de 2014;112(10):1628-35.
45. Casanova MJ, Chaparro M, Molina B, Merino O, Batanero R, Dueñas-Sadornil C, et al. Prevalence of Malnutrition and Nutritional Characteristics of Patients With Inflammatory Bowel Disease. J Crohns Colitis. 4 de diciembre de 2017;11(12):1430-9.
46. Nguyen GC, Munsell M, Harris ML. Nationwide prevalence and prognostic significance of clinically diagnosable protein-calorie malnutrition in hospitalized inflammatory bowel disease patients: Inflamm Bowel Dis. agosto de 2008;14(8):1105-11.




