La disfunción tiroidea es la segunda causa de patología endocrinológica durante la gestación1. Su elevada prevalencia y la morbilidad materno-fetal que se le asocia, así como las dificultades en el diagnóstico y manejo de esta patología, ha motivado que diferentes sociedades científicas hayan elaborado guías de práctica clínica para mejorar el diagnóstico y manejo de estas patologías. Sin embargo, entre estas guías existen algunas diferencias remarcables, como por ejemplo en los valores de referencia de la tirotropina (TSH) o en los criterios para el tratamiento con levotiroxina2-6. Ante las dificultades y divergencias surgidas en el manejo de estas patologías, recientemente, se ha publicado un documento de consenso7 elaborado por las Sociedades Españolas de Endocrinología y Nutrición (SEEN) y la de Ginecología y Obstetricia (SEGO) para ofrecer a los profesionales que intervienen en el control de la mujer embarazada, unas recomendaciones que unifiquen los criterios en el manejo de las patologías tiroideas más comunes, tanto para el diagnóstico como para el control y tratamiento. Este breve artículo pretende exponer los aspectos y recomendaciones más relevantes que componen este documento de consenso.
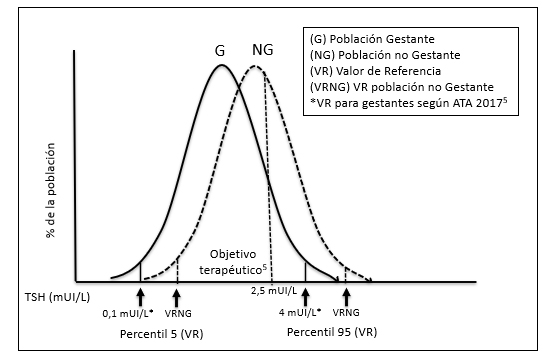
Figura 1. Distribución de la TSH y VR en población gestante5 y no gestante
VALORES DE REFERENCIA
En el primer trimestre de la gestación se producen unos cambios fisiológicos que modifican las concentraciones de las hormonas tiroideas y de la TSH. Por este motivo también varían sus valores de referencia (VR). Destaca la disminución de la concentración de TSH en el primer trimestre, por lo que sus VR serán inferiores a los de la población no gestante. La American Thyroid Association (ATA), ya en su guía de 20112 estableció la recomendación de que cada centro calculara sus propios valores de referencia. En el caso de no disponer de VR propios, la nueva guía de la ATA5 propuso utilizar, como punto de corte superior de la TSH, el valor de 4 mUI/L y como límite inferior el valor de 0,1 mUI/L. En la Figura 1 puede verse un esquema sobre la distribución de la TSH en población gestante y no gestante.
CLASIFICACIÓN DE LAS DISFUNCIONES
Además de las disfunciones tiroideas clásicas (hipotiroidismo clínico y subclínico e hipertiroidismo clínico y subclínico), durante la gestación pueden presentarse dos entidades que le son específicas: el hipertiroidismo gestacional (se comenta más adelante) y la hipotiroxinemia materna aislada, que se asocia a la deficiencia de yodo8.
CRIBADO
El cribado de la disfunción tiroidea ha sido y es motivo de discusión. Diversas guías abogan por un cribado selectivo entre las mujeres con mayor riesgo, destacando: historia personal o familiar de autoinmunidad, edad >30 años, gestación múltiple o residir en zona con deficiencia de yodo4-6. Sin embargo, ya en 2012 la SEEN-SEGO publicó un primer documento de consenso en el que se abogaba por un cribado universal de la disfunción tiroidea9. En el documento actual se sigue con el mismo planteamiento basándose en argumentos por cuestiones clínicas y de rendimiento diagnóstico, así como de estrategia coste-efectiva.
El cribado se aconseja realizarlo7 a todas las mujeres gestantes sanas entre las semanas 9-11, coincidiendo con el análisis bioquímico del programa de Detección Precoz de Aneuploidías.
NUTRICIÓN DE YODO
Las hormonas tiroideas (HT) contienen yodo, por lo que este micronutriente es imprescindible para su síntesis. Las HT participan directamente en el neurodesarrollo del feto10. Durante la gestación hay un significativo aumento de las necesidades de yodo debido al paso de yodo y de HT al feto, a un mayor aclaramiento renal de yodo y también a un aumento de la síntesis de HT. Para la mujer gestante y lactante, la OMS recomienda una ingesta de 250 µg/día de yodo11. Asimismo, no recomienda sobrepasar los 500 µg/día, ya que si se sobrepasa esta cantidad, aparte de que no se aporta ningún beneficio, se corre el riesgo de producir alteraciones de la función tiroidea12.

Dr. Lluís Vila
Fuente: Dr. Vila
Los requerimientos de yodo se pueden alcanzar con:
Alimentos ricos en yodo: En España el contenido de yodo en la sal yodada es de los más elevados de Europa (60 ppm), por lo que con un bajo consumo de sal yodada fácilmente se pueden cubrir los objetivos de consumo propuestos, no contraviniendo así las recomendaciones de reducir su consumo (“consumir poca sal pero que sea yodada”). En la actualidad, los lácteos son una importante fuente de yodo13. Así pues, para alcanzar las recomendaciones de ingesta de yodo se pueden conseguir con la ingesta de 3 raciones de leche o derivados y 2 gramos de sal yodada a diario. Es necesario llegar a la gestación con una adecuada repleción de los depósitos de yodo, por lo que se precisa un consumo de sal yodada durante al menos 2 años previos al embarazo, hecho que corroboran algunos estudios de nuestro país14-17.
Suplementos yodados: Garantizan un adecuado aporte de yodo. Existe un debate sobre si la suplementación con yoduro potásico debe ser universal o solo a las mujeres gestantes con una baja ingesta de yodo (no ingesta de sal yodada y un consumo de lácteos<2 raciones/día). La discusión se plantea en las poblaciones con una deficiencia de yodo leve o moderada. En esta situación, diversos metaanálisis/revisiones sistemáticas aprecian cambios positivos en el coeficiente intelectual de los hijos al suplementar18-22, mientras que otros no observan ningún cambio21,23-26. La OMS aconseja suplementar a mujeres gestantes en el caso de que la población general tenga una mediana de yoduria < 100 µg/L y que el uso de la sal yodada se realice en menos del 90% de los hogares.
En España, los suplementos tienen un contenido de yodo entre 150 y 300 µg por comprimido y pueden ir asociados a ácido fólico y vitamina B12. El documento de consenso recomienda la suplementación con yoduro potásico cuando no existen garantías de una ingesta adecuada de yodo con sal yodada y lácteos, situación que todavía afecta a una buena parte de la población gestante de España27.
HIPOTIROIDISMO
Se aconseja que las mujeres con un hipotiroidismo conocido y deseo gestacional planifiquen su embarazo. Los profesionales deben indicar ajustes de levotiroxina para conseguir una TSH pregestacional < 2,5 mUI/L5. Alcanzar este punto de corte antes de la gestación permite que se pueda responder adecuadamente al aumento de necesidades de tiroxina durante la gestación, reduciendo, de este modo, el riesgo de aborto o que se descompense el hipotiroidismo.
Manejo del hipotiroidismo clínico
El hipotiroidismo clínico se asocia a un gran número de complicaciones maternas y fetales o neonatales5,28. También los hijos de madres con hipotiroidismo clínico no tratado pueden presentar una marcada disminución del coeficiente intelectual29.
Si antes de la gestación la TSH es >2,5 mUI/L o no se ha determinado, cuando se confirma el embarazo, la dosis de levotiroxina debe incrementarse sobre un 30%, aunque puede ser preciso llegar al 40% si el hipotiroidismo es debido a una ablación por cirugía o por yodo radioactivo.
El objetivo del tratamiento será mantener la TSH <2,5 mUI/L. El primer control se realizará cuando se confirme el embarazo y, posteriormente, cada 4 semanas para titular la levotiroxina. A partir de la semana 20, si se ha alcanzado el objetivo, el siguiente control puede realizarse a la semana 30.
Si el diagnóstico del hipotiroidismo clínico se realiza durante la gestación, se aconseja iniciar con una dosis de levotiroxina de 2,3 mcg/kg/día. Si al diagnóstico la TSH es >10 mUI/L, esta dosis se podría doblar y reajustar cuando se alcance el objetivo30,31.
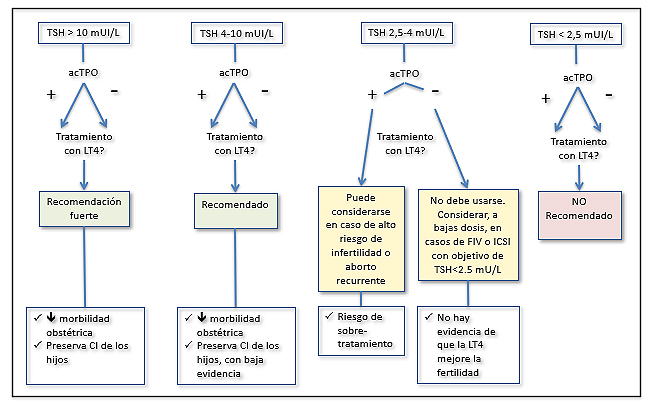
Figura 2. Manejo del Hipotiroidismo Subclínico (basado en Velasco et al 32)
acTPO: anticuerpos antiperoxidasa
LT4: Levotiroxina sódica
Manejo del hipotiroidismo subclínico (HSC)
El HSC se ha asociado a diversas complicaciones materno-fetales, pero el beneficio del tratamiento con levotiroxina está muy controvertido, hecho que se ilustra en las diferentes recomendaciones que ofrecen las guías anteriormente mencionadas. Por ello, el actual consenso considera que los pros y contras para el tratamiento del HSC deberían valorarse de manera individualizada. En la Figura 2, basada en la publicación de Velasco y colaboradores32, se incluyen los posibles escenarios y la actitud recomendada.
HIPERTIROIDISMO
Con respecto al hipertiroidismo, el documento plantea cuatro premisas clave a considerar:
1. Es preciso que las mujeres con hipertiroidismo conocido planifiquen su gestación de acuerdo con el endocrinólogo y ginecólogo, procurando escoger el momento más adecuado, que debe coincidir con una mayor estabilidad de la enfermedad.
2. En la gestación es preciso diferenciar adecuadamente el hipertiroidismo gestacional transitorio (HGT), la hiperémesis gravídica y otros hipertiroidismos como la enfermedad de Graves (EG).
3. Las mujeres con un hipertiroidismo conocido ya antes de la gestación, así como el que se diagnostica durante el embarazo, deben derivarse cuanto antes al endocrinólogo para que indique el tratamiento más adecuado. El control de estas pacientes requiere de un trabajo en equipo entre los profesionales que realizan el seguimiento del embarazo.
4. El hipertiroidismo clínico mal controlado, especialmente en la EG (la más frecuente), puede asociarse a un aumento de la morbilidad obstétrica33, fetal y neonatal5,28. No se ha demostrado morbilidad asociada en los casos de hipertiroidismo subclínico, por lo que no se deben tratar.
En la gestación, una TSH < 0,1 mUI/L es indicativa de un hipertiroidismo. En estos casos es preceptivo solicitar un control de tiroxina libre (más claramente elevada en la EG), β-hCG (más elevada en los casos de HGT) y de TSI (anticuerpos antireceptor de TSH) (elevados en la EG). Aunque la clínica puede solaparse, lo más común es que en el HGT, la clínica predominante sea la presencia de vómitos y también la pérdida de peso. En la EG puede existir, entre otra clínica, bocio, orbitopatía, taquicardia y pérdida de peso.

Fuente: Archivo
La HGT no precisa tratamiento y se autolimita al finalizar el primer trimestre. La EG habitualmente persiste, pero es frecuente que suela remitir parcialmente durante la gestación. En estos casos (disminución de los TSI, normalización de la TSH y T4 libre, con bajas dosis de antitiroideos) es preciso plantear la interrupción de la medicación.
Los fármacos antitiroideos pueden tener un efecto teratogénico (metimazol > propiltiouracilo –PTU-)34 y de toxicidad hepática (PTU). Si el tratamiento no se puede interrumpir durante el primer trimestre o antes de la gestación (si se planifica el embarazo), se aconseja iniciar o cambiar el tratamiento a PTU para, posteriormente, a partir del 2º trimestre, pasar a metimazol. Siempre se procurará utilizar la mínima dosis de antitiroideos y plantearse como objetivo que la T4 libre se mantenga en el límite superior de la normalidad. Los controles deben realizarse cada 4 semanas.
En la EG, cuando en el 2º o 3r trimestres los TSI triplican su valor de normalidad, existe un riesgo tanto de hipertiroidismo fetal como neonatal. En estos casos es preciso realizar una monitorización ecográfica fetal y consultar al equipo de neonatología después del parto. En pacientes con EG que han recibido un tratamiento definitivo, especialmente si ha sido con yodo radioactivo, los TSI pueden persistir elevados, por lo que será necesario monitorizarlos.
AUTOINMUNIDAD TIROIDEA DURANTE LA GESTACIÓN
Según la ATA5, se recomienda solicitar los anticuerpos antiperoxidasa (antiTPO) cuando, en el primer trimestre, la TSH sea >2,5 mUI/L. Desde otra perspectiva, siguiendo las recomendaciones de la reciente guía de la Sociedad Europea de Tiroides35, el documento de consenso recomienda que, en los casos de mujeres con infertilidad, se determinen los antiTPO y también los anticuerpos antitiroglobulina, ya que existen evidencias sobre su asociación con este problema.
Aunque la autoinmunidad tiroidea se ha asociado a un mayor riesgo de aborto y parto pretérmino36, no está claro el beneficio que pueda representar tratar con levotiroxina a mujeres eutiroideas con antiTPO positivos. En casos de subfertilidad debe individualizarse el tratamiento con levotiroxina35. En la Figura 2 se dan algunas indicaciones.
La presencia de autoinmunidad tiroidea representa un mayor riesgo de padecer una tiroiditis postparto.
Referencias
1. Tingi E, Syed AA, Kyriacou A, Mastorakos G, Kyriacou A. Benign thyroid disease in pregnancy: A state of the art review. J Clin Transl Endocrinol. 2016;6. doi:10.1016/j.jcte.2016.11.001
2. Stagnaro-Green A, Abalovich M, Alexander E, et al. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. In: Thyroid. Vol 21. ; 2011:1081-1125. doi:10.1089/thy.2011.0087
3. Lazarus J, Brown RS, Daumerie C, Hubalewska-Dydejczyk A, Negro R, Vaidya B. 2014 European thyroid association guidelines for the management of subclinical hypothyroidism in pregnancy and in children. Eur Thyroid J. 2014;3(2). doi:10.1159/000362597
4. de Groot L, Abalovich M, Alexander EK, et al. Management of thyroid dysfunction during pregnancy and postpartum: An endocrine society clinical practice guideline. Journal of Clinical Endocrinology and Metabolism. 2012;97(8):2543-2565. doi:10.1210/jc.2011-2803
5. Alexander EK, Pearce EN, Brent GA, et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease during Pregnancy and the Postpartum. Thyroid. 2017;27(3):315-389. doi:10.1089/thy.2016.0457
6. Thyroid Disease in Pregnancy: ACOG Practice Bulletin, Number 223. Obstetrics and gynecology. 2020;135(6). doi:10.1097/AOG.0000000000003893
7. Velasco I, Vila L, Goya M, Oleaga A, de la Calle M, Santamaria FcoJ. Executive summary of the SEEN (Sociedad Española de Endocrinología y Nutrición[Spanish Society of Endocrinology and Nutrition])-SEGO (Sociedad Española de Ginecología y Obstetricia [Spanish Society of Gynaecology and Obstetrics]) consensus document on the management of thyroid dysfunction during pregnancy. Endocrinología, Diabetes y Nutrición (English ed). Published online November 2022. doi:10.1016/J.ENDIEN.2022.11.008
8. Dosiou C, Medici M. Isolated maternal hypothyroxinemia during pregnancy: Knowns and unknowns. Eur J Endocrinol. 2017;176(1). doi:10.1530/EJE-16-0354
9. Vila L, Velasco I, González S, et al. Detection of thyroid dysfunction in pregnant women: Universal screening is justified. Endocrinologia y Nutricion. 2012;59(9):547-560. doi:10.1016/j.endonu.2012.06.014
10. Skeaff SA. Iodine deficiency in pregnancy: the effect on neurodevelopment in the child. Nutrients. 2011;3.
11. Andersson M, de Benoist B, Delange F, Zupan J. Prevention and control of iodine deficiency in pregnant and lactating women and in children less than 2-years-old: Conclusions and recommendations of the Technical Consultation. In: Public Health Nutrition. Vol 10. Cambridge University Press; 2007:1606-1611. doi:10.1017/S1368980007361004
12. Eastman CJ, Ma G, Li M. Optimal assessment and quantification of iodine nutrition in pregnancy and lactation: Laboratory and clinical methods, controversies and future directions. Nutrients. 2019;11(10). doi:10.3390/nu11102378
13. Soriguer F, Gutierrez-Repiso C, Gonzalez-Romero S, et al. Iodine concentration in cow’s milk and its relation with urinary iodine concentrations in the population. Clinical Nutrition. 2011;30(1):44-48. doi:10.1016/j.clnu.2010.07.001
14. Santiago P, Velasco I, Muela JA, et al. Infant neurocognitive development is independent of the use of iodised salt or iodine supplements given during pregnancy. British Journal of Nutrition. 2013;110(5):831-839. doi:10.1017/S0007114512005880
15. Menéndez Torre E, Delgado Alvarez E, Rabal Artal A, et al. Nutrición de yodo en mujeres embarazadas del área de Oviedo. ¿Es necesaria la suplementación con yodo? Endocrinologia y Nutricion. 2014;61(8):404-409. doi:10.1016/j.endonu.2014.02.005
16. Torres MT, Francés L, Vila L, et al. Iodine nutritional status of women in their first trimester of pregnancy in Catalonia. BMC Pregnancy Childbirth. 2017;17(1). doi:10.1186/s12884-017-1423-4
17. González-Martínez S, Riestra-Fernández M, Martínez-Morillo E, et al. Nutritional Iodine Status in Pregnant Women from Health Area IV in Asturias (Spain): Iodised Salt Is Enough. Published online 2021. doi:10.3390/nu13061816
18. Machamba AAL, Azevedo FM, Fracalossi KO, Franceschini SDCC. Effect of iodine supplementation in pregnancy on neurocognitive development on offspring in iodine deficiency areas: A systematic review. Arch Endocrinol Metab. 2021;65(3). doi:10.20945/2359-3997000000376
19. Levie D, Korevaar TIM, Bath SC, et al. Association of Maternal Iodine Status with Child IQ: A Meta-Analysis of Individual Participant Data. Journal of Clinical Endocrinology and Metabolism. 2019;104(12). doi:10.1210/jc.2018-02559
20. Taylor PN, Okosieme OE, Dayan CM, Lazarus JH. Therapy of endocrine disease: Impact of iodine supplementation in mild-to-moderate iodine deficiency: systematic review and meta-analysis. European journal of endocrinology / European Federation of Endocrine Societies. 2014;170(1). doi:10.1530/EJE-13-0651
21. Bougma K, Aboud FE, Harding KB, Marquis GS. Iodine and mental development of children 5 years old and under: A systematic review and meta-analysis. Nutrients. 2013;5(4). doi:10.3390/nu5041384
22. Trumpff C, de Schepper J, Tafforeau J, van Oyen H, Vanderfaeillie J, Vandevijvere S. Mild iodine deficiency in pregnancy in Europe and its consequences for cognitive and psychomotor development of children: A review. Journal of Trace Elements in Medicine and Biology. 2013;27(3). doi:10.1016/j.jtemb.2013.01.002
23. Nazeri P, Shariat M, Azizi F. Effects of iodine supplementation during pregnancy on pregnant women and their offspring: A systematic review and meta-analysis of trials over the past 3 decades. Eur J Endocrinol. 2021;184(1):91-106. doi:10.1530/EJE-20-0927
24. Dineva M, Fishpool H, Rayman MP, Mendis J, Bath SC. Systematic review and meta-analysis of the effects of iodine supplementation on thyroid function and child neurodevelopment in mildly-to-moderately iodine-deficient pregnant women. American Journal of Clinical Nutrition. 2020;112(2):389-412. doi:10.1093/ajcn/nqaa071
25. Harding KB, Peña-Rosas JP, Webster AC, et al. Iodine supplementation for women during the preconception, pregnancy and postpartum period. Cochrane Database of Systematic Reviews. 2017;2017(3). doi:10.1002/14651858.CD011761.pub2
26. Zhou SJ, Skeaff SA, Ryan P, et al. The effect of iodine supplementation in pregnancy on early childhood neurodevelopment and clinical outcomes: results of an aborted randomised placebo-controlled trial. Trials. 2015;16. doi:10.1186/s13063-015-1080-8
27. Vila L, Lucas A, Donnay S, et al. Iodine nutrition status in Spain Needs for the future. Endocrinol Diabetes Nutr. 2020;67(1):61-69. doi:10.1016/j.endinu.2019.02.009
28. Ge GM, Leung MTY, Man KKC, et al. Maternal thyroid dysfunction during pregnancy and the risk of adverse outcomes in the offspring: A systematic review and meta-analysis. Journal of Clinical Endocrinology and Metabolism. 2020;105(12). doi:10.1210/clinem/dgaa555
29. Haddow JE, Palomaki GE, Allan WC, et al. Maternal Thyroid Deficiency during Pregnancy and Subsequent Neuropsychological Development of the Child. New England Journal of Medicine. 1999;341(8). doi:10.1056/nejm199908193410801
30. Abalovich M, Vázquez A, Alcaraz G, et al. Adequate levothyroxine doses for the treatment of hypothyroidism newly discovered during pregnancy. Thyroid. 2013;23(11). doi:10.1089/thy.2013.0024
31. Shan Z, Teng W. Thyroid hormone therapy of hypothyroidism in pregnancy. Endocrine. 2019;66(1). doi:10.1007/s12020-019-02044-2
32. Velasco I, Taylor P. Identifying and treating subclinical thyroid dysfunction in pregnancy: Emerging controversies. Eur J Endocrinol. 2018;178(1):D1-D12. doi:10.1530/EJE-17-0598
33. Lillevang-Johansen M, Abrahamsen B, Jørgensen HL, Brix TH, Hegedüs L. Excess mortality in treated and untreated hyperthyroidism is related to cumulative periods of low serum TSH. Journal of Clinical Endocrinology and Metabolism. 2017;102(7). doi:10.1210/jc.2017-00166
34. Laurberg P, Andersen SL. Antithyroid Drug Use in Pregnancy and Birth Defects: Why Some Studies Find Clear Associations, and Some Studies Report None. Thyroid. 2015;25(11). doi:10.1089/thy.2015.0182
35. Poppe K, Bisschop P, Fugazzola L, Minziori G, Unuane D, Weghofer A. 2021 European Thyroid Association Guideline on Thyroid Disorders prior to and during Assisted Reproduction. Eur Thyroid J. 2021;9(6). doi:10.1159/000512790
36. Thangaratinam S, Tan A, Knox E, Kilby MD, Franklyn J, Coomarasamy A. Association between thyroid autoantibodies and miscarriage and preterm birth: Meta-analysis of evidence. BMJ. 2011;342(7806). doi:10.1136/bmj.d2616.




