Redacción Farmacosalud.com
La compañía MSD ha anunciado una actualización de los resultados de los ensayos KEYNOTE-045 y KEYNOTE-052, dos estudios que investigan KEYTRUDA® (pembrolizumab), el tratamiento anti-PD-1 de la compañía, en determinados pacientes con carcinoma urotelial localmente avanzado o metastásico, un tipo de cáncer de vejiga. Estos datos -que incluyen los resultados de supervivencia actualizados y los análisis de biomarcadores- mostraron aún más el potencial de KEYTRUDA como tratamiento de segunda línea en pacientes tras fracaso al platino y como tratamiento de primera línea en pacientes no elegibles para recibir tratamiento basado en cisplatino. En concreto, en el contexto de la segunda línea, pembrolizumab mejoró la supervivencia global (SG) en comparación con la quimioterapia -reduciendo en un 30% el riesgo de muerte (HR, 0,70 [IC del 95%, 0,57-0,86]; p = 0,0004 y en el contexto de la primera línea, KEYTRUDA demostró una tasa de respuesta global (TRG) del 29% (IC del 95%, 25 34).
Los hallazgos se han conocido con motivo de la Reunión Anual de la Sociedad Americana de Oncología Médica (ASCO), en Chicago. “Históricamente ha habido opciones muy limitadas de tratamiento para los pacientes con cáncer de vejiga urotelial avanzado”, ha señalado el Dean F. Bajorin, M.D., oncólogo médico del Memorial Sloan Kettering Cancer Center (Nueva York, EEUU). “Para los pacientes con esta devastadora enfermedad, la eficacia y el perfil de seguridad que hemos observado con KEYTRUDA en estos escenarios de tratamiento representan una importante nueva opción.” El programa de desarrollo clínico de KEYTRUDA (pembrolizumab) incluye más de 30 tipos tumorales en más de 500 ensayos clínicos, incluidos más de 300 ensayos que combinan KEYTRUDA con otros tratamientos para el cáncer. Actualmente, MSD tiene el mayor programa de desarrollo clínico en inmunooncología en cáncer de vejiga, con 29 ensayos en marcha que incluyen pembrolizumab en monoterapia y en combinación, incluidos cuatro ensayos de registro.

Fuente: www.farmacosalud.com / IMAGEN DE ARCHIVO
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
KEYNOTE-045
El ensayo KEYNOTE-045 es un ensayo de fase 3, aleatorizado, multicéntrico, con control activo, que investiga KEYTRUDA en 542 pacientes con carcinoma urotelial localmente avanzado o metastásico con progresión de la enfermedad durante o después de haber recibido quimioterapia basada en platino. Los datos conocidos ahora se basan en un mayor seguimiento (mediana de seguimiento de 18,5 meses a 18 de enero de 2017; intervalo: 14,2-26,5) y continúan mostrando una ventaja en SG superior con KEYTRUDA en comparación con quimioterapia en el tratamiento de segunda línea de pacientes con carcinoma urotelial avanzado que han tenido progresión durante o tras recibir quimioterapia basada en platino, independientemente de la expresión de PD-L1.
El análisis de los criterios de valoración principales mostró un 30% de reducción en el riesgo de muerte con KEYTRUDA (n=270) en comparación con la quimioterapia (n=272) (HR, 0,70 [IC del 95%, 0,57-0,86] p = 0,0004). La mediana de SG con KEYTRUDA fue de 10.3 meses (IC del 95%, 8.0-12.3) frente a 7.4 meses con quimioterapia (IC del 95% CI, 6.1-8.1). Tal y como se notificó previamente, no hubo diferencias significativas en la supervivencia libre de progresión (SLP) entre los brazos (HR, 0,96 [IC del 95%, 0,79-1,16], p= 0,32). La mediana de SLP fue de 2,1 meses (IC del 95%, 2,0-2,2) en el brazo que recibió KEYTRUDA y de 3,3 meses (IC del 95%, 2,4-3,5) en el brazo de quimioterapia. La tasa de SLP a los 6, 12 y 18 meses en el brazo de KEYTRUDA fue del 28,8%, 17,6% y 16,8% respectivamente; la SLP a los 6, 12 y 18 meses en el brazo que recibió quimioterapia fue del 28,4%, 7,9% y 3,5% respectivamente.
El análisis de los criterios de valoración secundarios mostró una mayor TRG con KEYTRUDA en comparación con la quimioterapia. En los pacientes tratados con KEYTRUDA, la TRG fue del 21,1% -con una tasa de respuestas completas del 7,8% y una tasa de respuestas parciales del 13,3%. En los pacientes tratados con quimioterapia, la TRG fue del 11,0% -con una tasa de respuesta completa del 2,9% y una tasa de respuestas parciales del 8,1%. La mediana de duración de respuesta no se había alcanzado en el brazo que recibió KEYTRUDA (intervalo: 1,6+-20,7+) y fue de 4,4 meses en el brazo de quimioterapia (intervalo: 1,4+-20,3+).
El perfil de seguridad de KEYTRUDA fue consistente con el observado en estudios previos. Los acontecimientos adversos de grado 1-2 relacionados con el tratamiento en el brazo de KEYTRUDA fueron anemia, astenia, estreñimiento, descenso del apetito, diarrea, fatiga, náuseas, neuropatía periférica, neuropatía sensorial periférica y prurito. Los acontecimientos adversos de grado 3-5 relacionado con el tratamiento en el brazo de KEYTRUDA incluyeron anemia, astenia, disminución de los neutrófilos, diarrea, fatiga, náuseas y prurito. Los acontecimientos adversos de grado 3-5 mediados por el sistema inmunitario incluyeron insuficiencia suprarrenal, colitis, nefritis, neumonitis y reacción cutánea grave.
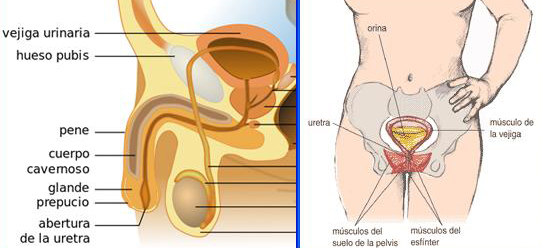
Imagen de la izquierda: La vejiga y el aparato reproductor masculino
Autor/a de la imagen: Male_anatomy.png: alt.sex FAQ Male_anatomy_all.svg: Tsaitgaist (talk) Spanish version: Angelito7 (talk) – Male_anatomy_all.svg
Fuente: Wikipedia
Imagen de la derecha: Componentes del sistema de control de la vejiga ilustrado en la mujer
Fuente: http://kidney.niddk.nih.gov/spanish/pubs/medicine/index.htm / User: Dodo
Difusión: Wikipedia
KEYNOTE-052
El estudio KEYNOTE-052 es un ensayo multicéntrico, abierto, de brazo único, en fase 2, que investiga KEYTRUDA en 370 pacientes con carcinoma urotelial localmente avanzado o metastásico que no son elegibles para recibir quimioterapia con cisplatino. Los nuevos datos, que incluyen a toda la población del estudio y un seguimiento mayor, muestran que, en el contexto de tratamiento de primera línea, muchos pacientes con carcinoma urotelial avanzado que no eran elegibles para cisplatino y que fueron tratados con KEYTRUDA continuaron experimentando respuestas completas o parciales. En la población completa del estudio (n=370), el análisis de la eficacia mostró una TRG del 29% (IC del 95%, 25-34) - con una tasa de respuestas completas del 7% (IC del 95%, 5-10) y una tasa de respuestas parciales del 22% (IC del 95%, 18-27). En el momento del análisis, el 67% de las respuestas se mantenían -de las cuales el 82% habían durado seis meses o más. La mediana de duración de la respuesta no se había alcanzado en el momento del análisis (IC del 95%, 12 meses-no alcanzada).
El estudio incluyó también un conjunto de formación (los primeros 100 pacientes incluidos) que se usó para identificar el punto de corte de CPS para la expresión de PD-L1, y un conjunto de validación (que incluyó a los 270 pacientes evaluables), con la intención de validar el punto de corte de puntuación combinado positivo (CPS). De los 270 pacientes en el conjunto de validación, en los pacientes con expresión de PD-L1 de menos del 10% (CPS <10), la TRG fue del 23% (IC del 95%, 17-29), con una tasa de respuestas completas del 3% (IC del 95%, 1 6) y una tasa de respuestas parciales del 20% (IC del 95%, 15-27); en los pacientes con expresión de PD-L1 igual o mayor al 10% (CPS ≥10%), la TRO fue del 51% (IC del 95%, 40-63), con una tasa de respuestas completas del 18% (IC del 95%, 10-28) y una tasa de respuestas parciales del 34% (IC del 95%, 24-45).
Los acontecimientos adversos relacionados con el tratamiento (de cualquier grado, que se produjeron en el 5% o más de los pacientes [n=370] en orden descendente) fueron cansancio (18%), prurito (17%), erupción cutánea (12%), disminución del apetito (10%), hipotiroidismo (10%), diarrea (9%) y náuseas (8%). Los acontecimientos adversos relacionados con el tratamiento de grado 3-5 observados (que se produjeron en 3 o más de los pacientes) fueron cansancio (2%), colitis (2%), debilidad muscular (1%), elevación de la fosfatasa alcalina (1%), diarrea (1%), neumonitis (1%), elevación de la AST (1%), astenia (1%), hepatitis (1%) y elevación de la ALT (1%). Los acontecimientos adversos de grado 3-5 mediados por el sistema inmunitario incluyeron: insuficiencia suprarrenal, colitis, dermatitis bullosa, cetoacidosis diabética, hepatitis, miocarditis, neumonitis, tiroiditis, diabetes mellitus tipo 1, nefritis tubulointersticial, y erupción cutánea.

Fuente: Archivo
El ensayo KEYNOTE-045 es un ensayo de fase 3, randomizado, multicéntrico, con control activo, que investiga KEYTRUDA en 542 pacientes con carcinoma urotelial localmente avanzado o metastásico con progresión de la enfermedad durante o después de haber recibido quimioterapia basada en platino. Los pacientes fueron asignados aleatoriamente a recibir KEYTRUDA 200 mg cada tres semanas (n=270) o bien la elección del investigador de cada uno de los siguientes regímenes de quimioterapia, todos ellos administrados de forma intravenosa cada tres semanas (n=272): paclitaxel 175 mg/m2 (n=84), docetaxel 75 mg/m2 (n=84), o vinflunina 320 mg/m2 (n=87). El tratamiento se continuó hasta toxicidad inaceptable o progresión de la enfermedad: los pacientes sin progresión dela enfermedad podían ser tratados hasta un máximo de 24 meses. Los objetivos primarios eran SG y SLP, evaluados por un comité central independiente (BICR) en base a RECIST (Criterio de evaluación de respuesta en tumores sólidos) v1.1; medidas adicionales de eficacia incluyeron TRG, evaluado por BICR en base a RECIST 1.1. y duración de la respuesta. La eficacia se evaluó en todos los pacientes, también en los pacientes con expresión de PD-L1 -determinada por un CPS igual o superior al 10% (CPS ≥10%) (brazo de KEYTRUDA: n=74/270; brazo de quimioterapia; n=90/272).
KEYNOTE-052 es un ensayo en fase 2, multicéntrico, abierto, de un solo brazo, que investiga KEYTRUDA en 370 pacientes con carcinoma urotelial localmente avanzado o metastásico que no son elegibles para un tratamiento de quimioterapia que contenga cisplatino. Los pacientes recibieron KEYTRUDA a una dosis de 200 mg cada tres semanas hasta toxicidad inaceptable o progresión de la enfermedad; los pacientes sin progresión de la enfermedad podían ser tratados hasta un máximo de 24 meses. El estudio incluyó un conjunto de formación (los primeros 100 pacientes incluidos) que se usó para identificar el punto de corte CPS para la expresión de PD-L1 y un conjunto de validación que incluyó a los 270 pacientes evaluables y se usará para validar el punto de corte CPS. Los objetivos principales incluyeron TRG en todos los pacientes incluidos en el estudio (población total del estudio) y en pacientes con tumores PD-L1 positivos (expresión del 1% o más); los objetivos secundarios incluían la duración de la respuesta, SLP y SG. La respuesta tumoral fue medida de acuerdo con los criterios RECIST v1.1. evaluados mediante una revisión central independiente.
Un anticuerpo monoclonal que bloquea la interacción entre PD-1 y sus ligandos
KEYTRUDA® es un anticuerpo monoclonal humanizado que bloquea la interacción entre PD-1 y sus ligandos, PD-L1 y PD-L2. Por la unión al receptor PD-1 y el bloqueo de la interacción con sus ligandos, KEYTRUDA® libera la inhibición mediada por vía PD-1 de la respuesta inmune, incluyendo la respuesta inmune antitumoral. MSD tiene en marcha un programa de desarrollo clínico para pembrolizumab, cada vez más amplio, que incluye más de 500 ensayos clínicos en más de 30 tipos de tumores y más de 40.000 pacientes, tanto en monoterapia como en combinación con otras terapias.
Fuente: Archivo
La aprobación de pembrolizumab es efectiva en los 28 países miembros de la Unión Europea (UE). En la Unión Europea KEYTRUDA en monoterapia está indicado en el tratamiento de melanoma avanzado (irresecable o metastásico) en adultos, también en monoterapia está indicado para el tratamiento del cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico en adultos cuyos tumores expresen PD-L1 con una TPS mayor o igual a 1% y que hayan recibido al menos un tratamiento de quimioterapia previo. Los pacientes con mutaciones positivas de EGFR o de ALK también deben haber recibido una terapia dirigida para estas alteraciones antes de recibir KEYTRUDA. Además, KEYTRUDA está indicado en monoterapia para el tratamiento de primera línea del cáncer de pulmón no microcítico (CPNM) metastásico en adultos cuyos tumores expresen PD-L1 con una proporción de marcador tumoral (TPS), ≥50% sin mutaciones tumorales positivas de EGFR o ALK. Pembrolizumab también está indicado en monoterapia para el tratamiento de pacientes adultos con linfoma de Hodgkin clásico (LHc) en recaída o refractario, que no han respondido a un trasplante autólogo de progenitores hematopoyéticos (TAPH) y a brentuximab vedotina (BV), o que no son candidatos a trasplante y no han respondido a BV.
En España están financiadas en el sistema público de salud las indicaciones, en monoterapia, de melanoma avanzado (irresecable o metastásico) en adultos y de cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico en adultos cuyos tumores expresen PD-L1 con una TPS ≥1% y que hayan recibido al menos un tratamiento de quimioterapia previo. Los pacientes con mutaciones tumorales positivas de EGFR o de ALK también deben haber recibido también terapia dirigida para estas alteraciones antes de recibir KEYTRUDA a la dosis recomendada de 2 mg/kg administrados por vía intravenosa durante 30 minutos cada tres semanas.
Pembrolizumab y los tumores sólidos tipo MSI-H o dMMR
Por otro lado, MSD ha anunciado la primera presentación de los hallazgos de los estudios KEYNOTE-164 y KEYNOTE-158, dos estudios fase 2 que evalúan KEYTRUDA® (pembrolizumab), el tratamiento anti-PD-1 de la compañía, en pacientes con tumores sólidos avanzados con inestabilidad de microsatélites alta (MSI-H) o deficiencia en la reparación del ADN (dMMR). Los estudios mostraron tasa de respuesta global (TRG), independientemente de la histología: con TRG- entre el 28% (IC del 95%, 17-41) y el 38% (IC del 95%, 27-49) en pacientes con cáncer colorrectal (CCR) MSI-H/dMMR y otros tumores sólidos avanzados con MSI-H/dMMR, respectivamente. Estos hallazgos se han presentado en ASCO 2017.
“Estos datos importantes se suman a las investigaciones hasta la fecha que muestran respuestas clínicamente importantes con pembrolizumab (KEYTRUDA) en monoterapia en una amplia variedad de tumores con MSI-H o dMMR en pacientes cuya enfermedad es localmente avanzada o metastásica”, dice el Dr. Luis A. Diaz, Jr., director de la división de oncología de tumores Sólidos del Memorial Sloan Kettering Cancer Center. “Además, estos datos confirman los hallazgos iniciales que hicimos demostrando el valor del estado de MSI-H o dMMR en el tumor como biomarcador predictivo para KEYTRUDA en estos cánceres de difícil tratamiento”.




