
Diandra Monfort Ferrè
Fuente: D. Monfort Ferrè
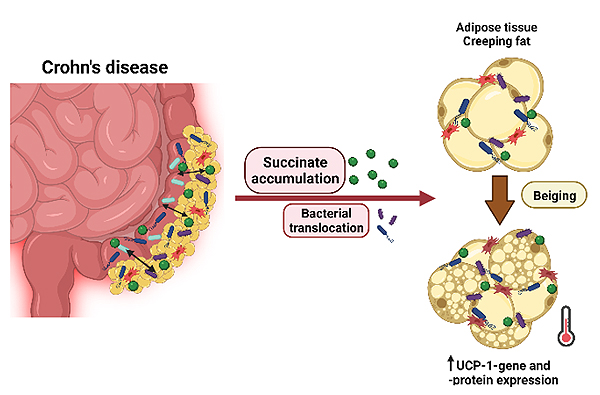
Un estudio con investigadores e investigadoras del Institut d’Investigació Sanitària Pere Virgili (IISPV), el Hospital Universitario Joan XXIII, el Hospital Vall d'Hebron, la URV, y CIBERDEM, ha descubierto una nueva característica relacionada con el tejido adiposo (también conocido como grasa corporal) de las personas que sufren enfermedad de Crohn que podría abrir nuevas vías para el seguimiento y tratamiento farmacológico de la enfermedad. Los grupos de investigación DIAMET e IBODI del IISPV, responsables de liderar este estudio, han encontrado que, en estos pacientes, en el tejido adiposo cerca de la zona inflamada del intestino (la parte que tienen más dañada) se produce una conversión de tejido adiposo blanco a tejido adiposo beige (conocido científicamente como “browning”).
En los humanos, existen tres tipos de tejido adiposo según su función, coloración, vascularización y estructura: tejido adiposo blanco, tejido adiposo pardo y tejido adiposo beige. En líneas generales, el tejido adiposo blanco sirve como depósito de energía; en cambio, el tejido adiposo pardo juega un papel esencial en el consumo o desgaste de energía con el fin de mantener la temperatura corporal. Finalmente, en ciertas ocasiones, el tejido adiposo blanco puede convertirse en tejido adiposo beige, adquiriendo características del tejido adiposo pardo. El aumento de tejido adiposo beige puede contribuir al incremento del gasto de energía, y mejorar los parámetros metabólicos y de tolerancia al frío.
El artículo científico The Gut Microbiota Metabolite Succinate Promotes Adipose Tissue Browning in Crohn’s Disease1 publicado en la revista internacional Journal of Crohn’s and Colitis ha revelado que las posibles causas de esta conversión del tejido adiposo blanco a tejido adiposo beige en los pacientes que padecen la enfermedad de Crohn están relacionadas con el aumento de un metabolito que producen las bacterias intestinales (la microbiota) llamado succinato. Este metabolito se acumula en el intestino de estos pacientes y produce un cambio metabólico en este tejido perilesional.
Al igual que sucede en otras afecciones inflamatorias como la obesidad o la diabetes de tipo 2, los pacientes con Crohn presentan un aumento de succinato circulante, que podría ayudar en el diagnóstico de la enfermedad. Existe también un segundo desencadenante de esta conversión a tejido adiposo beige, que es la presencia de ciertas bacterias en la grasa.
La enfermedad de Crohn es un trastorno crónico del tracto gastrointestinal caracterizado por una inflamación transmural con destrucción de la barrera intestinal y aumento de la permeabilidad intestinal. Estos pacientes también presentan una expansión del tejido adiposo mesentérico adherido a los segmentos inflamados del intestino, conocido como "grasa progresiva o creeping fat, en inglés". El creeping fat es un sello distintivo de la enfermedad de Crohn y parece estar directamente relacionado con la actividad de la enfermedad2,3. Dos estudios recientes, uno de ellos de nuestro grupo4,5, demuestran que ciertas bacterias intestinales escapan del intestino a través del "intestino permeable" hacia la grasa mesentérica, hecho que provoca el desarrollo de una elevada respuesta inflamatoria en el tejido adiposo creeping fat.
Extraído de 1
Se ha demostrado que el microbioma de pacientes con enfermedad de Crohn está alterado. Los cambios bacterianos más consistentes en la enfermedad de Crohn incluyen una diversidad de especies reducida, una mayor inestabilidad de la estructura de la microbiota intestinal, una menor abundancia de bacterias "protectoras" y una mayor abundancia de bacterias "dañinas"6,7. Además de las alteraciones en la composición de la microbiota, se reconoce cada vez más que los cambios en las funciones metabólicas de la microbiota tienen un impacto significativo en la fisiopatología de la enfermedad de Crohn. Uno de los metabolitos que vemos implicado en esta disbiosis es el metabolito succinato8.
En diferentes estudios se han visto niveles elevados de succinato en el intestino o circulantes en pacientes con enfermedad de Crohn9,10. En nuestro estudio determinamos que, en pacientes con la enfermedad activa de Crohn, los niveles de succinato estaban elevados en el tejido adiposo visceral (creeping fat). Esta acumulación en el tejido adiposo podría ser consecuencia de la disbiosis intestinal que tienen los enfermos de Crohn y también podría estar implicada en el aumento de succinato que vemos a nivel circulante en pacientes con enfermedad de Crohn activa.
Cabe destacar que, en los pacientes en remisión de la enfermedad, tanto en tejido como a nivel circulante, el succinato está disminuido comparado con los enfermos activos, teniendo unos niveles similares a los de los pacientes controles sanos. Por este motivo, consideramos que el succinato podría ser un marcador de actividad en la enfermedad de Crohn.
Por otra parte, se había descrito previamente que el metabolito succinato tiene la función de inducir “browning” en el tejido adiposo blanco. Concretamente, se había observado que el succinato produce una conversión del tejido adiposo blanco a tejido adiposo beige en ratones11. En este sentido, nuestros resultados han mostrado que el succinato aumenta los marcadores de Browning en las células precursoras del tejido adiposo visceral de los pacientes con enfermedad de Crohn. Específicamente, encontramos un aumento muy significativo de la proteína de desacoplamiento de la membrana mitocondrial interna 1 (UCP1) en tejido adiposo de pacientes con la enfermedad activa. En cambio, en los pacientes con remisión de la enfermedad de Crohn se observa una expresión menor de los marcadores de “browning” en comparación con la expresión en los enfermos activos de Crohn.
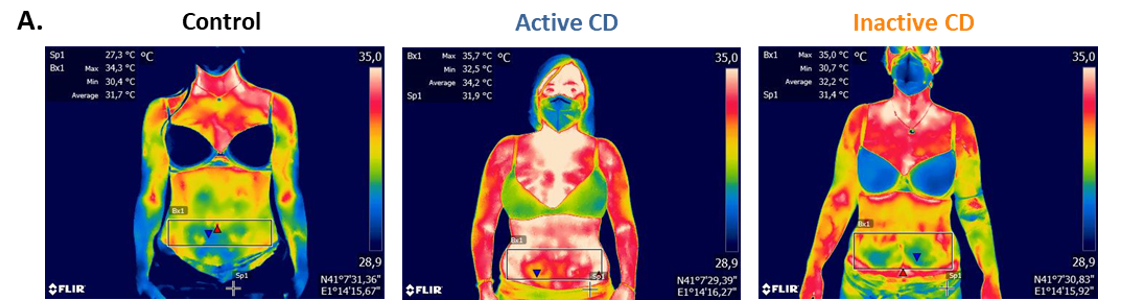
Una de las particularidades del tejido adiposo beige es la producción de calor, y esta característica la hemos observado utilizando una cámara termográfica, donde hemos podido observar un aumento de la temperatura abdominal en pacientes con enfermedad de Crohn activa. A continuación, se pueden contemplar unas imágenes térmicas en las que puede observarse un aumento de temperatura abdominal en pacientes con la enfermedad de Crohn activa. Los colores blanco y rojo indican una mayor temperatura, y los colores verde y azul una menor temperatura. En el caso de la paciente inactiva, se observa esta disminución de la temperatura abdominal acorde con la disminución de UCP1 y marcadores de “browning” que observamos en el creeping fat.
Extraído de 1
El aumento de la temperatura abdominal en pacientes con la enfermedad activa podría ser un indicador de una mayor presencia de este tejido adiposo beige, y por tanto un marcador de actividad inflamatoria de la enfermedad. Actualmente estamos realizando más estudios y aumentado el número de pacientes para confirmar estos datos preliminares en una cohorte más amplia, con el fin de ver si el uso de una cámara térmica puede ser útil como monitorización no invasiva de la enfermedad y/o para el seguimiento del tratamiento farmacológico en estas personas.
Bibliografía
1. Monfort-Ferré, D.; Caro, A.; Menacho, M.; Martí, M.; Espina, B.; Boronat-Toscano, A.; Nuñez-Roa, C.; Seco, J.; Bautista, M.; Espín, E.; et al. The Gut Microbiota Metabolite Succinate Promotes Adipose Tissue Browning in Crohn’s Disease. J Crohns Colitis 2022, 16, 1571–1583, doi:10.1093/ECCO-JCC/JJAC069.
2. Büning, C.; von Kraft, C.; Hermsdorf, M.; Gentz, E.; Wirth, E.K.; Valentini, L.; Haas, V. Visceral Adipose Tissue in Patients with Crohn’s Disease Correlates with Disease Activity, Inflammatory Markers, and Outcome. Inflamm Bowel Dis 2015, 21, 2590–2597, doi:10.1097/MIB.0000000000000527.
3. Connelly, T.M.; Juza, R.M.; Sangster, W.; Sehgal, R.; Tappouni, R.F.; Messaris, E. Volumetric Fat Ratio and Not Body Mass Index Is Predictive of Ileocolectomy Outcomes in Crohn’s Disease Patients. Dig Surg 2014, 31, 219–224, doi:10.1159/000365359.
4. Ha, C.W.Y.; Martin, A.; Sepich-Poore, G.D.; Shi, B.; Wang, Y.; Gouin, K.; Humphrey, G.; Sanders, K.; Ratnayake, Y.; Chan, K.S.L.; et al. Translocation of Viable Gut Microbiota to Mesenteric Adipose Drives Formation of Creeping Fat in Humans. Cell 2020, 183, 666-683.e17, doi:10.1016/j.cell.2020.09.009.
5. Serena, C.; Queipo-Ortuño, M.; Millan, M.; Sanchez-Alcoholado, L.; Caro, A.; Espina, B.; Menacho, M.; Bautista, M.; Monfort-Ferré, D.; Terrón-Puig, M.; et al. Microbial Signature in Adipose Tissue of Crohn’s Disease Patients. J Clin Med 2020, 9, 2448, doi:10.3390/jcm9082448.
6. Manichanh, C.; Borruel, N.; Casellas, F.; Guarner, F. The Gut Microbiota in IBD. Nat Rev Gastroenterol Hepatol 2012, 9, 599–608, doi:10.1038/nrgastro.2012.152.
7. Pascal, V.; Pozuelo, M.; Borruel, N.; Casellas, F.; Campos, D.; Santiago, A.; Martinez, X.; Varela, E.; Sarrabayrouse, G.; Machiels, K.; et al. A Microbial Signature for Crohn’s Disease. Gut 2017, 66, 813–822, doi:10.1136/gutjnl-2016-313235.
8. Fernández-Veledo, S.; Vendrell, J. Gut Microbiota-Derived Succinate: Friend or Foe in Human Metabolic Diseases? Rev Endocr Metab Disord 2019, 20, 439–447.
9. Macias-Ceja, D.C.; Ortiz-Masiá, D.; Salvador, P.; Gisbert-Ferrándiz, L.; Hernández, C.; Hausmann, M.; Rogler, G.; Esplugues, J. v; Hinojosa, J.; Alós, R.; et al. Succinate Receptor Mediates Intestinal Inflammation and Fibrosis. Mucosal Immunol 2019, 12, 178–187, doi:10.1038/s41385-018-0087-3.
10. Ortiz-Masiá, D.; Gisbert-Ferrándiz, L.; Bauset, C.; Coll, S.; Mamie, C.; Scharl, M.; Esplugues, J. v.; Alós, R.; Navarro, F.; Cosín-Roger, J.; et al. Succinate Activates EMT in Intestinal Epithelial Cells through SUCNR1: A Novel Protagonist in Fistula Development. Cells 2020, 9, 1104, doi:10.3390/cells9051104.
11. Mills, E.L.; Pierce, K.A.; Jedrychowski, M.P.; Garrity, R.; Winther, S.; Vidoni, S.; Yoneshiro, T.; Spinelli, J.B.; Lu, G.Z.; Kazak, L.; et al. Accumulation of Succinate Controls Activation of Adipose Tissue Thermogenesis. Nature 2018, 560, 102–106, doi:10.1038/s41586-018-0353-2.




