Redacción Farmacosalud.com
El Ministerio de Sanidad, Consumo y Bienestar Social español ha aprobado la financiación en el Sistema Nacional de Salud de Beovu® (brolucizumab) de Novartis, un tratamiento anti-VEGF de última generación para la degeneración macular asociada a la edad (DMAE) húmeda. Brolucizumab, que es el único anti-VEGF para el tratamiento de la DMAE húmeda, ofrece una resolución del fluido superior y mayor duración, con intervalos de dosificación de hasta tres meses inmediatamente después de la fase de carga1. Para los más de 20 millones de personas en todo el mundo que viven con DMAE húmeda, la frecuencia de las inyecciones es un motivo frecuente por el que los pacientes abandonan los tratamientos existentes2-4.
Fuente: Novartis
Brolucizumab es el único anti-VEFG que ha demostrado una resolución superior del fluido retiniano, un marcador clave de la actividad de la afección, frente a aflibercept5. Además, es el primer anti-VEGF que ofrece la capacidad de que los pacientes con DMAE húmeda sean tratados en un intervalo de dosificación de tres meses inmediatamente después de la fase de carga1, reduciendo así la frecuencia de la administración del tratamiento.
“La llegada de Beovu supone un paso hacia adelante en el control de la enfermedad”
“Actualmente, los intervalos de administración de la terapia no superan en la mayoría de los pacientes las 6-8 semanas. Poder disponer de fármacos que permitan alargar estos intervalos manteniendo durante más tiempo inactiva la enfermedad es una de las necesidades no cubiertas por los fármacos existentes. La llegada de Beovu supone un paso hacia adelante en el control de la enfermedad, la reducción de la carga asistencial y la adherencia al tratamiento”, explica la Dra. Maribel López, jefe de la Unidad de Retina del Servicio de Oftalmología del Hospital Clínico Universitario de Valladolid y Profª asociada en Ciencias de la Visión de la UVA.
El Dr. José Juan Escobar Barranco, jefe de Servicio de Oftalmología del Hospital Dos de Maig de Barcelona, subraya que "Beovu es un fármaco específicamente diseñado para ser más eficaz en el control de la DMAE neovascular y con una mayor durabilidad de efecto. De este modo, los pacientes tendrán mejores resultados en el control de la enfermedad con muchas menos intervenciones de inyección intravítrea ocular. Su desarrollo viene avalado por importantes ensayos clínicos, HAWK y HARRIER, que se iniciaron en julio del 2015 con más de mil pacientes a nivel mundial. España lideró la inclusión mundial de pacientes en el ensayo HARRIER, lo cual habla de la calidad a nivel de la investigación oftalmológica en nuestro país.”
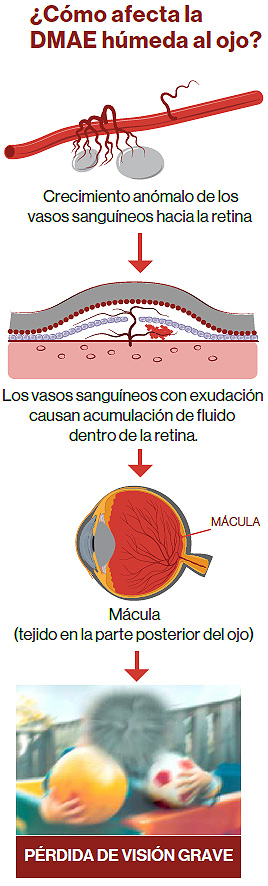
La DMAE afecta a más de 800.000 personas en España y es la principal causa de ceguera legal en personas mayores de 50 años6,7. La DMAE húmeda es una patyología ocular crónica y degenerativa que supone una de las principales causas de pérdida grave de visión y ceguera en personas mayores de 65 años y afecta a más de 20 millones de personas en todo el mundo3,4. Está causada por un exceso de VEGF (factor de crecimiento vascular endotelial), una proteína que promueve el crecimiento de vasos sanguíneos anómalos debajo de la mácula, la zona de la retina responsable de la visión aguda y central8.Los tratamientos anti-VEGF (factor de crecimiento vascular endotelial) bloquean la actividad de esta proteína. Estos tratamientos se administran de forma periódica mediante inyecciones intravítreas a los pacientes con DMAE húmeda para mantener la enfermedad bajo control.
Reducción de la frecuencia de las inyecciones
Beovu® (brolucizumab) es un tratamiento anti-VEGF que está diseñado para ofrecer la mayor concentración del fármaco, proporcionando más agentes vinculantes activos que otros anti-VEGF. De este modo, el nuevo medicamento ofrece a los pacientes con DMAE húmeda mayor resolución de fluido que otros anti-VEFG y similares ganancias visuales1,5. Además, brolucizumab da la posibilidad de establecer un intervalo de dosificación más largo -de hasta tres meses- en la mayoría de los pacientes1, reduciendo la frecuencia de las inyecciones, lo que ayuda a aliviar la carga asistencial y mejorar la calidad de vida quienes padecen este tipo de DMAE. Para los más de 20 millones de personas en todo el mundo que viven con DMAE húmeda, la frecuencia de las inyecciones es un motivo frecuente por el que abandonan los tratamientos existentes2-4. La falta de tratamiento o la pérdida de adherencia terapéutica repercute en un aumento de la acumulación de fluido y en el empeoramiento continuo de la patología9.
“El tratamiento con los anteriores fármacos pese a ser adecuado, tenía un grave déficit y es que en un alto porcentaje fracasaba por la falta adherencia final de los pacientes. La elevada carga asistencial y familiar que suponía tratar a más de la mitad de los pacientes en espacios de tiempo de cada 4, 6 u 8 semanas implicaba un abandono de la mitad de los pacientes antes de los 4 años del inicio de la DMAE neovascular, dando como resultado la pérdida del beneficio potencial. Con Beovu, además de un mayor control de la actividad, podemos tratar a los pacientes en regímenes de 8-12 semanas como mínimo. Y tenemos ensayos en los que se está evaluando la posibilidad de utilizar intervalos de hasta 16 e incluso 20 semanas”, destaca Escobar.
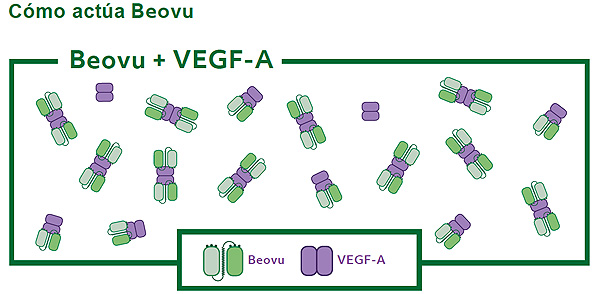
La molécula de Beovu se une al VEGF-A, lo que retrasa el crecimiento anómalo de los vasos sanguíneos y la pérdida de fluido
Beovu [prescribing information] East Hanover, NJ. Novartis: 2019
Dugel P, Koh A, Ogura Y, et al; HAWK and HARRIER Study Investigators. HAWK and HARRIER: Phase 3, multicenter, randomized, double-masked trials of brolucizumab for neovascular age-related macular degeneration. Ophthalmology. 2020;127(1):72-84
Difusión: Novartis
La aprobación de Beovu® (brolucizumab) para el tratamiento de la DMAE en Europa se basó en los resultados de los ensayos clínicos de fase III HAWK y HARRIER, en los que brolucizumab alcanzó el objetivo primario, demostrando ganancias en la mejor agudeza visual corregida (MAVC) no inferiores a aflibercept en el primer año (semana 48)1,5. Las ganancias de visión en el primer año se mantuvieron a lo largo del segundo año1,5.
Referencias
1. BEOVU [summary of product characteristics] Basel, Switzerland. Novartis: 2020.
2. Varano M, et al. Current barriers to treatment for wet age-related macular degeneration (wAMD): findings from the wAMD patient and caregiver survey. Clin Ophthalmol. 2015;9:2243–2250
3. Wong WL, Su X, Li X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and met analysis. Lancet Glob Health. 2014;2:106-16
4. Singer M. Advances in the management of macular degeneration. F1000Prime Rep. 2014;6:29.
5. Dugel P, Koh A, Ogura Y, et al; HAWK and HARRIER Study Investigators. HAWK and HARRIER: Phase 3, multicenter, randomized, double-masked trials of brolucizumab for neovascular age-related macular degeneration. Ophthalmology. 2020;127(1):72-84.
6. Prevention of Blindness and Visual Impairment. WHO website. from: http://www.who.int/blindness/causes/priority/en/. Retrieved April 2022.
7. Seattle), L., drusas, D., & Tomography, D. (2019). Degeneración Macular Asociada a la Edad (DMAE) | Barcelona Macula Foundation: Research for Vision. from https://barcelonamaculafound.org/es/patologias/dmae-degeneracion-macular... Retrieved April 2022.
8. Qazi Y, et al. Mediators of ocular angiogenesis. J. Genet. 2009;88(4):495-515.
9. Holz FG, Schmitz-Valckenberg S, and Fleckenstein M. Recent developments in the treatment of age-related macular degeneration. J Clin Invest. 2014;124:1430-8.




