Introducción
El cáncer de próstata es uno de los tumores más frecuentes en los hombres, ya que uno de cada 6 hombres lo presentará en algún momento de su vida, si bien sólo uno de cada 30 morirá por este tumor. En España es la tercera causa de muerte por tumor en los hombres tras el cáncer de pulmón y el colorrectal1. El cáncer de próstata es una enfermedad muy heterogénea, dado que existen tumores poco agresivos que no llegarán a afectar la expectativa de vida de los sujetos que lo padecen, mientras que en otros casos habrá tumores muy agresivos que desarrollarán metástasis que causarán la muerte del paciente2.
El tacto rectal y el PSA presentan limitaciones destacables en la detección del tumor maligno prostático. El tacto rectal presenta una baja sensibilidad, ya que un porcentaje importante de tumores no son palpables. En un estudio de meta-análisis, el valor predictivo positivo del tacto rectal para detectar cáncer era muy bajo (5-30%), por lo que no se recomienda su utilización de forma aislada3. Sin embargo, la detección de un tacto rectal anormal es indicativo de realizar una biopsia de próstata.

Dr. Gilberto Chéchile
Fuente: Dr. Chéchile
Las limitaciones del PSA radican en que es un marcador de próstata específico y no cáncer-específico, por lo puede elevarse por cualquier patología prostática (prostatitis, hiperplasia benigna)4. Por otro lado, si establecemos el nivel de corte de PSA en 4 ng/ml se pueden perder cánceres significativos, en tanto que los tumores poco diferenciados no elevan el PSA. La Asociación Americana de Urología recomienda que no se realicen determinaciones de PSA en hombres menores de 40 años, hombres mayores de 70 años o con una expectativa de vida inferior a 10-15 años5,6.
La biopsia transrectal ecoguiada es el procedimiento recomendado en las guías clínicas para el diagnóstico del cáncer de próstata. Sin embargo, es una técnica que presenta una serie de limitaciones, ya que, en el 40% de los casos en los que se detecta un tumor de bajo grado en la biopsia, al realizar la cirugía se observa que los tumores son de alto grado7. Otra limitación es que se detectan muchos tumores de bajo grado (Gleason 6) que no generan riesgo para el paciente, pero que si se tratan pueden producir efectos secundarios (disfunción eréctil, incontinencia de orina)8. Además, si el tumor está localizado en la región anterior de la próstata no se puede alcanzar con la biopsia ecoguiada por vía transrectal, por lo que podrían quedar sin diagnosticar tumores clínicamente significativos.
La importancia del problema radica en que el cáncer de próstata es muy prevalente: un 27% en la tercera década de la vida y un 85% en los hombres mayores de 80 años. La baja especificidad del PSA implica que el 60% de los casos con PSA mayor de 4 nanogramos por mililitro tendrán biopsia negativa. Como en Europa se realizan cada año más de 1.000.000 de biopsias de próstata, y como solo se detectará cáncer en un 25% de ellas, todo eso significa que cada año se realizan más de 750.000 biopsias innecesarias, lo que aumenta muy significativamente los costes sanitarios9,10. Por otro lado, el diagnóstico de tumores poco agresivos lleva al sobretratamiento de estos casos con la consiguiente aparición de efectos secundarios que disminuirán la calidad de vida de los pacientes. En los últimos años, las guías clínicas de la Asociación Europea de Urología recomiendan seguimiento activo en los casos con tumores de bajo riesgo11.
Recientemente se ha publicado un estudio en el que se comparan los resultados de seguimiento activo, radioterapia o cirugía en pacientes con cáncer de próstata localizado y detectado por elevación del PSA. La mortalidad por cáncer fue baja y no existieron diferencias entre los tres grupos. Sin embargo, en los casos con seguimiento activo se observó mayor progresión del cáncer y más incidencia de metástasis que en los casos tratados con cirugía o radioterapia12.
Para identificar con seguridad los casos que requieren tratamiento necesitamos mejorar la detección y localización de cánceres significativos y poder realizar biopsias dirigidas a las lesiones sospechosas de malignidad detectadas en la resonancia magnética.
Resonancia magnética multiparamétrica (RM)
En la última década se han producido importantes avances en las técnicas de diagnóstico por imagen en el ámbito del cáncer de próstata, especialmente con la introducción de la RM multiparamétrica13. Esta técnica permite combinar información morfológica y funcional al mismo tiempo mediante la aplicación de secuencias como la difusión del agua y la inyección endovenosa de contraste14.
Imagen Anatómica. La secuencia T2 brinda información anatómica de la próstata, permitiendo la distinción entre las distintas zonas de dicha glándula. Esta secuencia nos permite valorar los contornos de la próstata y las bandeletas neuro-vasculares, por lo que además de localizar las zonas con alteraciones morfológicas, nos permite valorar la potencial extensión fuera de la glándula (Figuras 1 y 2)15.
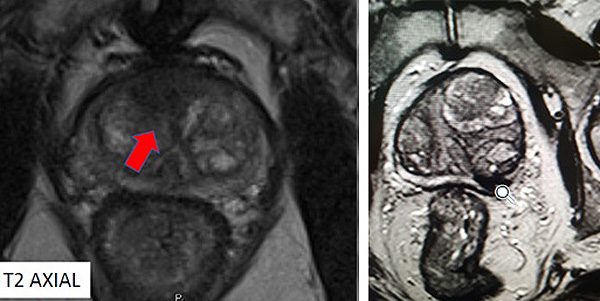
Figura 1 (a la izq. y flecha roja). RM secuencia T2. Lesión de zona de transición derecha
Figura 2 (a la dcha). RM secuencia T2. Lesión en zona periférica izquierda
Difusión: Dr. Chéchile
No obstante, este estudio anatómico posee una baja especificidad, de manera que es imprescindible obtener otros tipos de imágenes funcionales que permitan establecer con mayor seguridad la sospecha de cáncer, diferenciándolo de algunas patologías benignas como las prostatitis o la hiperplasia benigna. La secuencia T1 no puede ser utilizada para estudiar el interior de la próstata. Si se utiliza la secuencia T1 junto con la secuencia T2 es útil para detectar la hemorragia producida por una biopsia previa16. La secuencia T1 se utiliza para detectar ganglios patológicos o metástasis en la pelvis. (Figura 3).
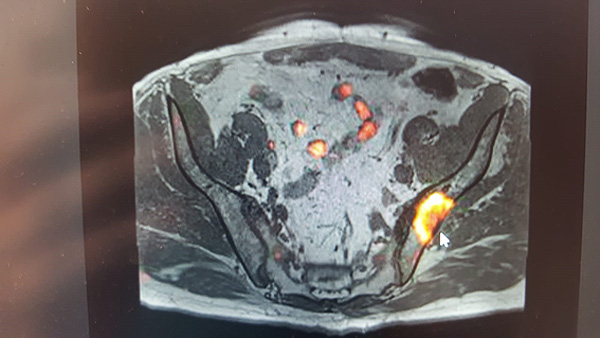
Figura 3. RM secuencia T1. Metástasis en hueso ilíaco izquierdo (flecha)
Difusión: Dr. Chéchile
Imagen de Difusión del agua (DWI). El agua se mueve más libremente en el tejido prostático normal que en el tejido tumoral, que es más denso.
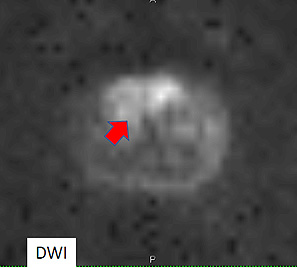
Figura 4. RM Secuencia de difusión de agua por cáncer de próstata en zona de transición derecha (flecha)
Difusión: Dr. Chéchile
Al aumentar la agresividad del tumor aumenta la restricción del movimiento del agua17 (Figura 4).
Estudio dinámico con contraste. Se realiza tras la inyección endovenosa de gadolinio y se valora la captación y la eliminación del contraste.
El cáncer de próstata presenta un aumento de la vascularización, lo que se traduce en una mayor captación del contraste durante el primer minuto con eliminación precoz del mismo18 (Figura 5).
Dentro de las limitaciones de la resonancia magnética destacan:
a- no detecta lesiones menores de 5 mm
b- detecta con dificultad tumores de Gleason bajo
c- no detecta entre un 5 y un 15 por ciento de los cánceres clínicamente significativos
d- puede detectar tumores clínicamente no significativos
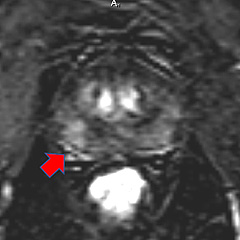
Figura 5. RM con inyección de contraste. Aumento de la captación en zona periférica derecha (flecha)
Difusión: Dr. Chéchile
e- no detecta la variante patológica cribiforme, ya que no restringe el movimiento del agua
f- la experiencia del radiólogo que informa19,20.
Biopsia de próstata transrectal ecoguiada
Hasta hace poco tiempo, el despistaje del cáncer de próstata se basaba casi exclusivamente en el tacto rectal (detección de nódulo duro) y el aumento del nivel del PSA (antígeno prostático específico) por encima de 4 ng/ml. Sin embargo, ambos parámetros poseen claras limitaciones: por una parte, el tacto rectal es poco sensible y omite la detección de un altísimo porcentaje de tumores, y por otra el PSA puede encontrarse en rangos normales en tumores agresivos y hallarse elevado en patologías benignas como la prostatitis o la hiperplasia benigna. De este modo, cuando el urólogo detectaba criterios de sospecha de carcinoma prostático indicaba una biopsia sistemática por vía transrectal guiada por vía transrectal. Lamentablemente, este tipo de biopsia tiene una elevada tasa de falsos negativos, dado que en un 75% de los casos será negativa.
La biopsia sistemática ecoguiada toma entre 8 y 12 muestras de tejido prostático (de 4 a 6 muestras de cada lóbulo de la próstata) y, aunque sea guiada por ecografía, se consideran biopsias ‘a ciegas’, puesto que la ecografía únicamente nos ofrece una imagen anatómica, es decir, las zonas y la forma de la próstata, pero no detecta los tejidos tumorales. Debido al alto porcentaje de falsos negativos después de una biopsia de próstata en la que no se ha encontrado tejido tumoral, no podemos estar seguros de estar libres de cáncer. En ocasiones, al repetir la analítica el PSA continúa aumentando. No significa que la biopsia anterior esté mal hecha, sino que el tumor puede estar localizado en una zona de difícil acceso o que dentro de las 8 o 12 punciones no se ha accedido al tumor o no se ha conseguido material suficiente.
Esto nos obligaría a repetir la biopsia ecoguiada sistemática, en la que a veces se dobla el número de toma de muestras. A más biopsias y mayor número de muestras, existe mayor riesgo de sangrado y de infección.
Biopsia por vía transperineal con gradilla (técnica de braquiterapia)
Presenta como ventajas: 1- menor incidencia de infecciones que la biopsia transrectal con un porcentaje de sepsis muy cercano al 0%; 2- permite acceder a toda la próstata, cosa imposible de lograr con la biopsia transrectal; 3- permite acceder a las lesiones de zona anterior, ápex y base de próstata que se identifican con la RMNmp21 (Figura 6).
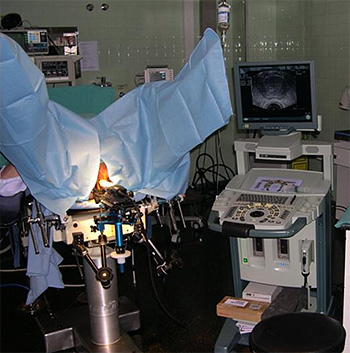
Figura 6. Biopsia de próstata transperineal con técnica de braquiterapia. Ecógrafo biplano BK Profocus y sistema de fijación de sonda ecográfica Brachy strand
Difusión: Dr. Chéchile
La biopsia transperineal con gradilla encontró cáncer en el 55,5% de los casos que tenían una biopsia previa negativa, en un 42% de los casos con 2 biopsias previas negativas, y en un 34% de los casos con 3 biopsias previas negativas22.
Papel de la RM en la biopsia de próstata
Los resultados de la RM se han unificado en un sistema denominado PIRADS (Prostate Imaging Reporting and Data System), que se actualizó en 2015 (PIRADS v2)23 y en 2019 (PIRADS v2.1)24. En la versión v2.1 la inyección de contraste pasa a tener un papel secundario frente a la secuencia T2 y a la difusión del agua (DW). Las lesiones PIRADS 4 y 5 presentan una alta o muy alta probabilidad de contener un cáncer clínicamente significativo, por lo que deberían ser biopsiadas, mientras que las lesiones PIRADS 1 y 2 tienen muy baja o baja probabilidad de contener cáncer. Las lesiones PIRADS 3 se consideran equívocas, por lo que las decisiones clínicas se deben tomar utilizando otros parámetros (cinética de PSA, densidad de PSA, marcadores biomoleculares, etc.). La probabilidad de cáncer significativo (Gleason ≥ 7) es del 3-12% en las lesiones PIRADS 1 y 2; del 4-27% en las PIRADS 3; del 32-60% en las PIRADS 4 y del 67-83% en las lesiones PIRADS 525.
Las biopsias de próstata utilizando el soporte de la RM ofrecen beneficios sobre las biopsias ecoguiadas convencionales, ya que permiten obtener muestras de las lesiones sospechosas detectadas (PIRADS 4 y 5). Existen 3 formas de realizar biopsias de próstata apoyadas por la RM: a- guía directa por RM en el interior del aparato (in bore); b- biopsia con fusión cognitiva en la que se punciona intentado alcanzar con una visión ecográfica la misma zona visualizada en la RM; c- biopsias por fusión de imágenes entre RM y ecografía26. La fusión cognitiva es rápida y no requiere otros equipos, aunque tiene la desventaja del potencial error humano al extrapolar las imágenes o al intentar biopsiar lesiones de pequeño tamaño27.
Los resultados de la biopsia directa ‘in bore’ son superiores frente a los de la biopsia ecoguiada ‘a ciegas’ en la detección de cáncer. Sin embargo, es un procedimiento engorroso y caro (por el tiempo de RM requerido) que se realiza por vía transrectal o transperineal y además se toman pocas muestras de la lesión sospechosa sin posibilidad de realizar además una biopsia sistemática de la próstata28.
En un estudio en el que se compararon los tres métodos de biopsia de próstata apoyados por la RM, se observó que los resultados de la biopsia ‘in gantri’ y los de la biopsia por fusión de imágenes son similares. Por el contrario, la biopsia cognitiva detectaba menor proporción de cánceres de próstata significativos que la biopsia ‘in gantri’ y la biopsia por fusión de imágenes29.
El estudio PROMIS comparó los resultados de la biopsia ecoguiada con gradilla y la biopsia apoyada con RM y mostró que la biopsia ecoguiada no detectaba el 37% de los cánceres significativos (Gleason ≥3+4), mientras que la biopsia apoyada con RM evitaba la biopsia en un 27% de los hombres con PSA elevado30. En 2018 se publicó el estudio PRECISION, en el que 500 hombres con PSA elevado se aleatorizaron en 2 grupos: uno fue biopsiado con gradilla y en otro la biopsia se realizó guiada con RM sólo si había zonas sospechosas. La biopsia con RM detectó cáncer de próstata significativo en un 38% de los casos y se evitó un 28% de biopsias innecesarias. En el otro grupo se les realizó biopsia a todos los casos y sólo un 26% mostraron cáncer significativo31.

Fuente: Startup Stock Photos Source: startupstockphotos.com
Pexels (Creative Commons)
En un estudio de meta-análisis se confirmó que la biopsia de próstata apoyada con RM (cognitiva, in bore y por fusión de imágenes) es superior a la biopsia sistemática ecoguiada para aumentar la detección de cánceres significativos y para disminuir la detección de cánceres no significativos con una sensibilidad y especificidad del 72% y 96%, respectivamente32. En el estudio prospectivo FUTURE se compararon las 3 técnicas para realizar biopsia de próstata apoyada por RM (cognitiva, in bore y fusión de imágenes RM-ECO) en hombres con biopsia previa negativa y con sospecha persistente de cáncer de próstata. No se observaron diferencias en la detección de cáncer de próstata clínicamente significativo entre las 3 técnicas33.
En la última edición de las guías clínicas de la Asociación Europea de Urología se recomienda realizar RM multiparamétrica (RMmp) antes de realizar biopsia de próstata en pacientes con PSA elevado34. Casi todos los estudios descritos hasta el momento incluían la inyección de contraste para obtener imágenes de RM; sin embargo, su utilidad es limitada, puesto que sólo ayuda en la versión 2 de PIRADS a que un 20% de los casos, generalmente PIRADS 3 de zona periférica, pasen a ser catalogados como PIRADS 435.
La RM biparamétrica (sin inyección de contraste) (RMbp) es más rápida (15-20 minutos) y más barata que la RMmp. En lo que respecta a los resultados, el valor predictivo negativo es del 95% y la sensibilidad del 97%. En otro estudio se observó que el área bajo la curva (AUC) para el diagnóstico de cáncer de próstata clínicamente significativo fue similar en la RMbp (0,781), y (0,779) en la RMmp. La seguridad, sensibilidad, especificidad, valor predictivo positivo y negativo para cáncer clínicamente significativo de la RMbp fue del 74%, 84%, 66,9%, 64,8% y 85%, respectivamente, y del 73,6%, 87,9%, 63,2%, 63,2% y 87,8%, respectivamente, para la RMmp36.

Autor/a: John Moeses Bauan
Fuente: unsplash.com (free photo)
En los casos en los que el PSA continúa elevándose pese a que tienen una RM negativa, debemos introducir otros parámetros para valorar la necesidad de realizar una biopsia de próstata. En estudios recientes se ha utilizado la densidad de PSA (PSAD) (PSA total dividido volumen prostático) y se ha observado que una combinación de RMmp y PSAD puede reducir el número de biopsias realizadas con el coste de no detectar un 3,7% de cánceres clínicamente significativos37. La asociación de lesión PIRADS <3 y PSAD <0,2 ng/ml2 fue el criterio más seguro para evitar una biopsia.
En otro trabajo, de los casos con RM negativa, un 18% presentaron cáncer significativo al repetir la biopsia, mientras que en los casos que asociaban RM negativa y PSAD menor de 0,15 presentaron cáncer un 10% de los casos al repetir la biopsia. En los casos que presentaban RM negativa, PSAD menor de 0,15 ng/ml2 y biopsia previa negativa, ningún caso presentó cáncer de próstata significativo al repetir la biopsia38.
Biopsia de próstata por fusión de imágenes
Consiste en la integración a través de diferentes plataformas de las imágenes obtenidas con RM y la ecografía para mejorar la seguridad de la biopsia de próstata dirigiendo las punciones a las lesiones observadas.
Las ventajas de la biopsia por fusión de imágenes son: a- superioridad frente a la biopsia eco guiada transrectal clásica, ya que combina la detección de lesiones por la RMmp con las ventajas de la ecografía transrectal en tiempo real; b- la movilización del transductor permite alcanzar todas las lesiones; c- puede utilizarse tanto la vía transrectal como la transperineal dependiendo de la localización; d- permite realizar biopsias guiadas y biopsias sistemáticas, con lo que se reduce la posibilidad de no detectar tumores clínicamente significativos o errores por la curva de aprendizaje. El éxito de la técnica dependerá de la plataforma utilizada y de la experiencia del radiólogo y del urólogo.
Las desventajas de este tipo de biopsia son el coste del equipo necesario para realizarla y la experiencia que debe tener el operador. Se ha demostrado que con este tipo de biopsia se detectan más tumores clínicamente significativos que con la biopsia ecoguiada convencional (64% frente al 18-35%), pero un menor porcentaje de cánceres no significativos39,40.
En un estudio de meta-análisis publicado recientemente se analizaron 7 ensayos clínicos con un total de 2.582 pacientes y se compararon los resultados de biopsia de próstata ecoguiada y de biopsia con RM41. La utilización de RM mejoró en un 57% el diagnóstico de cáncer de próstata clínicamente significativo, el número de biopsias realizadas se disminuyó en un 33% y el número de muestras obtenidas por procedimiento se redujeron en un 77%. Además, se observó que asociar biopsia sistemática, además de las guiadas por RMN, no mejoraba significativamente la detección de cánceres clínicamente significativos.
Indicaciones de la biopsia por fusión de imágenes
1- Biopsia previa negativa, elevación del PSA y RMN con lesión PIRADS 4-5 en zona periférica.
2- PCA3 >35 y RMN con lesión PIRADS 4-5 en zona periférica (acceso transrectal) o zona de transición o zona anterior (acceso transperineal).
3- Elevación del PSA y RMN con lesión PIRADS 4-5 en zona transicional anterior (acceso transperineal).
4- No realizar biopsia por fusión de imágenes en pacientes con RMN con lesiones PIRADS ≤3.

Autor/a: NEC Corporation of America (with Creative Commons license)
Fuente: Flickr / Creative Commons
Sistemas disponibles para la biopsia de próstata por fusión de imágenes
Existen varios sistemas para realizar biopsias por fusión de imagen. Los más utilizados son Artemis y Uronav, desarrollados en Estados Unidos, y Urostation, creado en Francia. De los 3 sistemas, Artemis es el que presenta mayor precisión biópsica en humanos con 1,2 ±± 1,1 milímetros (rango 0,2-5 mm), independientemente del volumen de la próstata y de la localización de la lesión42.
Uronav fue desarrollado con la colaboración de Philips Healthcare y el Instituto Nacional de Salud de USA. Utiliza una guía electromagnética para llegar a las lesiones detectadas con la RM y las biopsias se pueden realizar por vía transrectal o transperineal, aunque esta última ha ganado más adeptos. El sistema UroNav tiene un bajo índice de falsos negativos y detecta un 30% más de cánceres de alto riesgo que la biopsia transrectal convencional43.
Urostation es un sistema desarrollado en Francia que cuenta con un sistema doble de ecografía y RM 3D que permite al urólogo mover el transductor ecográfico para llegar a la zona a biopsiar44. En un estudio con un modelo de fantoma con lesiones hipo ecoicas conocidas visibles con RM, se observó que el 84% de las punciones alcanzaron la lesión45.
Otros dispositivos para la biopsia por fusión son Hitachi, Biopsee (MedCom), Virtual Navigator (Esaote), Biojet (GeoScan), Mona Lisa (Biopat Surgical) y LOgiq 9 (Healthecare).
Biopsia de próstata robótica por fusión de imágenes con el sistema Artemis
Artemis ® (Eigen) es uno de los sistemas más utilizados en el mundo para realizar biopsias por fusión de imágenes. Incorpora un programa de fusión (ProFuse®) elástica que convierte las imágenes 2D de la RM en una imagen 3D que se sobre-impone a las imágenes de la ecografía transrectal (Figura 7).
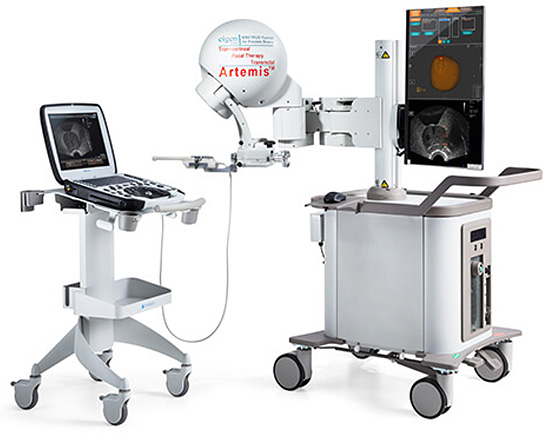
Figura 7. Sistema Artemis®
Difusión: Dr. Chéchile
El transductor ecográfico transrectal se acopla a un brazo articulado que posee sensores de ángulo que rastrean la posición de la aguja. Esto permite movimientos en tiempo real del transductor ecográfico para sincronizarlo con la imagen de la RM. Varios estudios han validado la utilidad del sistema Artemis para detectar cáncer de próstata significativo. En un estudio en el que pacientes con cáncer de próstata Gleason 3+3 fueron diagnosticados con biopsia transrectal ecoguiada convencional, la biopsia por fusión de imágenes con Artemis mostró que el 25% de los casos tenían grado de Gleason superior46. En un trabajo prospectivo con individuos con PSA elevado y biopsias previas negativas, la biopsia con el sistema Artemis detectó cáncer clínicamente significativo en un 32% de los casos, mientras que la biopsia convencional ecoguiada lo detectó en un 20% de los casos47. En otro estudio que comparó los resultados de biopsia con sistema Artemis con la biopsia ecoguiada, la detección de cáncer significativo fue del 91% y 54%, respectivamente48.
Al igual que en cualquier cambio tecnológico, la utilización del sistema Artemis requiere una curva de aprendizaje para obtener los mejores resultados. En un trabajo realizado en 173 pacientes biopsiados con el sistema Artemis, se calculó la fiabilidad de la biopsia calculando la distancia entre la trayectoria planeada y la realizada, almacenada en el sistema. Se observó un aumento significativo en la seguridad de la biopsia tras los primeros 98 casos realizados, lo que significa que la curva de aprendizaje es considerable49. El porcentaje de cilindros sin tejido prostático descendió del 18% al 3,3%.
En un estudio que analizó prospectivamente los resultados de 1.813 biopsias de próstata por fusión de imágenes durante un período de 4 años, se observó que la detección de cáncer significativo aumentó un 26% en los casos con lesiones PIRADS 4 y 5 en las biopsias realizadas en el último período, frente a las que se realizaron al inicio del estudio50.
Las ventajas que presenta el sistema Artemis son: a- mayor detección de cánceres significativos que la biopsia ecoguiada; b- realiza imágenes de la próstata en 3D; c- permite la fusión elástica y rígida de las imágenes; d- la planificación de las zonas a biopsiar es prospectiva; e- presenta un sistema de compensación de los movimientos del paciente y realiza el seguimiento mecánico de la aguja.
Características técnicas del sistema Artemis
El sistema Artemis consta de un brazo semirobotizado al que se aplica la sonda ecográfica transrectal y una guía para pasar la aguja de biopsia (Figura 8). Las zonas de interés (ZDI) identificadas en la RMN son transferidas al sistema y se sobre-imponen a las imágenes ecográficas en tiempo real (fusión elástica). Al mover el transductor ecográfico, el sistema Artemis detecta la dirección y la trayectoria del mismo y alinea la próstata. Cuenta además con un estabilizador para compensar los movimientos del paciente. El sistema permite el acceso transrectal o transperineal dependiendo de la localización de la lesión. Al ser mecánica la movilización del transductor, la aguja se visualiza en cualquiera de las orientaciones, por lo que se registra el trayecto de la punción y se guarda en un modelo tridimensional de la próstata por si fuera necesario en biopsias futuras.
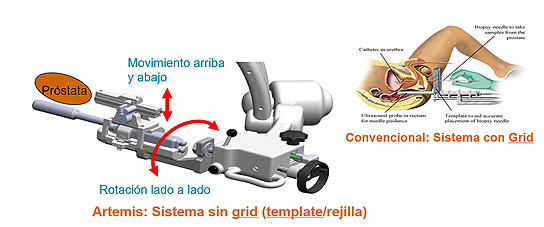
Figura 8. Brazo semirobotizado del sistema Artemis que permite la punción por vía transrectal o transperineal con o sin gradilla
Difusión: Dr. Chéchile
El sistema Artemis determina y almacena la longitud de cada punción, con lo que se puede conocer el tamaño del tumor detectado para las futuras biopsias durante el seguimiento de pacientes en vigilancia activa (Figura 9). También puede ser utilizado para realizar tratamientos focales (ablación parcial de próstata).
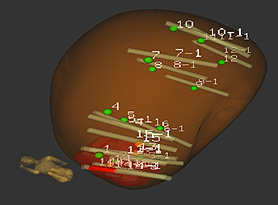
Figura 9. Trayecto de las biopsias almacenado en el sistema para biopsias futuras
Difusión: Dr. Chéchile
Para optimizar los resultados de la biopsia con Artemis debemos asegurar el posicionamiento correcto del paciente, con lo que se asegura la movilidad del brazo robótico para acceder a todas las zonas de la próstata. El centraje ecográfico de la próstata se debe realizar en el plano axial en la imagen más grande; además, el brazo debe mantener una posición neutral para permitir el desplazamiento por todas las zonas de la próstata. Se debe seguir la aguja en la ecografía en tiempo real. Se obtienen entre 2 y 5 punciones de la zona sospechosa dependiendo del tamaño de la misma. La plataforma es compleja y requiere mucho entrenamiento, pero los resultados son excelentes.
Técnica de biopsia robótica por fusión de imágenes con el sistema Artemis
Utilizando las imágenes en T2 obtenidas, el radiólogo contornea de forma semiautomática y manualmente el contorno de la próstata. Se marcan las zonas de interés en las imágenes con el diámetro más grande de la lesión para posteriormente segmentarlas del resto de las imágenes y transferirlas al sistema localizado en el sitio donde se realizará la biopsia. La identificación de las lesiones en la RM requiere que el radiólogo tenga mucha experiencia. En la biopsia por fusión de imágenes se combinan las ventajas de la RM con las ventajas de la ecografía en tiempo real para realizar las punciones utilizando un programa informático (Eigen ProFuse®). La colocación de una sonda en la vejiga facilita la identificación de la uretra. Se introduce el transductor ecográfico en el recto y se fija al brazo del Artemis. El operador realiza un barrido de la próstata en el plano axial que se incorpora al sistema Artemis. La fusión de las imágenes de la RM y de la ecografía transrectal se realiza de forma rígida. Sin embargo, el sistema Artemis ofrece la posibilidad de realizar una fusión elástica, con la que el operador que realizará la biopsia adapta las imágenes de la RMN a las imágenes ecográficas visualizadas en tiempo real (Figura 10). La fusión elástica compensa la posible deformación de la próstata producida por la introducción del transductor ecográfico en el recto y mejora los resultados de la fusión rígida.
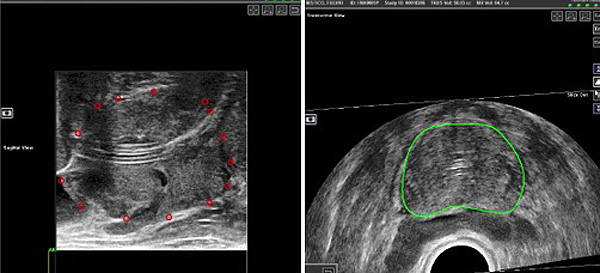
Figura 10. Fusión elástica de las imágenes
Difusión: Dr. Chéchile
Se visualizan las imágenes fusionadas desde la base hasta el ápex en el plano axial y sagital para ajustar los contornos, con lo que se asegura una correcta fusión y se consta que los volúmenes prostáticos de la RM y la ecografía coinciden.
La información de la RM con las lesiones sospechosas y 6 sitios de cada lóbulo prostático generados por el sistema se cargan en el modelo 3D. Teniendo en cuenta que la seguridad media de la biopsia en el sistema Artemis es de 1,2 ±1,1 mm, para maximizar la seguridad las biopsias de las zonas sospechosas deben realizarse cada 3 mm42 (Figura 11).
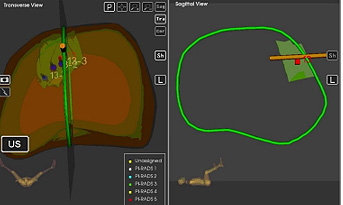
Figura 11. Visualización esquemática de las biopsias en una zona sospechosa
Difusión: Dr. Chéchile
El sistema permite compensar los movimientos del paciente y en cualquier momento se puede detener el procedimiento y volver a adquirir las imágenes ecográficas. Las punciones se realizan siguiendo en tiempo real el trayecto de la aguja marcado por Artemis hasta la zona de interés (Figura 12).
Dependiendo del tamaño de la zona sospechosa, se toman de 3 a 5 cilindros de cada una de las zonas que se numeran correlativamente como 13, 14 o 15.
Artemis permite registrar y guardar los sitios de las biopsias permitiendo volver a biopsiar la misma lesión en un futuro, por ejemplo en los casos en que se está realizando seguimiento activo de un cáncer diagnosticado previamente.
Las muestras obtenidas de las zonas sospechosas de la RM se numeran como 13, 14, 15, etc. y las biopsias sistemáticas como de 1 a 6 las del lóbulo izquierdo, y de 7 a 12 las del derecho. El patólogo realiza el informe siguiendo el mismo orden.
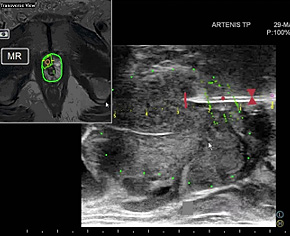
Figura 12. Imagen izquierda: zona sospechosa en región anterior de la próstata. Imagen derecha: visualización de la aguja entrando en la zona sospechosa en tiempo real
Difusión: Dr. Chéchile
Tras la biopsia de todas las zonas de interés se realiza la biopsia sistemática de ambos lóbulos prostáticos, ya que hasta un 16% de los casos con RM negativa puede tener cáncer clínicamente significativo51. El sistema Artemis genera automáticamente 6 sitios de biopsia sistemática en cada lóbulo prostático, distribuidos para cubrir todo el lóbulo correspondiente (Figura 13). Estos sitios no tienen en cuenta la localización de las zonas sospechosas, por lo que puede haber solapamiento. La media de sitios de punción sistemática solapados con zonas sospechosas es de dos52.
Recientemente se ha cuestionado la realización de biopsia sistemática en los pacientes sometidos a una biopsia por fusión de imágenes, dado que el porcentaje de casos en los que se eleva el grado del tumor con la biopsia sistemática es bajo (4,1%-6,2%)39,52.
Sin embargo, otros estudios sostienen la necesidad de asociar biopsias sistemáticas convencionales y biopsia por fusión de imagen, ya que se aumenta hasta un 16% el número de cánceres significativos53.
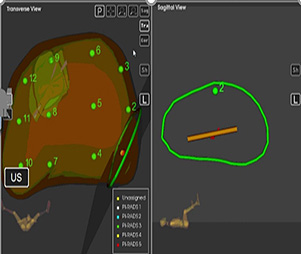
Figura 13. Imagen Izquierda: propuesta de sitios de punción sistemática generada por Artemis. De 1 a 6 en lóbulo derecho y de 7 a 12 en lóbulo derecho. Imagen Derecha: seguimiento en plano sagital de la punción del sitio 1 de la sistemática (lóbulo izquierdo)
Difusión: Dr. Chéchile
El descenso de la sensibilidad de la RM para detectar tumores de pequeño tamaño y la imposibilidad de detectar tumores con variante patológica cribiforme pueden explicar por qué las biopsias con fusión de imágenes no detectan todas las lesiones de alto grado.
Resultados del Instituto Médico Tecnológico
Entre abril de 2018 y mayo de 2019 realizamos biopsia de próstata con el sistema Artemis en 50 casos. La RM se realizó con un resonador 3 Tesla Siemens Verio y se tomaron imágenes en las secuencias anatómicas T1 y T2, difusión del agua e inyección de contraste. Las secuencias se analizaron con la versión 2.1 del sistema PIRADS. La edad media fue de 69 años. El tacto rectal fue normal en el 96% de los casos, mientras que en un 4% existía un nódulo en un lóbulo prostático. En un 36% de los casos se había realizado una biopsia de próstata previamente. La biopsia no había detectado tumor en el 50% de los casos, mientras que se había observado PIN o ASAP (atipical small acinar proliferation) y cáncer en el 33% y 17% de los casos, respectivamente. El PSA medio fue de 10,5 ng/ml.
La RM evidenció lesión PIRADS 1-2 en un caso, PIRADS 3 en 11 casos, PIRADS 4 en 25 casos y PIRADS 5 en 6 casos, PIRADS 3 y 4 en 5 casos y PIRADS 4 y 5 en un caso. La biopsia por fusión de imágenes RM/ecografía se realizó con el sistema Artemis con anestesia general en posición de decúbito lateral o supino según el abordaje fuera transrectal o transperineal, respectivamente. La ecografía transrectal se realizó con un Hitachi Aloka Noblus. Los resultados de la biopsia según las lesiones detectadas en la RM se presentan en la Figura 14.
La biopsia de las lesiones PIRADS 3 mostró cáncer con Gleason de grado alto (>4+3) en el 11% de los casos y Gleason de grado intermedio (3+4 y 4+3) en el 11% de los casos, mientras que la biopsia fue normal en un 72% de los casos. La biopsia de las lesiones PIRADS 4 mostró cáncer con Gleason de alto grado (>4+3) en el 6% de los casos, Gleason intermedio (3+4 y 4+3) en el 34% de los casos y Gleason bajo (3+3) en el 6% de los casos, mientras que la biopsia fue normal en el 44% de los casos. La biopsia de las lesiones PIRADS 5 mostró cáncer con Gleason de alto grado (>4+3) en el 20% de los casos, Gleason intermedio (3+4 y 4+3) en el 30% de los casos y Gleason bajo (3+3) en el 30% de los casos, mientras que la biopsia fue normal en el 20% de los casos.
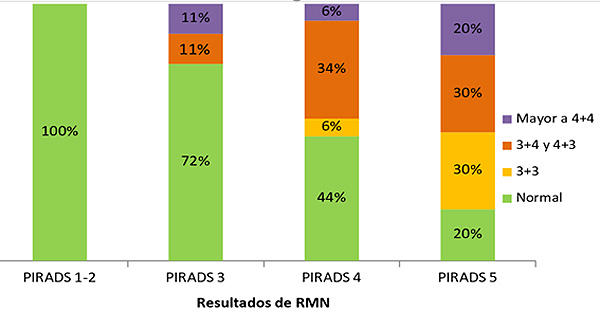
Figura 14. Correlación entre resultado de RM y de grado de Gleason de la anatomía patológica
Difusión: Dr. Chéchile
Conclusiones
El sistema Artemis es el único sistema semirobótico que existe en España para la realización de biopsias de próstata por fusión de imágenes. Es un sistema útil en la detección, en la planificación de tratamientos focales y en el seguimiento de pacientes con cáncer de próstata en vigilancia activa. Nos brinda una excelente precisión (1,2 ±1,1 mm) con una elevada seguridad de punción de las lesiones sospechosas. Aumenta considerablemente la detección de tumores clínicamente significativos y nos permite el registro en un modelo en 3 dimensiones de las zonas biopsiadas. Los resultados dependen de una estrecha colaboración entre el radiólogo, el urólogo y el patólogo.
Bibliografía
1. Incidencia del cáncer de próstata en España. En: www.aecc.es.
2. Loberg RD, Logothetis CJ, Keller ET, Pienta KJ. Pathogenesis and treatment of prostate cancer bone metastases: targeting the lethal phenotype. J Clin Oncol. 2005; 23: 8232–8241.
3. Coley CM, Barry MJ, Fleming C et al. Early detection of prostate cancer. Part I: prior probability and effectiveness of tests. The American College of Physicians. Ann Intern Med 1997; 126: 394–406.
4. Saini, S. PSA and beyond: alternative prostate cancer biomarkers. Cell Oncol. 2016; 39: 97–106.
5. Carter HB, Albertsen PC, Barry MJ et al. Early detection of prostate cancer: AUA Guideline. J Urol 2013; 190: 419–426.
6. Cary KC, Cooperberg MR. Biomarkers in prostate cancer surveillance and screening: past, present, and future. Ther Adv Urol. 2013; 5:318–329.
7. Noguchi M; Stamey TA, McNeal JF, Yemoto CM. Relationship between systematic biopsies and histological features of 222 radical prostatectomy specimens: lack of prediction of tumor significance for men with nonpalpable prostatic cáncer. J Urol 2001; 166: 104-109.
8. Carlsson S, Jaderling F, Wallerstedt A, et al. Oncological and functional outcomes 1 year after radical prostatectomy for very low risk Prostate cáncer: results from the prospective LAPPRO trial. BJU Int 2016; 118:205-212.
9. Smith-Palmer J, Takizawa C, Valentine WL. Literature review of the burden of prostate cancer in Germany, France, the United Kingdom and Canada. BMC Urol. 2019; 18:19.
10. Roehrborn CG, Black LK. The economic burden of prostate cancer. BJU Int. 2011;108: 806-13.
11. Heidenreich A, Bastian PJ, Bellmunt J, et al. EAU guidelines on prostate cancer. part 1: screening, diagnosis, and local treatment with curative intent-update 2013. Eur Urol. 2014; 65:124–137.
12. Hamdy FC, Donovan JL, Lane JA, et al. ProtecT Study Group 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med. 2016;375(15):1415–1424.
13. Heijmink SWTPJ, Fütterer JJ, Strum SS, et al. State–of-the-art uroradiologi imaging in the diagnosis of prostate cancer. Acta Oncol 2011; 50 (suppl) 1: 25-38.
14. Turkbey B, Pinto PA, Mani H, et al. Prostate cáncer: value of multiparametric MR imaging at 3T for detection- histopathologic correlation. Radiology 2010; 255: 89-99.
15. Turkbey B, Albert PS, Kurdziel K, et al. Imaging localized Prostate cáncer: current approaches and new developments. AJT Am J Roentgenol 2009; 192: 1471-80.
16. Tamada T, Sone T, Jo Y, et al. Prostate cancer: relationships between postbiopsy hemorrhage and tumor detectability al MR diagnosis. Radiology 2008; 248: 531-539.
17. Zelhof B Pickles M, Liney G,et al. Correlation of diffusion-weighted magnetic resonance data with cellularity in prostate cancer. BJU Int 2009; 103: 883-8.
18. Verma S, Turkbey B, Muradyan N, et al. Overview of dynamic contrast-enhanced MRI in prostate cancer diagnosis and management. AJR Am J Roentgenol 2012; 198: 1277-88.
19. Truong M, Feng C, Hollenberg G, et al. A comprehensive analysis of cribriform morphology on magnetic resonance imaging/ultrasound fusion biopsy correlated with radical prostatectomy specimens. J Urol 2018; 199: 106-113.
20. Valerio M, Donaldson I, Emberton M, et al. Detection of clinically significant prostate cancer using magnetic resonance imaging-ultrasound fusion targeted biopsy: a systematic review. Eur Urol 2015; 68: 8-19.
21. Justin Streicher J, Meyerson BL, Karivedu V, Sidana A. A review of optimal prostate biopsy: indications and techniques. Ther Adv Urol. 2019.
22. Taira AV, Merrick GS, Galbreath RW, et al. Performance of transperineal template-guided mapping biopsy in detecting prostate cancer in the initial and repeat biopsy setting. Prostate Cancer Prostatic Dis. 2010;13:71-7.
23. Weinreb JC, Barentsz JO, Choyke PL, et al. PI-RADS Prostate Imaging-Reporting and Data System: 2015, versión 2. Eur Urol 2016; 69: 16-40.
24. Turkbey B, Rosenkrantz AB, Haider MA, et al. Prostate imaging reporting and data system version 2.1: 2019 update of prostate imaging reporting and data system version 2. Eur Urol 2019; 76:340-51.
25. Israël B, Leest MV, Sedelaar M, et al. Multiparametric Magnetic Resonance Imaging for the Detection of Clinically Significant Prostate Cancer: What Urologists Need to Know. Part 2: Interpretation. Eur Urol 2020;77: 469-480.
26. Marks L, Young S, Natarajan S. MRI-ultrasound fusión for guidance of targeted Prostate biopsy. Curr Opin Urol 2013; 23: 43-50.
27. Lee SH, Chung MS, Kim JH, et al. Magnetic resonance imaging targeted biopsy in men with previously negative prostate biopsy results. J Endourol 2012; 26: 787-791.
28. Verma S, Choyke PL, Eberhardt, et al. The current state of MR imaging-targeted biopsy techniques for detection of Prostate cáncer. Radiology 2017; 285: 343-356.
29. Wegelin O, van Melick HH, Hooft I, et al. Comparing three different tecniques for magnetic resonance imaging-targeted Prostate biopsies: a systematic review of in bore versus magnetic resonance imaging-transrectal ultrasound fusión versus cognitive registration. Is there a preferred technique? Eur Urol 2017; 71: 517-531.
30. Ahmed HU, Bosaily AE, Brown LC, et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet 2017; 389:815-22.
31. Kasivisvanathan V, Rannikko AS, Borghi M, et al. MRI-targeted or standard biopsy for prostate-cancer diagnosis. N Engl J Med 2018; 378:1767-77.
32. Drost FH, Osses DF, Nieboer D, et al. Prostate MRI, with or without MRI-targeted biopsy, and systematic biopsy for detecting prostate cancer. Cochrane Database Syst Rev 2019;4:CD012663.
33. Wegelin O, Exterkate L, van der Leest M, et al. The FUTURE trial: a multicenter randomised controlled trial on target biopsy techniques based on magnetic resonance imaging in the diagnosis of prostate cancer in patients with prior negative biopsies. Eur Urol 2019; 75:582-90.
34. Perez IM, Jabor I, Kauko T, et al. Qualitative and Quantitative Reporting of a unique biparametric MRI: towards biparametric MRI-based nomograms for prediction of prostate biopsy outcome in men with a clinical suspicion of prostate cancer (IMPROD and MULTI-IMPROD Trials). Magn Reson Imaging. 2019.
35. Lili Xu, Gumuyang Zhang, Bing Shi, et al. Comparison of biparametric and multiparametric MRI in the diagnosis of prostate cáncer. Cancer Imaging. 2019; 19: 90.
36. Záleský M, Stejskal J, Adamcova V, et al. Use of prostate specific antigen density combined with multiparametric magnetic resonance imaging improves triage for prostate biopsy. Urol Int. 2019; 103: 33-40.
37. Masakatsu Oishi, Toshitaka Shin, Chisato Ohe, et al. which patients with negative magnetic resonance imaging can safely avoid biopsy for prostate cancer? J Urol. 2019; 201: 268–276.
38. Siddiqui MM, Rais-Bahrami S, Turkbey B, et al. Comparison of MR/ultrasound fusion–guided biopsy with ultrasound-guided biopsy for the diagnosis of prostate cancer. JAMA. 2015; 313: 390–7.
39. Radtke JP, Schwab C, Wolf MB, et al. Multiparametric magnetic resonance imaging (MRI) and MRI-transrectal ultrasound fusion biopsy for index tumor detection: correlation with radical postatectomy specimen. Eur Urol. 2016; 70: 846–53.
40. Elwenspoek, M, Athena L, Sheppard, MS, et al. Comparison of multiparametric magnetic resonance imaging and targeted biopsy with systematic biopsy alone for the diagnosis of prostate cancer. A systematic review and meta-analysis, JAMA Netw Open. 2019. Published online.
41. Natarajan S, Marks LS, Margolis D, et al. Clinical application of a 3D ultrasound-guided Prostate biopsy system: biopsy tracking and lesión targeting via real-time MRI/ultrasound fusión. Urol Oncol 2011; 29: 334-342.
42. Streicher J, Meyerson BL, Karivedu V, Sidana A. A review of optimal prostate biopsy: indications and techniques. Ther Adv Urol. 2019 Published online.
43. Fiard G,, Hohn N, Descotes JL, et al. Targeted MRI-guided prostate biopsies for the detection of prostate cancer: initial clinical experience with real-time 3-dimensional transrectal ultrasound guidance and magnetic resonance/ transrectal ultrasound image fusion. Urology. 2013; 81:1372-8.
44. Ukimura O, Desai MM, Palmer S, Get al. 3-Dimensional elastic registration system of prostate biopsy location by real-time 3-dimensional transrectal ultrasound guidance with magnetic resonance/transrectal ultrasound image fusion. J Urol 2012; 187: 1080–1086.
45. Kamrava M, Kishan AU, Margolis DJ, et al. Multiparametric MRI for Prostate cáncer improves Gleason score assessment in favorable risk Prostate cancer. Pract Radiat Oncol 2015; 5: 411-416.
46. Wysock JS, Rosenkrantz AB, Huang WC, et al. A prospective, blinded comparison of magnetic resonance (MR) imaging-ultrasound fusion and visual estimation in the performance of MR-targeted prostate biopsy: the PROFUS trial. Eur Urol 2013; 66: 343–351.
47. Sonn GA, Chang E, Natarajan S, et al. Value of targeted prostate biopsy using magnetic resonance-ultrasound fusion in men with prior negative biopsy and elevated prostate-specific antigen. Eur Urol 2014; 65: 809–15.
48. Kasabwala K, Patel N, Cricco-Lizza E, et al. The learning curve for magnetic resonance imaging/ultrasound fusion-guided prostate biopsy. Eur Urol Oncol. 2019; 2:135-140.
49. Meng X, Rosenkrantz AB, Huang R, et al. The institutional learning curve of magnetic resonance imaging-ultrasound fusion targeted prostate biopsy: temporal improvements in cancer detection in 4 years. J Urol. 2018; 200:1022-1029.
50. Filson, S. Natarajan, D.J. Margolis, et al. Prostate cancer detection with magnetic resonance-ultrasound fusion biopsy: the role of systematic and targeted biopsies. Cancer. 2016; 122: 884-892.
51. Patel N, Cricco-Lizza E, Kasabwala K et al. The Role of Systematic and Targeted Biopsies in Light of Overlap on Magnetic Resonance Imaging Ultrasound Fusion Biopsy. Eur Urol Oncol. 2018;1:263-267.
52. Haffner J, Lemaitre L, Puech P, et al. Role of Magnetic Resonance Imaging Before initial biopsy: comparison of magnetic resonance imaging-targeted and systematic biopsy for significant prostate cancer detection. BJU Int 2011; 108: 171-178.
53. Hanna N, Wszolek MF, Mojtahed A, et al. Multiparametric magnetic resonance imaging-ultrasound fusion biopsy improves but does not replace standard template biopsy for the detection of prostate cancer. J Urol. 2019 202:944-951.




