Redacción Farmacosalud.com
AstraZeneca y su división mundial de investigación y desarrollo de biológicos MedImmune han anunciado que la Agencia Americana del Medicamento (FDA, por sus siglas en inglés) ha aprobado benralizumab para el tratamiento de mantenimiento adicional en pacientes de 12 años o más con asma grave y con un fenotipo eosinófilo[1]. Asimismo, el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) ha emitido la opinión positiva recomendando la autorización de comercialización de benralizumab como tratamiento de mantenimiento adicional en pacientes adultos con asma grave eosinofílica no controlada a pesar de la administración de corticosteroides inhalados en dosis altas y agonistas β de acción prolongada[2].
La aprobación de la FDA y la recomendación del CHMP se basan en los resultados del programa WINDWARD, que incluye los ensayos pivotales Fase III sobre exacerbaciones, SIROCCO y CALIMA[3-5], y el ensayo Fase III de reducción de uso de corticosteroides orales (CSO), ZONDA[6]. Los resultados del régimen de administración de benralizumab durante 8 semanas en estos ensayos han demostrado:

Autor/a: Petr Kratochvil
Fuente: www.publicdomainpictures.net
Reducción de hasta el 51% en la tasa anual de exacerbaciones
• Una reducción de hasta el 51% en la tasa anual de exacerbaciones por asma frente a placebo.
• Una rápida mejoría de la función pulmonar (aumento de 290 ml del volumen espiratorio forzado en un segundo (VEF1) desde el nivel basal a las 4 semanas) después de la primera dosis, proporcionando los primeros indicios de la eficacia.
• Una mediana de reducción de dosis diaria de CSO del 75% y discontinuación de los CSO en el 52% de los pacientes elegibles.
• El perfil de eventos adversos general fue similar al del placebo.
Eugene Bleecker, MD, profesor y codirector de Genética, Genómica y Medicina de Precisión de Ciencias de la Salud de la Universidad de Arizona, e investigador principal del estudio pivotal Fase III SIROCCO, asegura que "es un día importante para los pacientes con asma eosinofílica grave que han tenido opciones de tratamiento limitadas durante demasiado tiempo, muchos de ellos confiando en los esteroides orales para controlar sus síntomas. Benralizumab tiene un fuerte perfil clínico que incluye la capacidad de mostrar mejoría de la función pulmonar después de la primera dosis, la posibilidad de reducir, o incluso detener, el uso de esteroides orales y la conveniencia de la dosificación cada 8 semanas. Benralizumab también trata un fenotipo distinto del paciente, ayudando a los médicos a seleccionar al paciente adecuado en la práctica clínica con más confianza".
Un nivel alto de eosinófilos contribuye a la hiperreactividad de las vías respiratorias
Benralizumab es el único tratamiento biológico respiratorio que consigue eliminar los eosinófilos de forma directa, rápida y casi completa, en un plazo de 24 horas. Los eosinófilos son un tipo de glóbulos blancos que forman parte del sistema inmunológico normal del organismo. Un nivel alto de eosinófilos, como el que se observa en aproximadamente la mitad de los pacientes con asma grave, contribuye a la inflamación y a la hiperreactividad de las vías respiratorias, aumentando la gravedad y los síntomas del asma, reduciendo la función pulmonar e incrementando el riesgo de exacerbaciones por asma. Benralizumab se une directamente al receptor IL-5α de los eosinófilos y atrae a las células natural ‘killer’ mediante un mecanismo exclusivo para inducir su apoptosis (muerte celular programada). Una vez que reciba la aprobación en la Unión Europea, benralizumab se comercializará en forma de dosis fija, en una jeringa precargada, para administrarlo por inyección subcutánea cada 8 semanas.
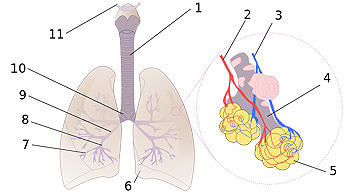
Diagrama pulmonar
1:Tráquea 2:Arteria pulmonar 3:Vena pulmonar 4:Bronquiolo terminal 5:Alvéolos 6:Corte cardíaco 7:Bronquios terciarios o segmentados 8:Bronquios secundarios o lobales 9:Bronquio principal 10:Bifurcación traquial o carina 11:Laringe
Autor/a de la imagen: Rastrojo (D•ES) - trabajo propio a partir de Image:Illu bronchi lungs.jpg
Fuente: Wikipedia
En un reciente análisis combinado de los ensayos SIROCCO y CALIMA, se han identificado características específicas y bien definidas del fenotipo eosinofílico que permitirán a los médicos seleccionar con mayor precisión los pacientes con asma grave que más podrían beneficiarse del tratamiento con benralizumab. Benralizumab también está siendo revisado por las autoridades reguladoras de Japón y otros países, cuyas decisiones están previstas para el primer semestre de 2018. Por su parte, la opinión positiva del CHMP será revisada por la Comisión Europea que tiene autoridad para aprobar medicamentos en los 28 Estados miembros de la UE además de Islandia, Noruega y Liechtenstein.
El asma afecta a 315 millones de personas en todo el mundo y aproximadamente el 10% de los pacientes asmáticos presenta asma grave que, en ocasiones, no pueden controlar a pesar de recibir dosis elevadas de los medicamentos de referencia para el control del asma, y pueden requerir corticosteroides orales (CSO) de forma crónica. El asma grave no controlada es una forma incapacitante y potencialmente mortal de la enfermedad, en la que los pacientes experimentan exacerbaciones frecuentes y una limitación considerable de la función pulmonar y la calidad de vida. El asma grave no controlada tiene un riesgo de mortalidad mayor que el asma grave. El asma grave no controlada puede ocasionar dependencia de los corticosteroides orales y una exposición sistémica a los esteroides que puede provocar efectos adversos graves a corto y largo plazo, como aumento de peso, diabetes, osteoporosis, glaucoma, ansiedad, depresión, enfermedades cardiovasculares e inmunosupresión. Además, supone una importante carga física y socioeconómica al representar el 50% de los costes relacionados con el asma.
Referencias
1. https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/761070s000lbl.pdf
2. http://www.ema.europa.eu/docs/en_GB/document_library/Summary_of_opinion_-_Initial_authorisation/human/004433/WC500238040.pdf
3. FitzGerald JM, Bleecker ER, Menzies-Gow A, Zangrilli JG, Hirsch I, et al. Predictors of enhanced response with benralizumab for patients with severe asthma: pooled analysis of the SIROCCO and CALIMA studies. Lancet Respir Med. 2017.
4. Bleecker ER, Fitzgerald MJ, Chanez P, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting β2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. Lancet. 2016. Volume 388, Issue 10056, 2115 – 2127.
5. FitzGerald MJ, Bleecker E, Parameswaran N, et al. Benralizumab, an anti-interleukin-5 receptor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2016. Volume 388, Issue 10056, 2128 – 2141.
6. Nair P, Wenzel S, Rabe KF, Bourdin A, Lugogo NL, et al. Oral glucocorticoid-sparing effect of benralizumab in severe asthma. N Engl J Med. 2017; 376:2448-58.




