Drs. José María Paredes, Nadia Moreno y Patricia Latorre
Introducción
En los últimos años se han producido grandes avances en el tratamiento farmacológico de la Enfermedad Inflamatoria Intestinal (EII). El desarrollo de nuevas moléculas ha experimentado un espectacular aumento, de forma que se dispone cada vez de más opciones terapéuticas y en pocos años se espera que aparezcan nuevas alternativas (Tabla). Aun así, el número de fármacos actualmente disponibles es pequeño comparado con el existente para otras enfermedades inmunomediadas como las reumatológicas o las de dermatología. Ello hace que, para evitar perder opciones terapéuticas, con frecuencia se deba recurrir en la práctica clínica habitual a la optimización del tratamiento aplicado, generalmente intensificándolo por respuestas subóptimas: bien por no alcanzar una respuesta completa con el tratamiento de inducción, o por producirse una pérdida de la misma durante el tratamiento de mantenimiento.

(de izq. a dcha): Drs. Patricia Latorre, José María Paredes y Nadia Moreno
Fuente: Drs. Latorre, Paredes y Moreno
Por otra parte, la implantación de objetivos terapéuticos cada vez más ambiciosos en lo que se ha denominado estrategia de “tratamiento por objetivos” (del inglés, “treat to target”), como la curación mucosa, conlleva la necesidad de monitorizaciones repetidas endoscópicas o analíticas utilizando diferentes biomarcadores (sustancias inflamatorias séricas o fecales, concentración plasmática del fármaco empleado, presencia de anticuerpos frente al fármaco empleado) que reflejen la actividad inflamatoria, y la consiguiente intensificación del tratamiento si no se consiguen los objetivos1.
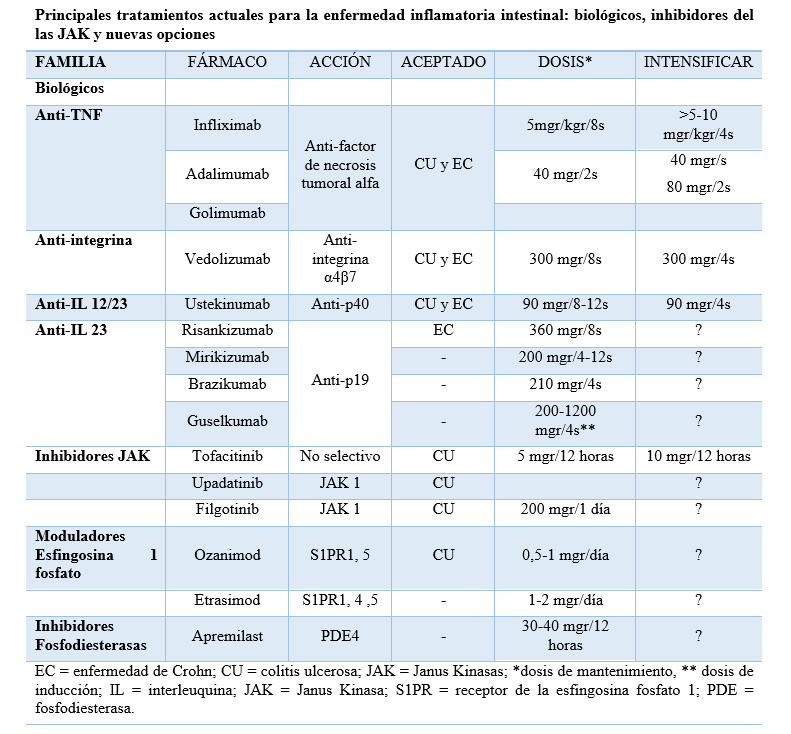
Tabla
Elaboración propia
Lo anteriormente expuesto obliga a que los gastroenterólogos dedicados al tratamiento de la EII estén informados sobre en qué circunstancias se debe intensificar el tratamiento, qué tipos de fármacos se pueden intensificar y qué resultados se pueden esperar de estas intensificaciones.
La intensificación se define como el aumento de dosis o la reducción de los tiempos de administración del fármaco empleado2. La necesidad de intensificación de los tratamientos empleados se ha descrito tanto en la enfermedad de Crohn (EC) como en la colitis ulcerosa (CU). Aunque los estudios que valoran los patrones de tratamiento de la EII (uso de monoterapia o de terapia combinada, necesidad de cambio de dosis o fármaco, suspensión del tratamiento...) muestran que inicialmente se producía un menor uso de fármacos biológicos en la CU que en la EC, en la actualidad se dispone de más opciones terapéuticas para la CU, en la que, además, se ha descrito la necesidad de una intensificación más precoz que en la EC3.
El propósito de la presente revisión es analizar brevemente los avances acontecidos en el patrón de tratamiento intensificado de la CU, incluyendo la utilización terapéutica de nuevas moléculas, la influencia del comportamiento de la CU en la decisión de proceder a la intensificación y el papel jugado por el empleo de biomarcadores en la toma de tal decisión.
Patrones de intensificación en la CU
Es importante conocer cómo y con qué frecuencia intensificamos los tratamientos en la EII. Gran parte de la información disponible proviene de la experiencia adquirida con fármacos anti-factor de necrosis tumoral α (anti-TNF, del inglés “tumor necrosis factor”) y especialmente con infliximab, dado que son los fármacos que más tiempo llevan utilizándose en la EII y con los que más experiencia tenemos los gastroenterólogos, siendo también, aún hoy en día, utilizados como primera línea de tratamiento.

Fuente: www.farmacosalud.com / Archivo
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
Aunque existen estudios de diversos países respecto al patrón de tratamiento con estos medicamentos, recientemente se han publicado los resultados de un estudio multicéntrico realizado en nuestro país, donde se valoran los patrones de empleo de los fármacos anti-TNF en la práctica clínica real (316 pacientes con EII seguidos durante una mediana de 60 meses)2. Entre los 116 pacientes con CU incluidos, la tasa de intensificación fue del 37.1%, sin diferencias entre el tipo de anti-TNF empleado: 33.3% para adalimumab y 37.6% de intensificaciones entre los que recibían tratamiento con infliximab. Los pacientes con CU necesitaron una intensificación de forma significativamente más precoz que los pacientes con EC (mediana de tiempo para intensificar 5.3 vs 14.2 meses, respectivamente; p = 0.028). El régimen de intensificación entre los pacientes con CU fue: aumento de la dosis del fármaco 30.2%; disminución del intervalo de administración 23.3%, y combinación de ambos regímenes en un 46.5%.
Esta necesidad de intensificación más precoz en la CU se atribuye a diversas características propias de la enfermedad como son: una mayor carga inflamatoria en la CU, posibles aspectos farmacocinéticos de la penetrancia del fármaco en la pared intestinal, o diferencias en la concentración plasmática del fármaco en la CU vs la EC4. Estos fenómenos pueden operar conjuntamente cuando la CU se comporta como un brote grave, en el que un patrón intensificado con múltiples dosis de infliximab en menos tiempo, parece conseguir mejores resultados respecto a una menor necesidad de colectomía a corto plazo5.
Con la extensión del empleo de los diferentes tipos de anti-TNF y la aplicación en la práctica clínica de las nuevas moléculas, necesitamos conocer los patrones de tratamiento que utilizamos con los diferentes fármacos y el efecto de estas intensificaciones.
Intensificación de los diferentes fármacos empleados en el tratamiento de la CU
a) Anti-TNF:
En el estudio VERNE, cuyos resultados se han publicado recientemente, se ha observado que no hay diferencias significativas en las necesidades de intensificar el tratamiento con infliximab o con adalimumab cuando tratamos a los pacientes con CU; sin embargo, sí que detectó una tendencia a una intensificación más precoz (sin significación estadística) entre los pacientes en tratamiento con adalimumab, mediana de 2.8 meses frente a los 6.3 meses necesarios para intensificar infliximab2. En este sentido, la publicación, también reciente, del estudio SERENE UC6 nos muestra cómo, entre un grupo de pacientes con CU tratados con dosis elevadas de adalimumab (160 mg en las semanas 0, 1, 2 y 3 seguido de 40 mgr semana 4 y 6), no existe diferencia significativa en el objetivo primario (remisión clínica) frente a un grupo de inducción estándar (160 mgr semana 0, 80 mgr semana 2 y 40 mgr semanas 4 y 6) y posterior aleatorización en la semana 8 a 40 mg semanales frente a la dosis habitual de 40 mgr cada 2 semanas; si bien no se alcanzó significatividad estadística, sí que se evidenció una diferencia superior al 10% de remisiones entre el grupo que recibió dosis elevadas.
Todo ello parece indicar que, cuando elijamos entre los anti-TNF una molécula como adalimumab, debemos estar preparados para emplear dosis más elevadas en la inducción o realizar intensificaciones precoces para conseguir un mayor porcentaje de remisiones.
Autor/a de la imagen: Bicanski
Fuente: Pixnio / Creative Commons
b) Vedolizumab:
Este fármaco anti-integrina fue la segunda clase dentro de los fármacos biológicos aceptada para el tratamiento de la CU. Según una revisión sistemática, la necesidad de intensificar el tratamiento de mantenimiento de 8 a cada 4 semanas aumenta con el tiempo de tratamiento: 9.9% al mes y medio, 30% a los 3 meses y 47% al año7. Más recientemente, una revisión sobre la eficacia de la intensificación de la administración de vedolizumab cada 4 semanas, en pacientes con EII, muestra unas tasas de respuesta y de remisión en la semana 58 del 40-73% y entre el 30-56%, respectivamente8.
c) Ustekinumab:
Aceptado para el tratamiento de la CU en tercer lugar dentro de los tratamientos biológicos. Hasta más de un 40% de los pacientes tienen una respuesta subóptima con la administración habitual cada 8 semanas9. Recientemente, un trabajo muestra el efecto de la intensificación de ustekinumab 90 mg cada 4 ó 6 semanas en pacientes con CU9. De los 108 pacientes incluidos, 46 (42.6%) precisaron intensificación con una mediana de 95 días tras el inicio del tratamiento; 33 pacientes recibieron tratamiento cada 4 semanas y 13 cada 6 semanas. La indicación de realizar la intensificación fue por falta de respuesta a la inducción a las 16 semanas del inicio del tratamiento; un 55% de los pacientes consiguieron la remisión clínica, con una tasa de efectos secundarios del 5% (dos infecciones leves en los 46 pacientes).
d) Tofacitinib:
Ha sido el primer fármaco inhibidor de las Janus Kinasas (JAK) aceptado para el tratamiento de la CU. Aunque existe escasa información sobre los pacientes que precisan intensificación (10 ó 15 mg cada 12 horas en vez de 5 mgr cada 12 horas tras las 8 semanas de inducción), un 50% de pacientes que en la semana 8 no han alcanzado una respuesta clínica se benefician de extender esta dosis intensificada (10 mg/12 horas) hasta la semana 16, lo cual puede ser más necesario entre los pacientes refractarios a múltiples tratamientos previos10. En el caso de tofacitinib, es de gran importancia establecer qué pacientes se pueden beneficiar de la estrategia intensificada, ya que el riesgo de efectos secundarios de este fármaco está relacionado con la dosis10.

Fuente: Archivo
Como muestran los datos de los principales fármacos biológicos empleados en el tratamiento de la CU, la necesidad de intensificar las dosis es igual o mayor al 40% de los pacientes. Aunque en la mayoría de las ocasiones las intensificaciones se realizan en el contexto de respuestas subóptimas al tratamiento, la estrategia actual de monitorizar de forma estrecha determinados objetivos terapéuticos nos permite decidir si realizar la intensificación antes de que el paciente presente síntomas y, por ello, debemos conocer los parámetros empleados para definir los objetivos terapéuticos.
Estrategia de “tratamiento por objetivos” y papel de la monitorización terapéutica en la CU
En caso de la CU, los síntomas de la enfermedad se correlacionan mejor que en la EC con la actividad inflamatoria endoscópica y pueden servir de guía para decidir intensificar el tratamiento. Por ello, actualmente la información sobre la utilidad de la monitorización estrecha con biomarcadores es escasa en la CU. Aun así, en una proporción significativa de pacientes con CU en remisión clínica persiste la actividad endoscópica11. Un estudio de 91 pacientes con CU asignados a dos grupos, uno con ajuste de la dosis de mesalazina en base a la determinación mensual de calprotectina y otro con dosis según la situación clínica, mostró una menor tasa de recaídas en el grupo de monitorización estrecha que en el grupo sin monitorización (35.3% vs 50.0%, respectivamente; p = 0.23)12. Más recientemente, en un abstract, Dubinsky et al, mostraban entre los pacientes con CU tratados con tofacitinib 10 mgr cada 12 horas, que el descenso de las cifras de calprotectina fecal y proteína C reactiva sérica en las semanas 2 y 4 era predictor de la curación mucosa frente a aquellos pacientes que no reducían dichos biomarcadores13.
Dada la escasa información disponible, el empleo de biomarcadores para optimizar las dosis del tratamiento en la CU aún es un campo de estudio.
Por otra parte, en la actualidad es un tema de debate si la monitorización terapéutica de los fármacos, fundamentalmente de los anti-TNF, debe practicarse mediante un enfoque proactivo (monitorizar la concentración de fármaco con vistas a optimizar las dosis antes de que se produzca la pérdida de respuesta clínica) o de forma reactiva (determinar la concentración de fármaco y la presencia de anticuerpos frente al mismo, solo ante la pérdida de respuesta clínica). Los estudios hasta la fecha no han podido demostrar claramente diferencias entre ambas estrategias14, pero se está pendiente de valorar la utilidad de la determinación inmediata (ultraproactiva) de los niveles del fármaco en el mismo momento de la atención a los pacientes.
Un estudio reciente valora esta estrategia ultraproactiva con determinación de la concentración de fármaco en el momento de atender al paciente y la optimización del tratamiento en el mismo acto frente a la utilización reactiva de la monitorización terapéutica del fármaco en 187 pacientes con EII, sin evidenciar diferencias entre ambos grupos respecto al porcentaje de pacientes con fallo al tratamiento con infliximab ni respecto al porcentaje de pacientes en remisión al año. Los autores concluyen que la monitorización proactiva puede ser útil en conjunción con otros parámetros de monitorización (clínica y biomarcadores)15. En este sentido, Bacsur et al, muestran un aumento de la concentración plasmática de infliximab en el 87% y una mejoría de los síntomas en el 90% de 47 pacientes con EII a los que intensificaron el fármaco en base a un conjunto de variables determinadas de forma inmediata en el momento de la atención a los pacientes como se muestra en la Figura16.
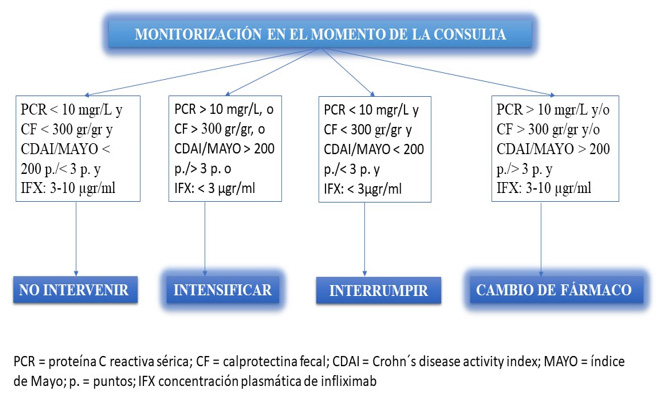
Figura: Algoritmo de optimización del tratamiento de la EII en base a una monitorización inmediata en el punto de atención al paciente adaptado de Bacsur et al, 16
Conclusión
A pesar del aumento de tratamientos para la CU, la necesidad de intensificar el tratamiento médico es frecuente y depende de múltiples factores como el comportamiento de la enfermedad, el tipo de fármaco empleado, la situación clínica, la monitorización con biomarcadores y la concentración plasmática del medicamento. El gastroenterólogo debe estar familiarizado con esta necesidad de optimizar los tratamientos y los avances que van apareciendo para poder dar una mayor vida a las opciones terapéuticas de nuestros pacientes.
Bibliografía
1. Colombel JF, D´HaensG, Lee WJ, et al. Outcomes and strategies to support a treat-to-target approach in inflammatory bowel disease: a systematic review. JCC 2020;14:254-266
2. Bastida G, Marín-Jiménez I, Forés A, et al. Treatment patterns and intensification within 5 year of follow-up of the first-line anti-TNFα used for the treatment of IBD: Results from the VERNE study. Dig Liver Dis 2022;54:76-83.
3. O’Donnell S, Stempak JM, Steinhart AH, et al. Higher rates of dose optimisation for infliximab responders in ulcerative colitis than in Crohn’s disease. J Crohns Colitis 2015;9:830–836.
4. Magro F, Rodrigues-Pinto E, Lopes S, et al. Earlier need of infliximab intensification in Ulcerative Colitis than Crohn´s disease. JCC 2014;8:1331-1332.
5. Conely TE, Fiske J, Subrmanian S. How to manage: acute severe colitis. Frontline Gastroenterol 2022;13:64–72.
6. Panés J, Colombel JF, D´Hanes G, et al. Higher vs standard adalimumab Induction and maintenance dosing regimens for treatment of ulcerative colitis: SERENE UC Trial Results. Gastroenterology 2022;162:1891–1910.
7. Gemayel NC, Rizello E, Atanasov P, et al. Dose escalation and switching of biologics in ulcerative colitis: a systematic literature review in real-world evidence. Curr Med Res Op 2016;35:1911-1923.
8. Patel D, Martin s, Luo S, et al. Real-world effectiveness of vedolizumab dose escalation in patients with inflammatory bowel disease: a systematic literature review. Crohn's & Colitis 360 2022;4:1-11.
9. Dalal RS, Esckilsem S, Barnes EL, et al. Predictors and outcomes of ustekinumab dose intensification in ulcerative colitis: a multicenter cohort study. Clin Gastroenterol Hepatol 2022;20:2399-2401.
10. Irving PM, Leung Y, Dubinsky MC. Review article: guide to tofacitinib dosing in patients with ulcerative colitis. Aliment Pharmacol 2022;56:1131-1145.
11. Jharap B, Sandborn WJ, Reinisch W, et al. Randomised clinical study: discrepancies between patient-reported outcomes and endoscopic appearance in moderate to severe ulcerative colitis. Aliment Pharmacol Ther 2015; 42: 1082- 1092.
12. Lasson A, Ohman L, Stotzer PO, et al. Pharmacological intervention based on fecal calprotectin levels in patients with ulcerative colitis at high risk of a relapse: A prospective, randomized, controlled study. United European Gastroenterol. 2015;3:72-79.
13. Dubinsky MC, Hudesman DP, Kulisek N, et al. Fecal calprotectin levels, C-reactive protein levels, and partial Mayo score as early predictors of clinical and endoscopic outcomes in patients with ulcerative colitis treated with tofacitinib in a Phase 2 study [abstract]. Am J Gastroenterol 2019;114:S474-S475. Abstract P0389.
14. Vermeire, S.; Dreesen, E.; Papamichael, K.; Dubinsky, M.C. How, When, and for whom should we perform therapeutic drug monitoring? Clin. Gastroenterol. Hepatol. 2019; 18:1291–1299.
15. Bossuyt P, Lieven P, Claeys S, et al. Ultra-proactive therapeutic drug monitoring of infliximab based on point of care testing in inflammatory bowel disease: results of a pragmatic trial. J Crohns Colitis 2022;16:199–206.
16. Bacsur P, Farkas K, Molnar T. Outcome of immediate dose optimization of infliximab in inflammatory bowel disease patients. J Crohns Colitis 2022;16:863–864.




