La osteoporosis debe ser prevenida, tratada si es necesario y monitoreada, ya que sus consecuencias, las fracturas, vienen cargadas con una importante comorbilidad y con una mortalidad muy alta. Hay que tener en cuenta que la osteoporosis está considerada por la Organización Mundial de la Salud (OMS) como una epidemia, aparte de que presenta un costo elevado en términos de calidad de vida y también en términos económicos. Por ello, para los sistemas de salud, resulta prioritario establecer a qué pacientes se debe tratar y con qué tipo de medidas, sean o no farmacológicas.
Resulta particularmente importante encontrar un punto de acuerdo en cuanto qué tipo de pacientes son susceptibles de recibir terapias farmacológicas, puesto que éstas pueden ser costosas, tienen que administrarse por tiempos prolongados, no siempre son bien toleradas y presentan una seguridad variable, puntos todos ellos que conllevan la necesidad de establecer normas generales de tratamiento. Por supuesto, y como prioritario, estarán las medidas higiénico-dietéticas, como la dieta rica en calcio y la exposición moderada al sol, y si es necesario los suplementos de calcio y/o vitamina D. Por otra parte, es importante establecer estrategias para la mejora del cumplimiento terapéutico.

Dr. Santiago Palacios
Fuente: Instituto Palacios
El objetivo principal del tratamiento en la osteoporosis es prevenir las fracturas; también será estabilizar o incrementar la masa ósea, aliviar los síntomas de las fracturas e intentar maximizar la función física[1].
¿A QUIÉN TRATAR?
Podemos simplificar y decir que las mujeres osteoporóticas se tratan y las ‘normales’ no. Como siempre, la parte más difícil está en las osteopénicas. En este caso, deberían tratarse las mujeres osteopénicas que están en riesgo de fractura[2,3]. De acuerdo con las guías de la National Osteoporosis Foundation[4], parece justificado pedir tratamiento en las siguientes condiciones:
1. Fractura de cadera o de columna (clínica o morfométrica).
2. T score menor o igual a -2,5 en cadera, cuello de fémur o columna (es decir, ante el diagnóstico de osteoporosis).
3. Baja masa ósea (T score entre -1 y 2,5 en columna o cadera) Y una probabilidad de fractura de cadera mayor o igual a 3% o de fractura osteoporótica mayor o igual a 20% según FRAX (algoritmo OMS).
4. Si el juicio clínico y/o las preferencias de la paciente indican instaurar un tratamiento por debajo de los umbrales de FRAX.
¿CON QUÉ TRATAR?
La decisión de iniciar el tratamiento y la selección del tipo de tratamiento debe basarse, como ya hemos señalado, en la necesidad de reducir el riesgo de fractura. Estas decisiones deben tener en cuenta las características de cada caso específico: edad, sexo, función renal, alergias a medicamentos, comorbilidades, tratamientos previos, contraindicaciones, costos, etc. También se recomienda tener en cuenta la baja adherencia general a la terapia de osteoporosis[4].
Según su mecanismo de acción, los fármacos indicados en el tratamiento de la osteoporosis se clasifican de la siguiente manera: Antirresortivos (bifosfonatos, SERMs, terapia hormonal en la menopausia (THM), Denosumab); y formadores o anabólicos óseos (Parathormona (PTH)).
Esqueleto humano
Autor/a: Hubert Ludwig
Fuente: Wikimedia Commons
ANTIRRESORTIVOS
Estrógenos – Terapia Hormonal en la Menopausia (THM)
La terapia de sustitución hormonal tiene como indicación primaria los síntomas vasomotores propios de la menopausia, reconociendo como efecto benéfico adicional muy importante la protección ósea. Se puede afirmar que, aunque la THM interviene de diferentes maneras sobre el metabolismo del calcio y la masa ósea, su principal efecto es como antirresortivo, y modula además la expresión de diferentes citoquinas, entre las que destacan la IL-6, el factor de necrosis tumoral y la IL-7[5].
En el año 2002, cuando se publica el informe del Estudio de Iniciativa de Salud de las Mujeres (WHI)[6], se confirman los hallazgos de beneficios de la THM sobre riesgo de fracturas. A pesar de las deficiencias que se han ido demostrando en el diseño de este estudio, en el tema de osteoporosis se considera que arroja conclusiones definitivas. En la publicación inicial, que incluye algo más de 16.000 mujeres aleatorizadas en dos grupos -uno de ellos recibió tratamiento activo con estrógenos conjugados en dosis de 0.625 mg diarios asociados a acetato de medroxiprogesterona 2.5 mg-, se concluye que el grupo de estudio mostró una incidencia menor muy significativa de fracturas tanto de cadera como vertebrales[6].
Independientemente del tipo de estrógeno o de la vía por la cual se utilice, hay aumento de la densidad ósea con cualquier estrógeno sistémico en un porcentaje que es significativamente mayor que con el placebo. Se puede decir que en un lapso de dos años, se han demostrado incrementos cercanos al 4% de la masa ósea de columna y del 2% de fémur[7].
Moduladores selectivos del receptor estrogénico
Los SERM o moduladores selectivos de los receptores estrogénicos son compuestos químicos que carecen de la estructura de los esteroides, pero que interactúan con los receptores de estrógeno (RE) como agonistas o antagonistas dependiendo del tejido diana[8].
Los dos SERM que tenemos en España con indicación para el tratamiento de la osteoporosis son raloxifeno y bazedoxifeno[8].
Raloxifeno
Este benzotiofeno fue diseñado originalmente como un medicamento para tratar el cáncer de mama. Sin embargo, su desarrollo clínico se centró después en la prevención y tratamiento de la osteoporosis postmenopáusica y se convirtió en el primer SERM con licencia para esta indicación[8].
El raloxifeno (RLX) está indicado para la prevención y el tratamiento de la osteoporosis en mujeres posmenopáusicas en los Estados Unidos y Europa. De acuerdo con un meta-análisis que incluyó siete estudios clínicos, RLX en dosis de 60 mg al día redujo el riesgo de fractura vertebral en un 40% (RR, 0,60, IC 95%, 0,49 a 0,74) r[9]. El uso de raloxifeno se ha asociado con un aumento de los síntomas vasomotores, en particular los sofocos y calambres en piernas[10,11]. También se ha relacionado con un aumento del riesgo de trombosis venosa[10,11].
Bazedoxifeno
Bazedoxifeno (BZA) es un SERM de tercera generación derivado del indol, con los anillos de fenilo que sirven para unirse a los receptores estrogénicos. Fue desarrollado para la prevención y el tratamiento de la osteoporosis posmenopáusica[8].
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Se realizó un estudio de referencia fase III para evaluar la eficacia y la seguridad de BZA en la prevención de fracturas en mujeres posmenopáusicas con osteoporosis (55 a 85 años de edad)[12]; la incidencia de nuevas fracturas vertebrales fue significativamente menor (p <0,05) con bazedoxifeno 20 mg (2,3%), bazedoxifeno 40 mg (2,5%), y raloxifeno 60 mg (2,3%) en comparación con placebo (4,1%), con reducciones del riesgo relativo del 42%, 37%, y 42%, respectivamente. La incidencia de fracturas no vertebrales con bazedoxifeno o raloxifenono no fue significativamente diferente del placebo. En un análisis post hoc de un subgrupo de mujeres con riesgo de fractura más elevado (cuello femoral T-score≤-3,0 Y / o ≥ 1 fractura vertebral moderada o grave o múltiples fracturas vertebrales leves; n = 1772), bazedoxifeno 20 mg mostró una reducción del 50% y del 44% en fracturas no vertebrales; el riesgo relativo con respecto a placebo fue de p = 0,02 y con respecto a 60 mg de raloxifeno p = 0,05, respectivamente.
El número de trastornos cardíacos y cerebrovasculares reportados tras 7 años de bazedoxifeno fue igualmente bajo entre todos los grupos con bazedoxifeno y semejantes a placebo[13]. El riesgo de trombosis venosa profunda fue significativamente mayor con bazedoxifeno que placebo, observándose después de 3 años de tratamiento[13]. Después de 3, 5 y 7 años, no hubo diferencias en la incidencia de cáncer de mama entre los diferentes grupos de BZA y placebo[13]. BZA ha demostrado un perfil endometrial favorable después de más de 7 años de tratamiento[13]. Los únicos efectos adversos que aumentaron con BZA frente a placebo fueron sofocos (p <0,001) y calambres en las piernas (p <0,01). La mayoría de las reacciones adversas que ocurrieron durante los ensayos clínicos fueron de leves a moderadas en severidad y no dieron lugar a la suspensión del tratamiento[13].
BZA 20 mg al día reduce el riesgo de fracturas vertebrales y no vertebrales en un grupo de alto riesgo. También ha demostrado seguridad mamaria y endometrial tras 7 años de uso.
![Efectos de la osteoporosis Efectos de la osteoporosis Autor/a de la imagen: BruceBlaus [When using this image in external sources it can be cited as: Blausen.com staff (2014). "Medical gallery of Blausen Medical 2014". WikiJournal of Medicine 1 (2). DOI:10.15347/wjm/2014.010. ISSN 2002-4436.] Fuente: Wikipedia](http://farmacosalud.com/wp-content/uploads/2017/07/222-Osteoporosis.jpg)
Efectos de la osteoporosis
Autor/a de la imagen: BruceBlaus
[When using this image in external sources it can be cited as: Blausen.com staff (2014). "Medical gallery of Blausen Medical 2014". WikiJournal of Medicine 1 (2). DOI:10.15347/wjm/2014.010. ISSN 2002-4436.]
Fuente: Wikipedia
Tissue Selective estrogen complex (TSEC)
TSEC es el concepto de añadir a un SERM un estrógeno, formando un ‘complejo estrogénico de tejido selectivo’ (TSEC). En un estudio fase 3[14], los resultados evidenciaron que el complejo TSEC de bazedoxifeno y estrógeno conjugado de origen equino incrementa de manera significativa la densidad mineral ósea (DMO) en columna y cadera, comparado con placebo y con raloxifeno, y en columna comparado con raloxifeno. En los resultados de un conjunto de estudios[15], se demuestra que el complejo TSEC que combina bazedoxifeno a dosis de 20 mg con estrógenos conjugados 0,45 mg o 0,625 mg, es un posible nuevo paradigma en el tratamiento de los síntomas y la pérdida de masa ósea que experimentan las mujeres posmenopáusicas.
Bifosfonatos
Son análogos del pirofosfato, con unión a los cristales de hidroxiapatita y que afectan al número y función de los osteoclastos[16]. Entre los bifosfonatos más usados se encuentran especialmente: alendronato, risedronato, ibandronato y ácido zoledrónico, indicados para el tratamiento en mujeres posmenopáusicas con densitometría ósea en valores de osteoporosis, y de un modo especial si presentan fracturas previas.
En algunos casos se pueden utilizar en mujeres premenopáusicas, aunque no existe la indicación formal. No se han demostrado alteraciones en aquéllas que recibieron bifosfonatos por largos períodos de tiempo y portaron embarazos durante o a posteriori a los mencionados tratamientos[17].
Estas drogas deben administrarse en pacientes cuya función renal presente una filtración glomerular mayor a 30 ml/min.
Siguen siendo el tratamiento más indicado para la osteoporosis (gold standard), y con una eficacia demostrada oscilando en una disminución de entre el 25-50% de nuevas fracturas vertebrales y de cadera[18]. Recientemente, para mejorar el cumplimiento, se ha desarrollado el risedronato gastrorresistente, el cual, al tomarse con la comida, mejora los efectos gastrointestinales manteniendo la eficacia[19].
Dado el potente efecto antirresortivo y la acumulación de los bifosfonatos, existen dos efectos secundarios característicos a todos los antirresortivos potentes (y debido también a la posible disminución del remodelado óseo): son las fracturas atípicas y la osteonecrosis de mandíbula.
Análisis recientes han concluido que el uso de bifosfonatos por más de 5 años incrementa las fracturas atípicas (subtrocanterias y femorales), con un riesgo relativo de 2.74 (1.25-6.02)[20]. La FDA y la EMA han dado una advertencia de su uso prolongado (más de cinco años)[21].
Mandíbula humana, vista anterior
Autor/a de la imagen: Gregory F. Maxwell <gmaxwell@gmail.com> PGP:0xB0413BFA
Fuente: Wikipedia
Se estima que el riesgo de desarrollar una osteonecrosis de mandíbula (ONM) en el contexto de un tratamiento para la osteoporosis está alrededor de 1 caso por 100.000 pacientes/año, teniendo un mayor riesgo las pacientes con ONM previo, con tratamiento de inmunosupresores y con tratamiento prolongado de bifosfonatos. El tratamiento odontológico conservador se podrá realizar en cualquier momento sin precisar supresión del tratamiento con bifosfonatos[22].
Denosumab
Denosumab (DMAB) es un anticuerpo monoclonal humano anti-RANKL [23]. Se trata de un isotipo de la inmunoglobulina IgG2 plenamente humano, con alta afinidad y especificidad por RANKL[24] y que actúa de forma similar a la osteoprotegerina (OPG), esto es, previene la interacción entre RANKL y RANK y reduce la diferenciación, actividad y supervivencia de los osteoclastos, inhibiendo por tanto la resorción ósea. Uno de los riesgos potenciales del uso de moléculas OPG es la generación de anticuerpos que pudieran reaccionar con la OPG endógena. Sin embargo, no se han observado anticuerpos neutralizantes anti-DMAB, probablemente debido a que la estructura del DMAB no se asemeja a la OPG[24].
La acción de DMAB es rápida, prolongada y reversible. La larga duración de su efecto puede atribuirse a su vida media y a su efecto inhibidor de los osteoclastos. Una vez el fármaco ha sido eliminado y los osteoclastos se han regenerado, su efecto antirresortivo desaparece rápidamente. Esta reversibilidad distingue a DMAB de los bisfosfonatos, ya que, a diferencia de ellos, no se incorpora en la matriz del hueso[25].
Dentro de lo que ha sido el desarrollo clínico de DMAB en el tratamiento de la osteoporosis, cabe destacar el estudio de referencia -un ensayo clínico aleatorizado controlado con placebo-, el estudio FREEDOM[26]. En él se incluyeron 7.868 mujeres de 60 a 90 años con T por debajo de -2,5 pero no inferior a -4,0 a las que se administró DMAB a dosis de 60 mg cada 6 meses durante 3 años. En comparación con placebo, DMAB redujo significativamente el riesgo de fracturas vertebrales (reducción relativa del riesgo [RRR] de un 68%), no vertebrales (RRR 20%) y de fractura de cadera (RRR 40%). También se asoció el tratamiento con DMAB con un aumento relativo de la densidad mineral en columna lumbar y cadera. Este estudio se ha prolongado hasta los 10 años, en los que se demuestra el continuo aumento de DMO a todos los niveles, así como aparentemente la eficacia antifractura, aunque este dato, al no existir grupo placebo, deriva de datos indirectos comparativos con los resultados de los tres primeros años[27].
Datos de postcomercialización de 1.252.566 pacientes-año[28] han mostrado una incidencia de 4 casos de fracturas femorales atípicas, todos ellos con toma previa de bifosfonatos. El número de osteonecrosis de mandíbula de todas estas pacientes-año fue de 32, encontrándose como factores de riesgo glucocorticoides, quimioterapia, uso anterior de bifosfonatos, ser añosa y procedimientos dentales invasivos[28].
(imagen modificada) Autor/a del original: DodgertonSkillhause
Fuente: morguefile.com (free photo)
DMAB a dosis de 60 mg cada 6 meses durante 3 años ha demostrado la reducción de fracturas vertebrales y no vertebrales. También ha demostrado eficacia y seguridad tras 10 años de uso.
OSTEOFORMADORES
PTH (1-34) o Teriparatida
La PTHrh1-34 o teriparatida está constituida por los 34 primeros aminoácidos de la molécula de PTH humana obtenidos por técnica del DNA recombinante. Usada diariamente en pacientes con osteoporosis en dosis de 20 mg, la PTH1-34 al año y medio de tratamiento demostró disminuir el 65% del riesgo de fracturas vertebrales, y el 53% de las no vertebrales[29,30].
La teriparatida tiene especial recomendación en el tratamiento de pacientes con osteoporosis severa de ambos sexos y postmenopáusicas mayores de 65 años con osteoporosis densitométricamente comprobada y fractura vertebral prevalente[31].
Debido a su costo elevado, se restringe su uso al tratamiento de los pacientes con más de una fractura por fragilidad y DMO con T-score < -3.5, así como también en aquellos pacientes con nuevas fracturas luego de dos años o más bajo un tratamiento con bifosfonatos. No se recomiendan más de dos años de tratamiento, durante el cual el aporte de calcio debe ser asegurado en aproximadamente 1.5 g/día, así como suplementos adecuados de vitamina D. Se debe controlar la calcemia a los 30 días de tratamiento y la calciuria antes de los 90 días. Elevaciones leves de calcio en sangre y/u orina pueden manejarse con una reducción moderada de su aporte. Cuando se interrumpe su administración, comienza en el primer año la pérdida de masa ósea, por lo que se aconseja dar posteriormente un tratamiento antirresortivo[32].
¿CÓMO TRATAR?
La osteoporosis es una enfermedad crónica que puede requerir tratamiento durante muchos años y requiere no sólo un tratamiento individual, sino también tratamientos secuenciales o combinados. Durante muchos años, hemos utilizado antirresortivos como monoterapia, posicionando cada uno según su mecanismo de acción, la eficacia vertebral y no vertebral y sus efectos secundarios. La aparición de los agentes anabólicos como es la hormona paratiroidea (PTH) (teriparatida (PTH1-34) ha abierto nuevas posibilidades[33]. Los agentes anabólicos son una opción atractiva debido a la estimulación directa de la formación ósea. Un concepto actual en relación con la acción de los agentes anabólicos, está relacionado con su capacidad para estimular los procesos asociados con la formación ósea antes de estimular los procesos asociados con la resorción ósea.
Otro enfoque sería añadir un tratamiento anabólico al tratamiento en curso con antirresortivos, o incluso comenzar con un anabólico y continuar con un antirresortivo. Varias terapias anabólicas y antirresortivas se han combinado en un intento de alcanzar mayor masa ósea y mayor resistencia en comparación con la monoterapia. Sin embargo, hay una clara diferencia en los datos encontrados, dependiendo de si se trata de una población naïve que recibe tratamiento o de una población que ya estaba recibiendo tratamiento antirresortivo. Los datos también dependen del antirresortivo específico que se utiliza[34,35].
El pensamiento inicial fue que, después de usar el tratamiento hormonal, o un SERM, la terapia debería continuar con otros antirresortivos que evitara la pérdida ósea. No obstante, este concepto ha evolucionado con el uso de agentes anabólicos. Debido a que los anabólicos son fármacos dirigidos a mujeres con mayor riesgo de fracturas, la mayoría de los pacientes que comienzan el tratamiento con anabólicos han recibido previamente antirresortivos. Además, los efectos secundarios con el uso prolongado de varios agentes antirresortivos han apoyado la idea de este concepto de la terapia secuencial.
Este es y seguirá siendo el concepto de tratamiento secuencial. Los pacientes que utilizan tratamiento antirresortivo, bifosfonatos, o SERMs, con fracaso terapéutico después de muchos años y/o haber tenido una fractura, se trasladan a la terapia anabólica (Fig. 1).
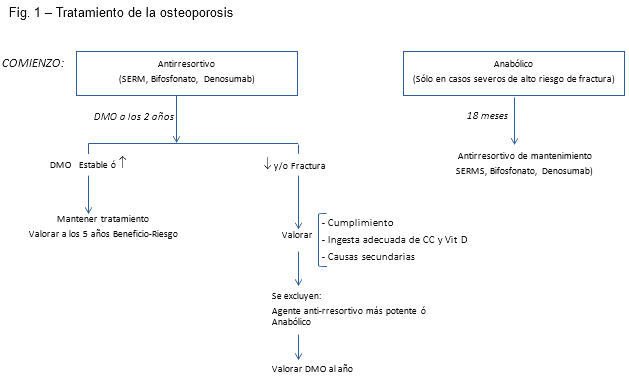
Figura 1
Fuente: Elaboración propia del Dr. Palacios
Mantener o modificar el tratamiento antirresortivo depende en gran medida de la DMO. La densidad ósea debe ser reevaluada al menos después de 2 años y, si es estable o aumentada, se puede volver a verificar después de 5 años. Si la DMO disminuye después de 2 años y/o hay una fractura, el médico debe verificar si hay cumplimiento con el tratamiento. Si el cumplimiento es bueno, es importante controlar la ingesta de calcio (1200 mg) y vitamina D (600-800 UI) y el ejercicio. En las mujeres que están perdiendo hueso, el médico debe considerar las causas secundarias de la pérdida ósea y las patologías asociadas, como una alta ingesta de alcohol. Una vez que se excluyen las causas secundarias de pérdida de masa ósea, debe considerarse un agente antirresortivo más potente o una terapia secuencial con un agente anabólico. La DMO debe ser revisada nuevamente después de un año para evaluar la respuesta. Si es estable, se puede volver a comprobar a los 5 años (Fig. 1)[33].
Según las pruebas actuales, el cambio a la teriparatida sola o en combinación con un tratamiento antirresortivo parece proporcionar beneficios adicionales en relación con diferentes parámetros como la DMO y la resistencia ósea. Sin embargo, cabe señalar que, con respecto a la terapia anabólica, ya sea combinada o secuencial, no hay estudios con determinación de la fractura como la principal variable de resultado[33]. Actualmente, los análogos de la hormona paratiroidea suelen estar indicados durante 18-24 meses en pacientes con osteoporosis severas y de alto riesgo; posteriormente a su uso, se recomienda la terapia secuencial con un agente antirresortivo para mantener el aumento de la masa ósea y apoyar la mineralización secundaria del hueso recién formado[36]. Una posible tendencia en el futuro, en según qué casos, podría ser comenzar con un anabólico e incrementar la masa ósea de forma importante, para después mantener lo ganado con un antirresortivo (Fig. 1)[33].
Bibliografía
1. Camacho PM, Petak SM, Binkley N, Clarke BL, Harris ST, Hurley DL, Kleerekoper M, Lewiecki EM, Miller PD, Narula HS, Pessah-Pollack R, Tangpricha V, Wimalawansa SJ, Watts NB. American Association Of Clinical Endocrinologists And American College Of Endocrinology Clinical Practice Guidelines For The Diagnosis And Treatment Of Postmenopausal Osteoporosis - 2016. Endocr Pract. 2016 Sep 2;22(Suppl 4):1-42
2. Ethel S. Siris, MD; Ya-Ting Chen, PhD; Thomas A. Abbott, PhD; Elizabeth Barrett-Connor, MD;Paul D. Miller, MD; Lois E. Wehren, MD; Marc L. Berger, MD. Bone Mineral Density Thresholds for Pharmacological Intervention to Prevent Fractures. Arch Intern Med. 2004; 164:1108-1112.
3. Bliuc D1, Nguyen ND, Nguyen TV, Eisman JA, Center JR. Compound risk of high mortality following osteoporotic fracture and refracture in elderly women and men.J Bone Miner Res. 2013 Nov; 28(11):2317-24.
4. Palacios S, Christiansen C, Sánchez Borrego R, Gambacciani M, Hadji P, Karsdal M, Lambrinoudaki I, Lello S, O'Beirne B, Romao F, Rozenberg S, Stevenson JC, Ben-Rafael Z. Recommendations on the management of fragility fracture risk in women younger than 70 years. Gynecol Endocrinol. 2012 Oct;28(10):770-86.
5. Baber RJ, Panay N, Fenton A; IMS Writing Group 2016 IMS Recommendations on women's midlife health and menopause hormone therapy. Climacteric. 2016 Apr;19(2):109-50.
6. Writing Group for the Women´s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women. JAMA 2002;288:321-333
7. Lobo RA. The rationale for low-dose hormonal therapy. Endocrine 2004; 24:217-21.
8. Palacios S. Selective estrogen receptor modulators: the future in menopausal treatment. Minerva Ginecol. 2011 Jun;63(3):275-86
9. Seeman E, Crans GG, Diez-Perez A, Pinette KV, Delmas PD. Anti-vertebral fracture efficacy of raloxifene: a meta-analysis. Osteoporos Int 2006;17(February (2)):313–6.
10. Siris ES, Harris ST, Eastell R, et al. Skeletal effects of raloxifene after 8 years: results from the continuing outcomes relevant to Evista (CORE) study. J Bone Miner Res 2005;20(September (9)):1514–24.
11. Vogel VG, Costantino JP, Wickerham DL, et al. Effects of tamoxifen vs. raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 trial. JAMA 2006;295(23):2727–41.
12. Silverman SL, Christiansen C, Genant HK, et al. Efficacy of bazedoxifene in reducing new vertebral fracture risk in postmenopausal women with osteoporosis: results from a 3-year, randomized, placebo- and active-controlled clinical trial. J Bone Miner Res 2008;23:1923–34.
13. Palacios S, de Villiers TJ, Nardone Fde C, Levine AB, Williams R, Hines T, Mirkin S, Chines AA; BZA Study Group. . Assessment of the safety of long-term bazedoxifene treatment on the reproductive tract in postmenopausal women with osteoporosis: results of a 7-year, randomized, placebo-controlled, phase 3 study. Maturitas. 2013 Sep;76(1):81-7.
14. Lindsay R, Gallagher JC, Kagan R, Pickar JH,Constantine G. Efficacy of tissue- selective estrogen complex (TSEC) of bazedoxifene/conjugated estrogens (BZA/CE) for osteoporosis prevention in at-risk postmenopausal women. Fertil Steril 2009; 92:1045-1052.
15. Gallagher JC, Palacios S, Ryan KA, Yu CR, Pan K, Kendler DL, Mirkin S, Komm BS. Effect of conjugated estrogens/bazedoxifene on postmenopausal bone loss: pooled analysis of two randomized trials. Menopause. 2016 Oct;23(10):1083-9
16. Fleisch H. Bisphosphonates: mechanisms of action. Endocr Rev. 1998 Feb;19(1):80-100.32.
17. Suresh E, Pazianas M, Abrahamsen B. Safety issues with bisphosphonate therapy for osteoporosis. Rheumatology (Oxford). 2014 Jan;53(1):19-31
18. Alejandro P, Constantinescu F. A Review of Osteoporosis in the Older Adult: An Update. Rheum Dis Clin North Am. 2018 Aug;44(3):437-451
19. Guzman ML, Soria EA, Laino C, Manzo RH, Olivera ME.Reduced food interaction and enhanced gastrointestinal tolerability of a new system based on risedronate complexed with Eudragit E100: Mechanistic approaches from in vitro and in vivo studies.Eur J Pharm Biopharm. 2016 Oct;107:263-72
20. Park-Wyllie LY, Mamdani MM, Juurlink DN, Hawker GA, Gunraj N, Austin PC, Whelan DB, Weiler PJ, Laupacis A.Bisphosphonate use and the risk of subtrochanteric or femoral shaft fractures in older women.JAMA. 2011 Feb 23;305(8):783-9.
21. FDA news release-available at: http://www.fda.gov/newsEvents. Febrery 26.2011.
22. Sosa Henriquez, M, Gomez de Tejada Romero M J, Began Sebastian J V, et al. Osteonecrosis de los maxilares: Documento de consenso. Rev osteoporos Metab Miner 2009;1; 1; 41-51
23. Neyro J, Jesús Cancelo M, Palacios S. [Inhibition of RANK-L in the pathophysiology of osteoporosis. Clinical evidences of its use].Ginecol Obstet Mex. 2013 Mar;81(3):146-57. Review. Spanish
24. Palacios S, Kalouche-Khalil L, Rizzoli R, Zapalowski C, Resch H, Adachi JD, Gallagher JC, Feldman RG, Kendler DL, Wang A, Wagman RB, Adami S. Treatment with denosumab reduces secondary fracture risk in women with postmenopausal osteoporosis. Climacteric. 2015;18(6):805-12.
25. Lewiecki EM. Denosumab: an investigational drug for the management of postmenopausal osteoporosis. Biologics. 2008;2:645-53.
26. Cummings SR, San Martin J, McClung MR, Siris ES, Eastell R, Reid IR, et al; FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009;361:756-65.
27. Diédhiou D, Cuny T, Sarr A, Norou Diop S, Klein M, Weryha G Efficacy and safety of denosumab for the treatment of osteoporosis: A systematic review. Ann Endocrinol (Paris). 2015 Dec;76(6):650-7
28. M. Geller, R. B. Wagman, P. R. Ho , S. Siddhanti, C. Stehman-Breen, N. B. Watts, S. Papapoulos . . M. Geller, R. B. Wagman, P. R. Ho , S. Siddhanti, C. Stehman-Breen, N. B. Watts, S. Papapoulos . Early findings from Prolia post-marketing safety surveillance for atypical femoral fracture, osteonecrosis of the jaw, severe symptomatic hypocalcemia, and anaphylaxis. WCO-IOF-ESCEO 22-5 April 2014. Seville. Spain OC40WCO-IOF-ESCEO 22-5 April 2014. Seville. Spain OC40.
29. Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2004; 344:1434-41.
30. Gallagher JC, Rosen CJ, Chen P, Misurski DA, Marcus R. Response rate to teriparatide in postmenopausal women with osteoporosis. Bone 2006; 39:1268-75.
31. Geusens P, Sambrook P, Lems W. Fracture prevention in men. Nat Rev Rheumatol 2009; 5:497-504.
32. Lou S, Lv H, Li Z, Tang P, Wang Y. Parathyroid hormone analogues for fracture healing: protocol for a systematic review and meta-analysis of randomised controlled trials. BMJ Open. 2018 Jan 23;8(1):e019291
33. Palacios S, Mejía A. Antiresorptives and anabolic therapy in sequence or combination for postmenopausal osteoporosis. Climacteric. 2015;18(4):453-5
34. Cosman F. Anabolic and antiresorptive therapy for osteoporosis: combination and sequential approaches. Curr Osteoporos Rep 2014;12:385–95
35. Meier C, Lamy O, Krieg MA, et al. The role of teriparatide in sequential and combination therapy of osteoporosis. Swiss Med Wkly 2014;144:w13952
36. Anagnostis P, Gkekas NK, Potoupnis M, Kenanidis E, Tsiridis E, Goulis DG. New therapeutic targets for osteoporosis. Maturitas. 2019 Feb;120:1-6





