Guillermo González Castilla
Introducción
En la actualidad, existe ya la suficiente evidencia científica como para afirmar que el uso de probióticos no sólo es seguro y eficaz como tratamiento, sino también como prevención de determinadas enfermedades.
Los resultados obtenidos en numerosos ensayos clínicos han posibilitado grandes avances en el desarrollo de medicamentos probióticos, que contienen fundamentalmente lactobacilos y bifidobacterias, y que constituyen nuevas terapias que vienen a ampliar el arsenal terapéutico para el tratamiento de afecciones que, hasta ahora, se abordaban con otro tipo de fármacos que, en ocasiones, producían efectos secundarios, falta de adherencia o ineficiencia a medio o largo plazo.
Los avances en la investigación sobre los mecanismos de acción y las dianas terapéuticas de los probióticos, que actúan incrementando la población de los microorganismos de la microbiota y mejorando los mecanismos de defensa del cuerpo humano ante ciertos patógenos, está revolucionando el abordaje de enfermedades que, hasta ahora, no disponían de alternativas farmacológicas de amplio espectro tan eficaces, como sucedía en el caso del síndrome del colon irritable (SCI) o en algunas infecciones genitourinarias.

Gracias al desarrollo de estos nuevos productos, el empleo de probióticos está aumentando de manera importante en nuestro país, tanto en la dieta diaria de la población, como en la práctica clínica. Asimismo, la mayor divulgación y conocimiento de los beneficios asociados a su consumo está provocando que sean productos muy bien aceptados por el usuario y por el paciente.
¿Qué son exactamente los probióticos?
Los probióticos son organismos vivos que, ingeridos en la cantidad adecuada, resultan beneficiosos y saludables para el organismo, dado que contribuyen al equilibrio de la microbiota intestinal del huésped así como a potenciar el sistema inmunitario.
En concreto, los probióticos son preparados farmacéuticos a base de microorganismos vivos que se estudian, se formulan, y se ponen a prueba al igual que se hace con cualquier otro producto farmacéutico.
Los probióticos deben cumplir unos criterios científicos y de calidad, como que estén caracterizados a nivel genómico y determinadas sus propiedades y cómo actúan. Asimismo, deben estar vivos y ser capaces de alcanzar el colon y adherirse a él. Todo ello, respaldado por estudios que hayan demostrado su actividad biológica.
Microbiota y regulación del sistema inmune
El concepto de flora intestinal, a partir de ahora denominado microbiota, ha cambiado por completo en los últimos 15 años (ver Figura 1). El término microbiota se refiere a la comunidad de microorganismos vivos: bacterias, hongos y virus, residentes en el organismo humano.
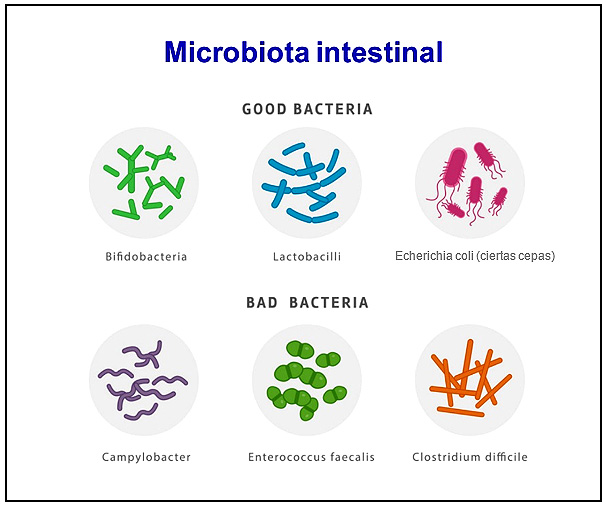
Figura 1. Microbiota intestinal
Dos conceptos fundamentales sobre dicha microbiota son el balance existente entre las diferentes bacterias, hongos y virus; y su diversidad. En la enfermedad inflamatoria, como en el caso del síndrome del intestino irritable o en cualquier otro síndrome metabólico, se observa una disminución de la diversidad de la microbiota.
La microbiota puede verse alterada no sólo por determinadas enfermedades, sino también por estrés, uso de antibióticos, alteraciones fisiológicas del intestino, cambios en la dieta o, también, por la colonización e infección del intestino por patógenos. Afortunadamente, hoy en día contamos con la capacidad de modificarla gracias a la acción de los probióticos.
SCI y Bifidobacterium longum 35624®
El SCI es un síndrome multifactorial en el que están implicados diversos mecanismos patogénicos, con una alta prevalencia (aproximadamente el 10% de la población), y un gran impacto en la calidad de vida del paciente. La alteración de la barrera intestinal puede provocar efectos dañinos al permitir la entrada de patógenos, que irritan el intestino y modifican la microbiota.
Tras 15 años de investigación clínica y numerosos ensayos clínicos, desde 2016 se dispone en España de Alflorex® para Colon Irritable, comercializado por Farmasierra Laboratorios. Alflorex® para Colon Irritable es el único probiótico que ha demostrado su eficacia en la reducción de los síntomas del SCI[1], gracias a su alto contenido de bacteria Bifidobacterium longum 35624®, que tiene un efecto beneficioso sobre el intestino al actuar frente a los microorganismos patógenos mediante su adhesión a la pared intestinal[2].
Diversos ensayos clínicos han demostrado que Bifidobacterium longum 35624® reduce los principales síntomas que sufren las personas que padecen el SCI, como el dolor abdominal, hinchazón, flatulencia, estreñimiento y diarrea. Alflorex® para Colon Irritable reduce los marcadores inflamatorios en tres enfermedades que causan procesos inflamatorios como son la colitis ulcerosa, la psoriasis y la fatiga crónica.

Mecanismo de adhesión y seguridad
La cepa Bifidobacterium longum 35624® actúa mediante su adhesión a las células epiteliales y al moco de la pared intestinal, mejorando y fortaleciendo la barrera intestinal, al ejercer un efecto calmante y de protección del intestino irritado[3] (ver Figura 2).
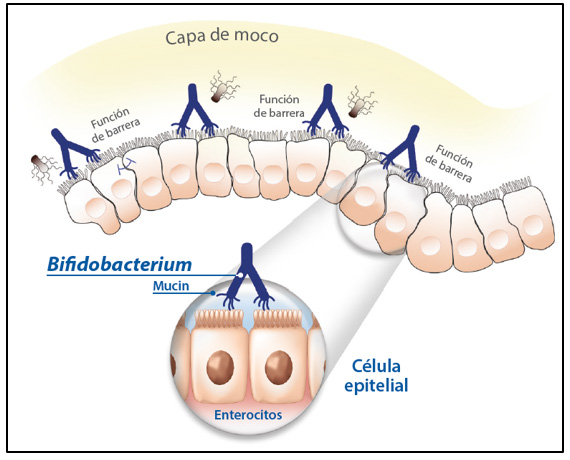
Figura 2: Mecanismo de adhesión
Fuente: Juntunen M, Kirjavainen PV, Ouwehand AC, Salminen SJ, Isolauri E. Adherence of probiotic bacteria to human intestinal mucus in healthy infants and during rotavirus infection. Clin Diag Lab Immunol 2001;8:293–296.
Los ensayos clínicos realizados avalan la seguridad de este probiótico para el tratamiento del SCI, cuyos resultados son equivalentes a los obtenidos en los grupos en los que se les administraba placebo[4], y han demostrado que los beneficios en relación a la calidad de vida de los pacientes con SCI se mantienen con la toma de una dosis diaria durante cuatro semanas o más.
Hay que tener en cuenta que hay dos factores que determinan la efectividad de los probióticos en relación a patologías concretas, como son la cepa de la bacteria seleccionada (los beneficios en cada patología son específicos de cada cepa) y la concentración adecuada de la misma. Con respecto al SCI, sólo Bifidobacterium longum 35624® ha demostrado ser efectiva, como se señala en el informe sobre Probióticos y Prebióticos publicado en 2011 por la Organización Mundial de Gastroenterología[5].
En 2013 se realizó un estudio doble-ciego y aleatorizado[6], con el objetivo de comparar la excreción fecal de B. longum 35624 antes, durante y después de un tratamiento diario durante 8 semanas en personas con SCI que recibieron el suplemento oral encapsulado (n=39) o placebo (n=37), y en sujetos sanos que también recibieron el suplemento (n=41). En segundo lugar, se determinaron los cambios en la microbiota fecal evaluada y los síntomas del SCI.
Los resultados demostraron que la suplementación aumentó significativamente la excreción fecal de B. longum 35624 frente a placebo en sujetos con SCI. La excreción en sujetos sanos que recibieron suplemento fue cuantitativamente similar. Los niveles fecales de B. longum 35624 disminuyeron y volvieron a los niveles basales una vez que cesó la administración de suplementos orales, lo que indica su transitoriedad.
Según se pudo constatar en otro trabajo realizado en 2017[7] con el objetivo de confirmar el tránsito de Bifidobacterium longum 35624 por el tracto gastrointestinal, independientemente de la forma de administración, la cepa se detectó en heces en el día 7 a niveles superiores a 1×104 UFC/g. A una dosis de 108 UFC, una vez/día, es una cepa estable y fácil de administrar[8], que debería usarse con más frecuencia.
![]()
Aunque no se han realizado apenas estudios sobre el uso de probióticos en niños pequeños sanos de países pobres, destaca un ensayo clínico aleatorizado de fase I[9] en el que se incluyeron 160 recién nacidos (lactantes sanos de entre 4 a 12 semanas) de barrios urbanos marginales de Bangladesh. El objetivo del ensayo fue estudiar la seguridad y tolerancia de Lactobacillus reuteri DSM 17938 y Bifidobacterium longum 35624, administrados en tres diferentes pautas de dosificación más un brazo placebo. Los resultados observaron que la combinación de estos dos probióticos, incluso administrados diariamente, es segura y bien tolerada en los recién nacidos incluidos en el ensayo.
Otros estudios han demostrado que B. longum 35624 tiene efectos antiinflamatorios con respecto a la salmonella. El daño inducido por salmonela en el intestino delgado puede disminuir la actividad enzimática asociada a las vellosidades, causando una mala absorción de nutrientes y diarrea. En uno de los primeros ensayos[10] en los que se utilizaron probióticos para estudiar sus posibles efectos beneficiosos sobre la actividad enzimática, se comprobó que el tratamiento con B. longum 35624 sobre ratones atenuaba el efecto de la infección por salmonella sobre la actividad enzimática del borde en cepillo y la pérdida de peso.
En definitiva, todas las guías terapéuticas sobre el SCI señalan el uso de probióticos como una opción de tratamiento para mejorar su sintomatología, aunque en España no se disponía de ninguno que hubiese demostrado su eficacia, hasta la comercialización de Alflorex® para Colon Irritable. Un probiótico seguro, eficaz y al alcance de todos los pacientes afectados por el SCI que quieran mejorar los síntomas globales que más afectan a su calidad de vida.
CONCLUSIONES
• Los probióticos incrementan la población de los microorganismos de la microbiota y mejoran los mecanismos de defensa del cuerpo humano ante ciertos patógenos.
• La microbiota puede verse alterada no sólo por determinadas enfermedades, sino también por estrés, uso de antibióticos, alteraciones fisiológicas del intestino, cambios en la dieta o, también, por la colonización e infección del intestino por patógenos.
• Bifidobacterium longum 35624® ha demostrado su eficacia en la reducción de los síntomas que más afectan a la calidad de vida de las personas con SCI, como hinchazón, dolor abdominal, flatulencia, estreñimiento y diarrea.
• La cepa Bifidobacterium longum 35624® actúa mediante su adhesión a las células epiteliales y al moco de la pared intestinal, mejorando y fortaleciendo la barrera intestinal, al ejercer un efecto calmante y de protección del intestino irritado.
• Alflorex® para Colon Irritable es el único probiótico que ha demostrado su eficacia en la reducción de los síntomas del SCI, contiene 1x109 bacterias por cápsula y mantiene una dosis apropiada durante el periodo de caducidad (2 años) con un correcto almacenamiento, y no es necesario conservar en frío.
Referencias
1. Alflorex® for IBS is a Medical Device Class IIb and fulfills the requirement for CE marking (CE0477). It is intended to
reduce the symptoms of IBS.
2. Von Wright A, Vilpponen-Salmela T, Llopis MP, Collins K, Kiely B, Shanahan F, et al. The survival and colonic adhesion of Bifidobacterium infantis in patients with ulcerative colitis. International Dairy Journal.2002;12;197-200.
3. Juntunen M, Kirjavainen PV, Ouwehand AC, Salminen SJ, Isolauri E. Adherence of probiotic bacteria to human intestinal mucus in healthy infants and during rotavirus infection. Clin Diag Lab Immunol 2001;8:293–296.
4. Catanzaro D, Quigley E, Wycherley C, Tillisch K. Tolerability and Safety of the Probiotic Bifidobacterium infantis 35624: Review of Clinical and Postmarketing Data. Can J Gastroenterol. 2011;25(Suppl A):A-47.
5. Guarner F, Khan AG, Garisch J, Eliakim R, Gangl A, Thomson A, et al. World gastroenterology organisation global guidelines: probiotics and prebiotics October 2011. J Clin Gastroenterol (2012) 46(6):468–81.
6. Charbonneau D, Gibb RD, Quigley EM. Fecal excretion of Bifidobacterium infantis 35624 and changes in fecal microbiota after eight weeks of oral supplementation with encapsulated probiotic. Gut Microbes. 2013 May-Jun;4(3):201-11.
7. Healy S, Casey M, Kiely B, Quigley EM, Shanahan F, et al. The bifidobacterium longum 35624® culture transits in high numbers through the human gut. Gut, supl. Supplement 1; London Tomo 66 (Apr 2017): A25.
8. Moayyedi P, Ford AC, Talley NJ, Cremonini F, Foxx-Orenstein AE, Brandt LJ, et al. The efficacy of probiotics in the treatment of irritable bowel syndrome: a systematic review. Gut. 2010 Mar;59(3):325–32.
9. Hoy-Schulz YE, Jannat K, Roberts T, Zaidi SH, Unicomb L, Luby S, et al. Safety and acceptability of Lactobacillus reuteri DSM 17938 and Bifidobacterium longum subspecies infantis 35624 in Bangladeshi infants: a phase I randomized clinical trial. BMC Complement Altern Med. 2016 Feb 2;16:44.
10. Symonds EL1, O'Mahony C, Lapthorne S, O'Mahony D, Sharry JM, O'Mahony L, et al. Bifidobacterium infantis 35624 protects against salmonella-induced reductions in digestive enzyme activity in mice by attenuation of the host inflammatory response. Clin Transl Gastroenterol. 2012 May 10;3:e15.




