Redacción Farmacosalud.com
MSD ha anunciado que la Food and Drug Administration (FDA, en Estados Unidos) ha dado luz verde a la nueva solicitud de aprobación (sNDA, por sus siglas en inglés) para el uso de ZERBAXA (ceftolozano y tazobactam) para el tratamiento de pacientes de 18 años o mayores con neumonía adquirida en el hospital y neumonía asociada a ventilación mecánica (NAH y NAVM) provocada por los siguientes microorganismos Gram-negativos susceptibles: Enterobacter cloacae, Escherichia coli, Haemophilus influenzae, Klebsiella oxytoca, Klebsiella pneumoniae, Proteus mirabilis, Pseudomonas aeruginosa, y Serratia marcescens. La FDA concedió previamente el estatus de revisión prioritaria a esta solicitud.
Esta ampliación de su uso se ha basado en los resultados del ensayo clínico pivotal Fase 3 ASPECT-NP que comparó ceftolozano y tazobactam 3g (2g ceftolozano / 1g tazobactam) por vía intravenosa cada 8 horas frente a meropenem (1g por vía intravenosa cada 8 horas) entre 8 y 14 días para el tratamiento de pacientes adultos con NAH y NAVM.
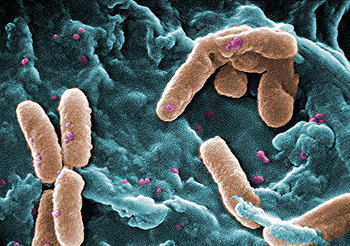
P. aeruginosa al microscopio de barrido
Autor/a de la imagen: Photo Credit: Janice Haney Carr Content Providers(s): CDC/ Janice Haney Carr - This media comes from the Centers for Disease Control and Prevention's Public Health Image Library (PHIL), with identification number #10043. Note: Not all PHIL images are public domain; be sure to check copyright status and credit authors and content providers
Fuente: Wikipedia
La NAVM, asociada a una morbilidad y mortalidad sustanciales
Ceftolozano y tazobactam está contraindicado en la Unión Europea en caso de hipersensibilidad a los principios activos o a alguno de los excipientes; hipersensibilidad a cualquier medicamento antibacteriano con cefalosporina; hipersensibilidad grave (por ejemplo, reacción anafiláctica, reacción cutánea grave) a cualquier otro tipo de agente antibacteriano beta-lactámico (por ejemplo, penicilinas o carbapenemes).
“La neumonía en pacientes con ventilación mecánica continúa siendo un reto clínico importante y se asocia a una morbilidad y mortalidad sustanciales”, señala el Dr. Andrew Shorr, jefe de servicios de cuidados críticos pulmonares y respiratorios del Hospital Medstar Washington, en Washington, D.C. “A este desafío se suma la necesidad de cubrir diversos patógenos, entre los que se incluyen Pseudomonas aeruginosa y algunas Enterobacteriaceae”. De acuerdo con una reciente publicación de la Foundation for the National Institutes of Health Biomarkers Consortium, los pacientes con NAH ventilada tienen una tasa de mortalidad mayor (39%) que los pacientes con NAVM (27%). Además, el patógeno Gram-negativo Pseudomonas aeruginosa es el más común en NAH y NAVM y cada vez es más difícil de tratar.
Ceftolozano + tazobactam vs. meropenem
Un total de 726 pacientes en edad adulta hospitalizados con NAH y NAVM participaron en un estudio internacional y doble ciego (NCT 02070757) que comparó la administración por vía intravenosa de 2g de ceftolozano y 1g de tazobactam cada 8 horas frente a meropenem (1g cada 8 horas por vía intravenosa) durante 8-14 días de terapia. En la aleatorización, todos los pacientes tenían que estar intubados y con ventilación mecánica. La eficacia se evaluó teniendo en cuenta la mortalidad por cualquier causa en el día 28 y curación clínica, definida como resolución completa o mejora significativa en los signos y síntomas del índice de infección en el Test de curación (TOC, por sus siglas en inglés) que tuvo lugar entre los 7 y 14 días tras la finalización del tratamiento. El análisis se realizó sobre la población por intención de tratar, que incluyó a todos los pacientes aleatorizados.
La media de edad de los 726 pacientes en la población por intención de tratar fue de 62 años. El 44% de ellos tenía 65 años o más y un 22% 75 años o más. La mayoría de los pacientes eran de piel blanca (83%), hombres (71%) y procedían de Europa del Este (64%). La puntuación media de APACHE II fue de 17 y un 33% de los pacientes obtuvieron una puntuación basal igual o mayor a 20. Todos los pacientes se encontraban con ventilación mecánica y 519 (71%) tenían NAVM. En la aleatorización, la mayoría de los pacientes habían estado hospitalizados durante 5 días o más (77%) y estuvieron en la UCI (92%), y el 49% de pacientes estuvieron con ventilación mecánica durante 5 días o más. Al inicio del estudio, el 36% de los pacientes presentaban aclaramiento de creatinina (CrCl, por sus siglas en inglés) inferior a 80 ml/min. De estos, el 14% tuvo CrCI inferior a 50 ml/min.
Una Unidad de Cuidados Intensivos
(Imagen modificada) Original y fuente: This file comes from Wellcome Images, a website operated by Wellcome Trust, a global charitable foundation based in the United Kingdom http://wellcomeimages.org/indexplus/obf_images/47/9f/530376e6628883b0c1e0897a4d28.jpg
Gallery: http://wellcomeimages.org/indexplus/image/L0075034.html
Difusión: Wikimedia Commons
Aproximadamente el 13% de los pacientes no habían respondido al tratamiento antibacteriano de ese momento para la NAH o NAVM, y en el 15% de los pacientes la bacteriemia estaba presente al inicio. Las principales comorbilidades incluían diabetes mellitus, insuficiencia cardíaca congestiva y enfermedad pulmonar obstructiva crónica (EPOC), con unas tasas del 22%, 16% y 12%, respectivamente.
Ceftolozano y tazobactam fue fue no-inferior a meropenem en cuanto a la mortalidad por cualquier causa en el día 28 en la población por intención de tratar, 24% (87/362) y 25,3% (92/364) respectivamente, con una diferencia del porcentaje ponderado del 1,1 (IC del 95% estratificado: -5,13%, 7,39%; margen de no inferioridad del 10%). Además, ceftolozano y tazobactam fue no-inferior a meropenem en la respuesta clínica del Test de curación (7 a 14 días después del final de la terapia) en la población por intención de tratar, 54,4% (197/362) y 53,3% (194/364) respectivamente, con una diferencia del porcentaje ponderado del 1,1 (IC del 95% estratificado: -6,17, 8,29; margen de no inferioridad del 12,5%).
En el subgrupo NAH se observó una respuesta favorable a ceftolozano y tazobactam en cuanto a la mortalidad por cualquier causa en el día 28, 24,2% (24/99) para ceftolozano y tazobactam y 37% (40/108) para meropenem, respectivamente, con una diferencia del porcentaje ponderado del 12,8 (IC del 95% estratificado: 0,18-24,75). En el caso del subgrupo NAVM, la respuesta favorable en cuanto a la mortalidad por cualquier causa en el día 28 fue del 24% (63/263) para ceftolozano y tazobactam y del 20,3% (52/256) para meropenem, con una diferencia del porcentaje ponderado del -3,6 (IC del 95% estratificado: -10,74, 3,52).

Autor/a: Free-Photos
Fuente: Pixabay (free photo)
Las reacciones adversas, que ocurrieron en un 2% o más de los pacientes que recibieron ceftolozano y tazobactam, incluyeron un aumento de la transaminasa hepática en el 11,9% (43/361), daño renal/insuficiencia renal en el 8,9% (32/361), diarrea en el 6,4% (23/361), hemorragia intracraneal en el 4,4% (16/361), vómitos en el 3,3% (12/361) y colitis por Clostridium difficile en el 2,8% (10/361). La discontinuación del tratamiento debido a reacciones adversas se dio en el 1,1% (4/361) de los que recibieron ceftolozano y tazobactam y en el 1,4% (5/359) de los que recibieron meropenem.
Combinación antibacteriana para perfusión intravenosa
Ceftolozano y tazobactam es una combinación antibacteriana para perfusión intravenosa compuesta por la cefalosporina sulfato de ceftolozano y el inhibidor de beta-lactama satazobactam sódico. La combinación ceftolozano y tazobactam 1,5g (1g. ceftolozano y 0,5 g. tazobactam) está indicada en la Unión Europea para el tratamiento de las siguientes infecciones en adultos: infecciones intraabdominales complicadas, pielonefritis aguda e infecciones del tracto urinario complicadas, según se recoge en la ficha técnica. MSD no recomienda ni promueve otros usos diferentes a los aprobados en la Ficha Técnica.




