Redacción Farmacosalud.com
El Ministerio de Sanidad español ha dado luz verde a la financiación de Tecentriq® (atezolizumab) subcutáneo (SC), la primera y única inmunoterapia para el cáncer que puede ser administrada a través de una inyección subcutánea en aproximadamente siete minutos1,2. Diferentes estudios han mostrado que la mayoría de los pacientes prefieren la administración SC de esta terapia porque pueden beneficiarse de una mayor comodidad con la misma eficacia3-8. De hecho, todos los perfiles de enfermos “que sean candidatos al tratamiento con atezolizumab pueden beneficiarse de la formulación subcutánea. Esto está sustentado por datos de bioequivalencia entre la formulación SC y el resto de estudios pivotales de Tecentriq. Además, tal y como se demostró en el estudio IMscin002, Tecentriq SC es la opción preferente para 7 de cada 10 pacientes… los motivos de su preferencia fue el menor tiempo de administración, el menor estrés emocional que supone esta nueva opción y la mayor comodidad en su aplicación”, asevera la Dra. Mariluz Amador, directora médico de Roche Farma España.
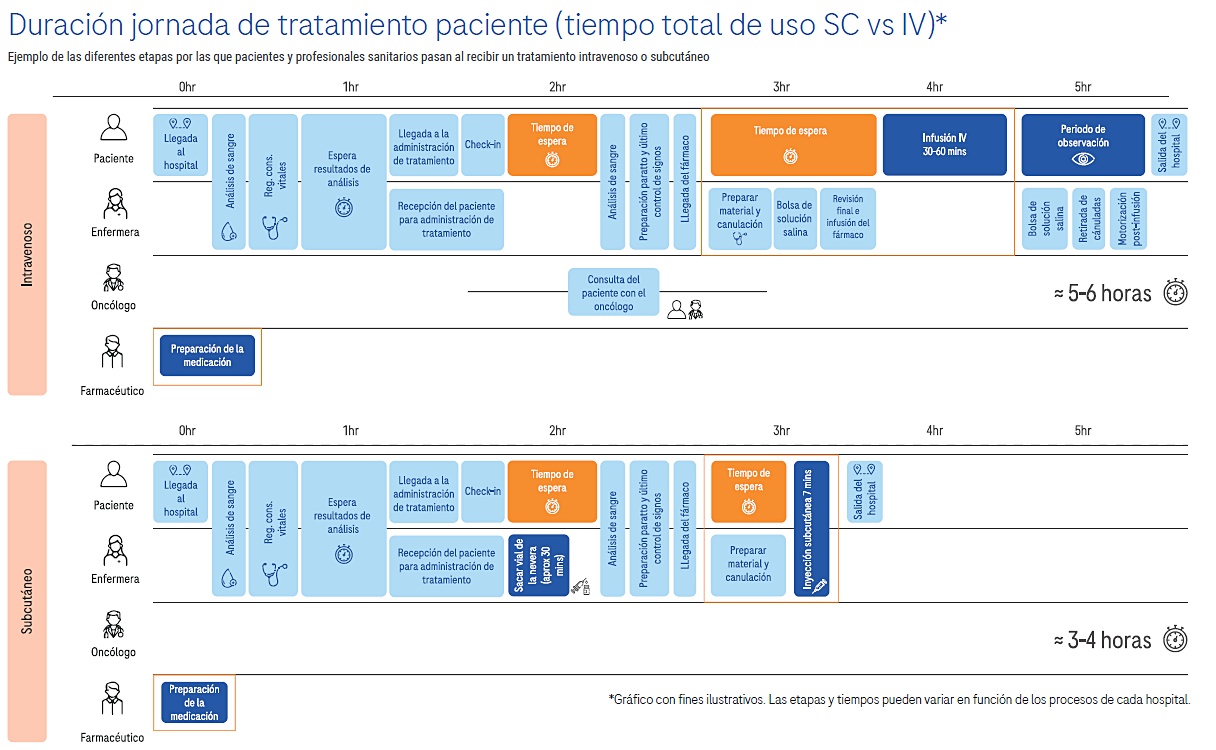
El año pasado, más de 38.000 personas recibieron este fármaco en Europa para tratar distintos tipos de tumores de pulmón, hígado, vejiga y mama1. Hasta ahora, su administración era realizada mediante vía intravenosa (IV), un procedimiento que tiene una duración aproximada de entre 30 y 60 minutos6. La nueva inyección subcutánea reduce el tiempo de tratamiento a aproximadamente siete minutos, con una duración que oscila entre los 4 y los 8 minutos2. La autorización de comercialización de la vía subcutánea se aplica a todas las indicaciones aprobadas para atezolizumab IV en territorio español.
Fuente: Roche / Alabra
1 dosis de 1.875 mg cada tres semanas
La pauta de aplicación de atezolizumab SC es de 1 dosis de 1.875 mg cada tres semanas, mientras que, tal y como se ha apuntado, el tiempo de administración es de aproximadamente unos 7 minutos, disminuyéndose de este modo en un 75% el tiempo de aplicación con respecto a la alternativa intravenosa.
La duración del tratamiento con atezolizumab subcutáneo depende de la indicación en la que se use… hay indicaciones, como el carcinoma hepatocelular avanzado o irresacable, en las que el medicamento “se da hasta pérdida de beneficio clínico o toxicidad inaceptable. Y hay otras como el estadio temprano de cáncer de pulmón no microcítico, en el que se da durante un año, siempre y cuando no haya progresión o toxicidad inaceptable”, detalla la Dra. Amador en declaraciones a www.farmacosalud.com.

Esta inmunoterapia subcutánea está disponible para todas las indicaciones ya financiadas de la formulación IV en tumores de pulmón, mama, hígado y vejiga
CT: células tumorales; CI: células inmunes infiltrantes de tumor; ECOG: puntuación ECOG sobre calidad de vida
Fuente: BIFIMED. Ministerio de Sanidad. Disponible en https://www.sanidad.gob.es/profesionales/medicamentos.do?metodo=verDetalle&cn=764093. Último acceso julio 2024
Difusión: Roche / Alabra
“Esta innovación (atezolizumab subcutáneo) adquiere especial relevancia ante el creciente aumento en la demanda de los servicios de los Hospitales de Día oncológicos, impulsada por un mayor diagnóstico e incidencia del cáncer. Con esta nueva aplicación del tratamiento, reforzamos nuestro compromiso de contribuir a la sostenibilidad del Sistema Nacional de Salud mejorando la experiencia de pacientes, cuidadores y profesionales sanitarios, optimizando los tiempos totales de tratamiento e impactando en el uso eficiente de recursos del sistema. Más allá de desarrollar nuevas terapias, desde Roche apostamos por poder ofrecer tratamientos más flexibles que mejoren la calidad de vida de los pacientes, a la vez que sean coste-efectivos, tanto para los profesionales sanitarios como para la Administración pública”, sostiene Amador mediante un comunicado.
La aprobación de la nueva presentación de la terapia se ha basado en los datos del estudio fase IB/III IMscin001, que mostraron niveles comparables de atezolizumab en sangre cuando se inyectó por vía subcutánea, y un perfil de seguridad y eficacia consistente con la formulación IV2,9. Cabe destacar el papel de España en el desarrollo clínico de atezolizumab SC, con la participación de siete centros, cifra que representa el 20% del total de los pacientes reclutados a nivel mundial en el estudio que avaló su aprobación2,9. La mayor flexibilidad de administración asociada al nuevo fármaco permite aplicar el tratamiento en el hospital y facilita la dosificación simultánea de medicamentos y tratamientos combinados10.
“Trabajamos para ampliar los centros asistenciales en los que este fármaco pueda estar disponible”
Atezolizumab SC es un medicamento de uso hospitalario y, por lo tanto, su punto de administración principal es el medio propio de los hospitales. “No obstante, desde Roche trabajamos con las Administraciones sanitarias nacionales y autonómicas para ampliar los centros asistenciales en los que pueda estar disponible, siempre pensando en ofrecer la mejor opción para los pacientes, y cumpliendo -obviamente- con la normativa aplicable y la Ficha Técnica del producto”, manifiesta la Dra. Amador.
Según la Dra. Dolores Isla, jefa de Servicio de Oncología Médica del Hospital Clínico Universitario Lozano Blesa de Zaragoza y presidenta de la Asociación para la Investigación del Cáncer de Pulmón en Mujeres (ICAPEM), “para las personas que viven con cáncer es fundamental garantizar la mejor calidad de vida posible, por lo que contar con esta opción subcutánea, que pueda reducir el tiempo de tratamiento, sin duda marcará una diferencia significativa para los pacientes y su entorno familiar”.
“Si hablamos del tiempo de los profesionales que atendemos a estos pacientes también hay un impacto positivo, dado que se acelera todo el proceso. Algo muy importante para el sistema sanitario, teniendo en cuenta la elevada demanda que hay en los Hospitales de Día oncológicos. Además, si el enfermo está más satisfecho con su tratamiento, también mejora su adherencia al mismo, por lo que todo son ventajas”, aduce la Dra. Isla.
El 79% de los pacientes apuestan por la vía subcutánea
La administración SC es la preferida por el 79% de los pacientes, tal y como se desprende del estudio IMscin002. Los sujetos con cáncer consultados optan por esta vía5 por ser un procedimiento menos invasivo y presentar una eficacia similar11,12. Además, al ser un tratamiento que va vinculado a menos dolor y molestias adyacentes11,13, aporta, sin duda, una mayor calidad de vida. Todo ello hace posible una vida menos condicionada por la enfermedad, y una mejor adherencia terapéutica14.
Asimismo, el 90% de los profesionales sanitarios que fueron encuestados como parte del ensayo coincidieron en que la formulación SC es fácil de administrar, mientras que el 75% dijo que dicha formulación podría ahorrar tiempo a los equipos sanitarios en comparación con atezolizumab IV2. Concretamente, se ha observado que la presentación subcutánea disminuye aproximadamente en un 80% el tiempo de administración en comparación con la infusión intravenosa estándar2.
“Para el personal de Enfermería, poder mejorar el cuidado y la experiencia de nuestros pacientes es fundamental. Esta forma de aplicación ayuda a mitigar sus miedos y optimiza los tiempos totales de tratamiento y de uso del Hospital de Día, lo que repercute en una utilización más eficiente de los recursos. Se trata de un tratamiento menos invasivo que alivia el dolor, los hematomas e irritaciones asociadas a la vía IV, y que está asociado a menores riesgos derivados del uso de dispositivos de acceso venoso. Todo esto tiene un impacto directo en la calidad de vida de estas personas. Tampoco precisa de un periodo de observación tras su administración, por lo podemos disponer de más tiempo para atender a más enfermos”, manifiesta Alba Silveiro, enfermera de ensayos clínicos del Vall d’Hebron Instituto de Oncología-VHIO (Barcelona).
En este sentido, la nueva formulación de atezolizumab puede contribuir a la sostenibilidad del sistema sanitario gracias a un mejor uso de los recursos de asistencia sanitaria12,14 y a una reducción considerable de los tiempos de preparación e inyección15,16.

(de izq. a dcha): Raquel Sánchez, responsable del servicio de Farmacia Hospitalaria Oncológica de MD Anderson Cancer Center Madrid; Alba Silveiro, enfermera de ensayos clínicos del Vall d’Hebron Instituto de Oncología-VHIO (Barcelona); Mariluz Amador, directora médico de Roche Farma España, y Dra. Dolores Isla, jefa de servicio de Oncología Médica del Hospital Clínico Universitario Lozano Blesa de Zaragoza y presidenta de la Asociación para la Investigación del Cáncer de Pulmón en Mujeres (ICAPEM)
Fuente: Roche / Alabra
En lo relativo a los tiempos de preparación, Raquel Sánchez, responsable del servicio de Farmacia Hospitalaria Oncológica de MD Anderson Cancer Center Madrid, comenta que “una mejor eficiencia en el uso de los recursos pasa, entre otras cosas, por contar con terapias que impliquen un menor tiempo de elaboración y de administración, manteniendo la misma eficacia que las opciones intravenosas. Asimismo, la vía SC conlleva mejores procesos de conservación y puede ayudar a reducir el riesgo de errores de dosificación, disminuir el desperdicio de medicamentos y, en definitiva, aumentar la disponibilidad del personal de farmacia para otras tareas”.
Un anticuerpo monoclonal diseñado para unirse a la proteína PD-L1
Las ventajas vinculadas a la formulación SC de atezolizumab han comportado que la disponibilidad de este fármaco en territorio español se haya conseguido en un tiempo récord, teniendo en cuenta que en enero de este año recibió la aprobación europea. “Algo que responde a que se trata de una innovación incremental, es decir, la que se refiere a aquellas mejoras en un medicamento que, con los mismos principios activos ya aprobados, aportan beneficios clínicos, beneficios para el paciente y beneficios para la sociedad y la salud pública”, concluye Sánchez.
Atezolizumab es una inmunoterapia contra el cáncer aprobada para algunas de las formas tumorales más agresivas y difíciles de tratar. Fue la primera inmunoterapia aprobada para el abordaje de un determinado tipo de cáncer de pulmón no microcítico (CPNM) en fase inicial, el cáncer de pulmón microcítico (CPM) y el carcinoma hepatocelular (CHC)17-19. Se trata de un anticuerpo monoclonal diseñado para unirse a la proteína PD-L1 -que se expresa en las células tumorales y en las células inmunitarias que infiltran el tumor- bloqueando sus interacciones con los receptores PD-1 y B7.1. Al inhibir PD-L1, atezolizumab puede permitir la activación de las células T (células del sistema inmunitario del organismo).
Referencias
1. Agencia Española de Medicamentos y Productos Sanitarios. FT Tecentriq. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1171220001/FT_1171220001.html
2. Burotto M, Zvirbule Z, Alvarez R, et al. IMscin001 Part 2 updated results: Efficacy, safety, immunogenicity, healthcare provider perspectives and patient-reported outcomes from the randomised Phase III study of atezolizumab subcutaneous vs intravenous in patients with locally advanced or metastatic non-small cell lung cancer. Presented at ESMO; 23 October 2023. Poster #1447P.
3. O'Shaughnessy J, et al., Preference for the fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection in patients with HER2-positive early breast cancer (PHranceSCa): A randomised, open-label, phase II study. Eur J Cancer. 2021 Jul;152:223-232.
4. Xavier P, et al. Preference for subcutaneous or intravenous administration of trastuzumab in patients with HER2-positive early breast cancer (PrefHer): an open-label randomised study. Lancet Oncol. 2013;14(10):962-70.
5. Tjalma, et al. Trastuzumab IV versus SC: A time, motion and cost assessment in a lean operating day care oncology unit. Presented at: SABCS; 2016 Dec 6-10; San Antonio, TX, USA. Abstract #P4-21-15.
6. López-Vivanco et al. Cost minimization analysis of treatment with intravenous or subcutaneous trastuzumab in patients with HER2-positive breast cancer in Spain. Clin Transl Oncol. 2017 Dec;19(12):1454-1461.
7. Manevy, F; Filkauskas, G; Levy, P; et al. Potential non-drug cost differences associated with the use of the fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection (PH FDC SC) in the treatment of HER2-positive early breast cancer patients in Western Europe and the United States. Poster 544. ASCO 2021.
8. European Medicines Agency. Tecentriq, INN-atezolizumab. SmPC. [Internet; last updated 25 July 2023; cited December 2023] Disponible en: https://www.ema.europa.eu/en/documents/product-information/tecentriq-epar-product-information_en.pdf
9. Burotto M, Zvirbule Z, Mochalova A, et al. IMscin001 Part 2: a randomised phase III, open-label, multicentre study examining the pharmacokinetics, efficacy, immunogenicity, and safety of atezolizumab subcutaneous versus intravenous administration in previously treated locally advanced or metastatic non-small-cell lung cancer and pharmacokinetics comparison with other approved indications. Ann Oncol. 2023;34(8):693-702.
10. Bittner B, et al. BioDrugs 2018;32:425-440
11. Leveque D. Anticancer Res 2014;34:1579-86
12. Anderson KC, et al. Future Oncol 2019;15:3267-3281
13. Stoner KL, e al. Patient 2014;8:45-153
14. McCloskey C, et al. Pharmacoecon Open 2023;7:3-36
15. De Cock E, et al. Value Health 2014;17:A65
16. IMSC002:Cappuzzo F, et al. ELCC 2024
17. Roche. Nota de prensa: “El Ministerio de Sanidad financia la primera inmunoterapia para el cáncer de pulmón en estadios iniciales”. Disponible en: https://www.roche.es/actualidad/notas-prensa-producto/2023/julio/ministerio-sanidad-primera-inmunoterapia-cancer-pulmon
18. Roche. Nota de prensa: “Disponible en España la primera inmunoterapia, Tecentriq® (atezolizumab), para uno de los subtipos de cáncer de pulmón más agresivos y difíciles de tratar”. Disponible en: https://www.roche.es/actualidad/notas-prensa-producto/2021/septiembre/disponible-espana-inmunoterapia-tecentriq
19. Roche. Nota de prensa: “El Ministerio de Sanidad aprueba la financiación de la primera novedad terapéutica en una década para el abordaje del Carcinoma Hepatocelular (CHC)”. Disponible en: https://www.roche.es/actualidad/notas-prensa-producto/2022/mayo/ministerio-sanidad-financiacion-terapia-carcinoma




