Redacción Farmacosalud.com
La compañía Roche ha anunciado que el Comité Europeo de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) ha emitido una opinión positiva para el uso de TECENTRIQ® (Atezolizumab) en monoterapia para el tratamiento de cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico en pacientes tratados previamente con quimioterapia. Las personas con la mutación EGFR activada o ALK positivo también deberían recibir terapia dirigida antes de ser tratados con Atezolizumab. Esta opinión positiva se ha basado en los resultados de los estudios fase III OAK y del fase II POPLAR. El CHMP también ha recomendado el uso del fármaco en monoterapia para adultos con carcinoma urotelial localmente avanzado o metastásico (CUm) que han sido tratados previamente con quimioterapia con platinos o que no son candidatos a recibir quimioterapia con cisplatino. Esta opinión positiva se ha basado en los resultados del estudio fase III IMvigor211 y de los cortes 1 y 2 del estudio fase II IMvigor210. Basándose en esta opinión positiva del CHMP, se espera que la Comisión Europea tome una decisión en un futuro próximo. Atezolizumab ya está aprobado en Estados Unidos y en otros países para personas con CPNM metastásico, y para las personas con CUm o localmente avanzado y que no son candidatos a recibir quimioterapia con cisplatino, o en los que la enfermedad ha progresado durante o después de recibir quimioterapia con platinos.
Acerca del estudio OAK
OAK es un estudio fase III internacional, multicéntrico, abierto, aleatorizado y controlado que evaluó la eficacia y seguridad de Atezolizumab en comparación con docetaxel. Participaron 1225 pacientes con enfermedad escamosa y no escamosa, independientemente del nivel de expresión de PD-L1 de sus tumores, y recibieron de manera aleatoria (1: 1) Atezolizumab por vía intravenosa con una dosis de 1.200 mg cada tres semanas o docetaxel (75 mg/m2) por vía intravenosa cada tres semanas. Los objetivos co-primarios fueron la supervivencia global (SG) en los primeros 850 pacientes asignados al azar (población con intención de tratar) y en un subgrupo seleccionado con PD-L1 del análisis primario. El estudio de OAK mostró que Atezolizumab ayudó a todos los pacientes del estudio a vivir una media de 13,8 meses - 4,2 meses más que los tratados con quimioterapia con docetaxel (media de supervivencia global [SG]: 13,8 frente a 9,6 meses; HR = 0,73; IC del 95%: 0,62, 0,87).

Fuente: Roche Farma / Planner Media
Acerca del estudio POPLAR
El estudio POPLAR es un ensayo internacional controlado, multicéntrico, aleatorizado, abierto, en pacientes con CPNM localmente avanzado o metastásico que progresaron durante o después de recibir quimioterapia con platinos, independientemente de la expresión de PD-L1. El objetivo primario de eficacia fue la SG. Un total de 287 pacientes fueron aleatorizados 1: 1 para recibir Atezolizumab (1.200 mg por infusión intravenosa cada tres semanas hasta pérdida de beneficio clínico) o docetaxel (75 mg/m2 por infusión intravenosa el día 1 de cada ciclo de 3 semanas hasta progresión de la enfermedad). Los pacientes se dividieron por su estado de expresión PD-L1 en IC, por el número de regímenes de quimioterapia anteriores y por los datos histológicos. Un análisis actualizado con un total de 200 fallecimientos y una media de seguimiento de la supervivencia de 22 meses mostró una SG media de 12,6 meses en pacientes tratados con Atezolizumab frente a 9,7 meses en pacientes tratados con docetaxel (HR de 0,69, IC del 95% : 0,52, 0,92). La TRO fue de 15,3% frente a 14,7% y la media de DR fue de 18,6 meses frente a 7,2 meses para Atezolizumab vs docetaxel, respectivamente.
Acerca del estudio IMvigor211
IMvigor211 es un estudio fase III que compara Atezolizumab con quimioterapia en pacientes con cáncer de vejiga avanzado que fueron previamente tratados con quimioterapia con platino. El estudio evaluó la eficacia y seguridad de Atezolizumab en comparación con la quimioterapia elegida por el médico (vinflunina, paclitaxel o docetaxel) administrada cada tres semanas en 931 personas con CUm previamente tratados que progresaron durante o después de recibir platinos. El objetivo primario de la eficacia fue la SG y los secundarios incluían la tasa de respuesta objetiva, la supervivencia libre de progresión, la duración de la respuesta y la seguridad. El estudio no alcanzó su objetivo primario de SG en comparación con la quimioterapia. Los datos completos se presentaron en una Conferencia Especial EACR-AACR-SIC 2017.
El objetivo primario de eficacia, la supervivencia global, debía ser probado de una manera sucesiva (prueba jerárquica) en poblaciones de estudio definidas por la expresión PD-L1. La primera población sometida a prueba fue la de pacientes con los niveles más altos de expresión PD-L1 (IC2/3), seguida de aquellas con cualquier nivel de expresión PD-L1 (IC1/2/3), y seguida de la población total del estudio (Intención de Tratar). Según el orden establecido, la población de IC2/3 (≥ 5%) fue evaluada primero, con una SG HR de 0,87 (95%IC: 0,63, 1,21, SG media de 11,1 frente a 10,6 meses para Atezolizumab y quimioterapia respectivamente). En la población total del estudio (IT), las personas tratadas con Atezolizumab alcanzaron una media de SG de 8,6 meses (IC: 95%, 7,8, 9,6) en comparación con 8 meses (IC: 95%, 7,2, 8,6) con quimioterapia (HR 0,85, IC del 95%: 0,73-0,99).
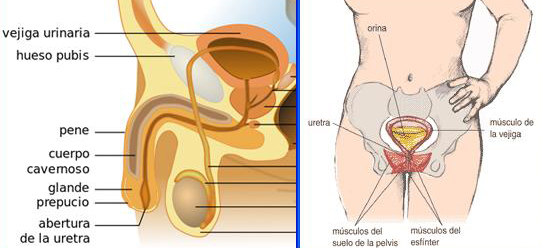
Imagen de la izquierda: La vejiga y el aparato reproductor masculino
Autor/a de la imagen: Male_anatomy.png: alt.sex FAQ Male_anatomy_all.svg: Tsaitgaist (talk) Spanish version: Angelito7 (talk) – Male_anatomy_all.svg
Fuente: Wikipedia
Imagen de la derecha: Componentes del sistema de control de la vejiga ilustrado en la mujer
Fuente: http://kidney.niddk.nih.gov/spanish/pubs/medicine/index.htm / User: Dodo
Difusión: Wikipedia
Se necesitó la significación estadística para las poblaciones del estudio en el siguiente orden: IC2/3 (≥ 5%), IC1/2/3 (≥1%) y grupo IT. Sin embargo, debido a que no se alcanzó significación estadística para SG en la población IC2/3, los resultados no pudieron ser evaluados para significancia estadística en las poblaciones IC1/2/3 y IT y esos análisis se consideran descriptivos. Las tasas de respuesta global (TRG) fueron similares a las reportadas anteriormente en el estudio IMvigor210 fase II y similares entre los dos grupos de estudio. La media de duración de la respuesta (mDR), un objetivo secundario, para los que recibieron Atezolizumab fue de 21,7 meses (IC del 95%: 13,0, 21,7) en la población total del estudio, en comparación con 7,4 meses (IC del 95%: 6,1, 10,3) en los que recibieron quimioterapia. En el momento de corte de los datos, la mayoría (63%) de los pacientes que respondieron al tratamiento con Atezolizumab siguieron respondiendo, en comparación con el 21% de los tratados con quimioterapia.
Acerca del estudio IMvigor210 (corte 2)
En el corte 2, los objetivos co-primarios de eficacia fueron confirmados como TRG usando el sistema RECIST v1.1 y la TRG evaluada por el investigador de acuerdo con los criterios RECIST modificados (mRECIST). Hubo 310 pacientes tratados con Atezolizumab 1.200 mg por infusión intravenosa cada tres semanas hasta perder el beneficio clínico. El estudio cumplió con los objetivos co-primarios en el corte 2, demostrando la TRGs estadísticamente significativas según RECIST v1.1 y el mRECIST evaluado por el investigador en comparación con una tasa de respuesta de control histórico pre-especificada del 10%.
También se realizó un análisis con una media de seguimiento de la supervivencia de 21,1 meses para el corte 2. Los valores de TRG confirmados por IRF-RECIST v1.1 fueron 28,0% (IC del 95%: 19,5, 37,9) en pacientes con expresión de PD-L1 IC2/3 (≥ 5%), 19,3% (IC del 95%: 14,2, 25,4) en pacientes con expresión IC1/ 2/3 (≥ 1%) y 15,8% (IC del 95%: 11,9, 20,4). La TRG confirmada por el investigador-mRECIST fue de 29,0% (95% IC: 20,4, 38,9) en pacientes con expresión PD-L1 ≥ 5%, 23,7% (IC95%: 18,1, 30,1) en pacientes con expresión PD-L1 1% y 19,7% (IC del 95%: 15,4, 24,6) en todos los participantes. La tasa de respuesta completa por IRF-RECIST v1.1 en todos los participantes fue de 6.1% (95% IC: 3.7, 9.4). Para el corte 2, la media de DR por IRF-RECIST v1.1 no se alcanzó en ningún subgrupo de expresión PD-L1 o en todos los participantes, sin embargo se alcanzó en pacientes con expresión PD-L1 <1% (13,3 meses, IC del 95% NE). La tasa de SG a los 12 meses fue de 37% en todos los participantes.

Autor/a: George Hodan
Fuente: www.publicdomainpictures.net
Acerca del estudio IMvigor210 (corte 1)
La opinión positiva del CHMP para los pacientes no candidatos a quimioterapia con cisplatino se basa en los resultados del corte 1, que incluyó 119 pacientes con CUm o localmente avanzado que no eran candidatos a quimioterapia con cisplatino y no habían sido tratados previamente o tuvieron progresión de la enfermedad al menos 12 meses después de recibir quimioterapia neoadyuvante (antes de la cirugía) o adyuvante (después de la cirugía). El objetivo primario del estudio fue la TRO. El perfil de seguridad de Atezolizumab se basa en los datos agrupados de 2.160 pacientes con CUm y CPNM. Las reacciones adversas más frecuentes fueron fatiga (35,4%), disminución del apetito (25,5%), náuseas (22,9%), disnea (21,8%), diarrea (18,6%), pirexia (18,3%), erupción cutánea (18,6%), vómitos (15,0%), artralgia (14,2%), astenia (13,8%) y prurito (11,3%).
Un anticuerpo monoclonal concebido para unirse a la proteína PD-L1
Atezolizumab es un anticuerpo monoclonal en investigación concebido para unirse a una proteína denominada PD-L1. Se ha diseñado para unirse directamente al PD-L1 que se expresa en las células tumorales y en los linfocitos infiltrantes de tumores y bloquear su interacción con los receptores PD-1 y B7.1. Al inhibir el PD-L1, Atezolizumab permite la activación de los linfocitos T. Este anticuerpo monoclonal tiene el potencial de ser utilizado en combinación con inmunoterapias frente al cáncer, terapias dirigidas y diversas quimioterapias en una amplia gama de tumores.




