Redacción Farmacosalud.com
Un estudio ha evaluado la seguridad y eficacia de EMEND® (aprepitant) en la prevención de las náuseas y vómitos inducidos por la quimioterapia (CINV, por sus siglas en inglés) en pacientes pediátricos con cáncer, de edades comprendidas entre los seis meses y los 17 años. En este estudio de pacientes pediátricos con cáncer, sometidos a quimioterapia muy alta, alta o moderadamente emetógena (que induce el vómito), el uso del régimen con EMEND para la prevención de las náuseas y vómitos provocados por la quimioterapia, fue significativamente más efectivo que el régimen de control a la hora de lograr una respuesta completa, definida como la ausencia de vómitos o arcadas, y el no uso de fármacos de rescate para las náuseas y vómitos en todas las fases de CINV (agudos, retardados y generales) , ha informado la compañía MSD mediante un comunicado.
“Las náuseas y vómitos son complicaciones comunes de la quimioterapia contra el cáncer y pueden ser especialmente angustiosos y debilitantes para los pacientes pediátricos", afirmó Stuart Green, vicepresidente de Investigación Clínica de Merck Research Laboratories. "En este extenso estudio pediátrico, la adición de EMEND a un régimen estándar para la prevención de náuseas y vómitos inducidos por la quimioterapia dio lugar a una reducción significativa de los eventos eméticos", ha añadido. Sobre la base de estos datos, MSD planea presentar una solicitud de registro a nivel mundial para EMEND (aprepitant), empezando en Estados Unidos, para su uso en la prevención de las náuseas y vómitos inducidos por la quimioterapia en pacientes pediátricos y adolescentes con cáncer.
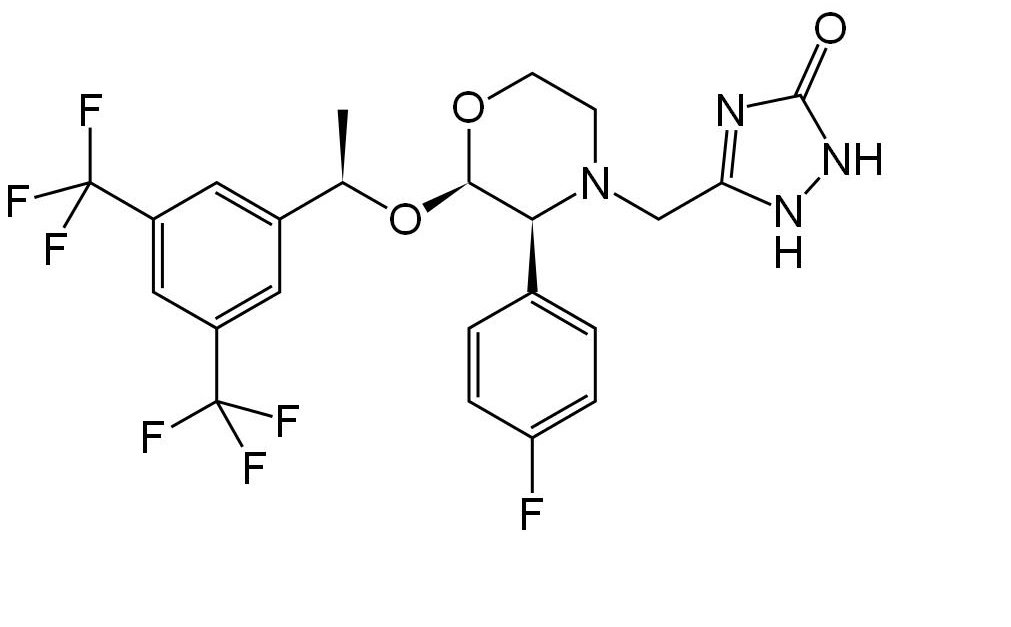
Fórmula de Aprepitant
Autor/a: Fvasconcellos
Fuente: Wikipedia
Náuseas-vómitos agudos y retardados
Las náuseas y vómitos inducidos por quimioterapia son un efecto secundario frecuente provocado por células del estómago afectadas que inician el proceso de náuseas y vómitos, y pueden activar directamente el área del cerebro responsable de producirlos. Los dos tipos principales de náuseas y vómitos inducidos por quimioterapia son agudos y retardados. Los episodios agudos suceden en las primeras 24 horas tras recibir la quimioterapia. Los episodios retardados se dan a partir del día 2 al día 5 tras la quimioterapia. La cantidad y el momento en que ocurren las náuseas y vómitos inducidos por la quimioterapia puede variar. Algunas quimioterapias provocan náuseas y vómitos agudos. Otras provocan náuseas y vómitos agudos seguidos de otro periodo de náuseas y vómitos retardados.
EMEND, un antagonista de los receptores de la sustancia P/ neurocinina 1 (NK1), autorizado para su utilización en combinación con otros agentes antieméticos, está indicado para la prevención de las náuseas y los vómitos agudos y diferidos que se asocian con la quimioterapia antineoplásica altamente emetógena basada en el cisplatino en adultos y para la prevención de las náuseas y vómitos que se asocian con la quimioterapia antineoplásica moderadamente emetógena en adultos. EMEND no ha sido estudiado para el tratamiento de náuseas y vómitos establecidos. No se recomienda la administración continua o crónica de EMEND. No se ha establecido la seguridad y eficacia de EMEND en pacientes pediátricos.
Contraindicaciones de EMEND
EMEND está contraindicado en pacientes con hipersensibilidad al principio activo o a alguno de los excipientes. Es un inhibidor de la isoenzima 3A4 del citocromo P450 (CYP3A4) dependiente de la dosis. EMEND no debe emplearse conjuntamente con pimozida, terfenadina, astemizol o cisaprida. La inhibición de CYP3A4 por aprepitant podría dar lugar a elevaciones de las concentraciones plasmáticas de estos fármacos, lo que podría provocar reacciones graves o potencialmente mortales. EMEND debe emplearse con precaución en pacientes que estén recibiendo de forma concomitante fármacos, incluidos agentes quimioterapéuticos que se metabolizan principalmente a través de CYP3A4. La inhibición de CYP3A4 por EMEND podría dar lugar a elevaciones de las concentraciones plasmáticas de estos fármacos concomitantes. En cambio, cuando EMEND se emplea de forma concomitante con otro inhibidor de CYP3A4, las concentraciones plasmáticas de aprepitant podrían ser elevadas. Cuando EMEND se emplea de forma concomitante con otros fármacos que inducen la actividad del CYP3A4, se pueden reducir las concentraciones plasmáticas de aprepitant y esto podría dar lugar a una menor eficacia del aprepitant. La administración conjunta de EMEND con warfarina (un sustrato CYP2C9) puede dar lugar a una disminución clínicamente significativa del coeficiente internacional normalizado (INR, por sus siglas en inglés del tiempo de protrombina).
La eficacia de los anticonceptivos hormonales (incluidas píldoras, parches cutáneos, implantes y algunos DIU) puede disminuir durante la administración conjunta con EMEND y durante 28 días después de la misma.
Estudio en Fase III
El estudio en Fase III, aleatorizado, doble ciego, de comparador activo, en el que participaron 302 participantes evaluó EMEND para la prevención de náuseas y vómitos inducidos por la quimioterapia en niños (con edades entre los seis meses y los 17 años de edad). En el estudio, a los pacientes que recibían quimioterapia emetógena se les designó aleatoriamente para recibir un régimen de EMEND (aprepitant) más ondansetrón (N=152) o un régimen de control (placebo más ondansetrón) (N=150). El régimen de EMEND incluyó tanto cápsulas de EMEND como una formulación de polvo para suspensión en investigación de aprepitant de dosificación basada en el peso. La administración de ondansetrón se basó en la dosis pediátrica aprobada (según la ficha técnica local). La variable principal del estudio fue la respuesta completa (ausencia de vómitos, arcadas y no necesidad de fármacos de rescate para las náuseas y vómitos) en la fase retardada (25 a 120 horas tras el inicio de la quimioterapia). Las variables secundarias fueron la respuesta completa en la fase aguda (0 a 24 horas) y en la fase general (0-120 horas) y ausencia de vómitos en la fase general.
Autor/a: Andres Rueda
Fuente: Wikimedia (originalmente en Flickr)
En ambos grupos, la primera dosis de EMEND (más ondansetrón) se administró en el día 1 de la quimioterapia y en los sucesivos días 2 y 3 (sin ondansetrón). La dexametasona se pudo administrar por vía intravenosa, según el criterio del investigador (la dosis se basó en el peso). La administración de dexametasona fue similar en pacientes que recibían el régimen de EMEND y el régimen de control (44 versus 42 pacientes, respectivamente). El régimen de EMEND aumentó la respuesta completa en los días 2 al 5 (variable principal).
Efectos adversos
En el estudio, el 51% de los pacientes que recibía el régimen de EMEND alcanzó la variable principal de la respuesta completa en la fase retardada de náuseas y vómitos inducidos por quimioterapia, frente al 26% de pacientes en el grupo de control (p<0,0001). En relación con las variable secundarias, el 66% de los pacientes que recibía el régimen de EMEND alcanzó la respuesta completa en la fase aguda de náuseas y vómitos inducidos por quimioterapia, frente al 52% de pacientes en el régimen de control (p=0,0135). Asimismo, la respuesta completa en la fase general fue mayor en los pacientes que recibían el régimen de EMEND frente al régimen de control (40% versus 20%, p=0,0002). No se observaron vómitos en la fase general en el 47% de los pacientes que recibían el régimen de EMEND frente al 21% en el régimen de control, respectivamente (p<0,0001).
En total, el 79% de los pacientes que recibía el régimen de EMEND y el 77% de los que recibía el régimen de control experimentó uno o más efectos adversos. Los efectos adversos más frecuentes (en todos los niveles de gravedad) con el régimen de EMEND en comparación con el régimen de control incluían anemia (17% versus 25%), neutropenia febril (16% para ambos grupos), vómitos (15% para ambos grupos), neutropenia (14% vs 12%), trombocitopenia (10% versus 11%), recuento disminuido de neutrófilos (9% versus 13%), náuseas (9% versus 11%) y un recuento disminuido de plaquetas (8% versus 10%). Se observaron efectos adversos relacionados con el tratamiento en el 3% de los pacientes (5/152) que recibía el régimen de EMEND y en el 2% de los pacientes que recibía el régimen de control (3/150). Se observaron efectos adversos graves relacionados con el tratamiento en el 1% de los pacientes del régimen con EMEND (2/152) y en un 0% (0/150) de los pacientes que recibía el régimen de control.




