Introducción
A pesar de la introducción de nuevos fármacos en el arsenal terapéutico de la Enfermedad Inflamatoria Intestinal (EII), existe una proporción de pacientes que no toleran, no responden o pierden la respuesta a los tratamientos ya disponibles en práctica clínica, por lo que la investigación de fármacos con distintos mecanismos de acción es crucial para ofrecer otras alternativas terapéuticas a estos pacientes.
1. Moduladores de la esfingosina-1-fosfato (S1P)

Dra. Elena Ricart
Fuente: Dra. Ricart
La esfingosina-1-fosfato (S1P) es un metabolito lipídico bioactivo que ejerce sus acciones mediante la activación de 5 receptores acoplados a la proteína G (S1PR1-S1PR5). Los receptores S1P están involucrados en varios eventos celulares y fisiológicos, incluido el tráfico de linfocitos y células hematopoyéticas y consecuentemente en la patogenia de las enfermedades inmunomediadas1.
Los moduladores de S1PR conducen a la internalización del receptor, la ubiquitinación posterior y la degradación del proteosoma, lo que ocasiona que los linfocitos sean incapaces de seguir el gradiente de S1P impidiendo su acceso a los puntos de inflamación. Estos fármacos también pueden bloquear la salida de linfocitos de los ganglios linfáticos al inhibir la migración transendotelial. La selección de S1PR como estrategia terapéutica se utilizó por primera vez para la esclerosis múltiple (EM), y actualmente se han aprobado cuatro moduladores de S1P (fingolimod, siponimod, ozanimod y ponesimod) para su tratamiento2.
Los nuevos moduladores de S1PR están en desarrollo clínico para la EM y se están evaluando sus usos para tratar otras enfermedades inmunomediadas, como la EII, la artritis reumatoide, el lupus eritematoso sistémico y la psoriasis. (Figura 1)3
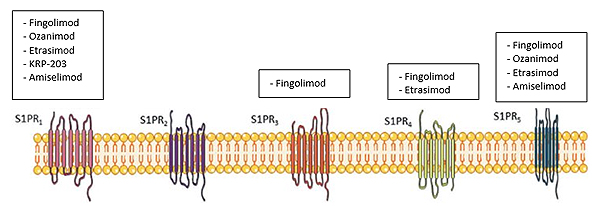
Figura 1. Moduladores de los receptores de la esfingosina 1-fosfato (S1P) evaluados para el tratamiento de la colitis ulcerosa
Modificada de 3
Los moduladores de S1P son pequeñas moléculas que ofrecen la ventaja de poder administrarse por vía oral, con una vida media corta y ausencia de inmunogenicidad, por lo que los hace especialmente atractivos. El desarrollo de esta diana terapéutica en la EII se ha centrado fundamentalmente en la colitis ulcerosa (CU), y ozanimod y etrasimod son los fármacos que actualmente ofrecen un mayor desarrollo clínico.
Ozanimod
Ozanimod es un agonista oral de S1PR1 y S1PR5 inicialmente evaluado en un ensayo clínico de fase 2 (TOUCHSTONE) para el tratamiento de la CU de moderada a grave4. Un total de 197 pacientes fueron aleatorizados a recibir 0,5 mg, 1 mg o placebo de ozanimod por vía oral una vez al día, durante un máximo de 32 semanas. El objetivo primario se definió como remisión clínica (Índice de Mayo ≤ 2, sin ninguna subpuntuación > 1) a las 8 semanas y se observó en el 16% de los pacientes que recibieron ozanimod 1 mg/día en comparación con el 14% y el 6% que recibieron 0,5 mg de ozanimod (p = 0,048) y placebo (p = 0,14), respectivamente. En cuanto a la proporción de pacientes que presentaron respuesta clínica, (definida como una disminución del índice de Mayo ≥ 3 y ≥ 30% y una disminución en la subpuntuación de sangrado rectal de ≥ 1 punto o una subpuntuación ≤ 1), a las 8 semanas fue superior en los pacientes que recibieron ozanimod 1 mg (57%) y 0.5 mg (54%) respecto al grupo placebo (37%).
En la semana 32, se logró una remisión clínica del 21% en el grupo que recibió 1 mg de ozanimod, del 26% en el grupo que recibió 0,5 mg y del 6% en el grupo que recibió placebo, con tasas de respuesta clínica del 51%, 35% y 20%, respectivamente. Con respecto al perfil de seguridad, los eventos adversos más comunes observados en este ensayo incluyeron empeoramiento de la CU (3.4% con ozanimod frente a 8% con placebo), anemia (0.5% frente a 6%) y cefalea (0.3% frente a 5%). Se produjo bloqueo auriculoventricular de primer grado y bradicardia sinusal en un paciente tratado con ozanimod y elevaciones en los niveles de aminotransferasas hepáticas de más de 3 veces el límite superior en 4 pacientes (3%) durante el tratamiento con ozanimod.
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Tras los resultados positivos de este estudio, se ha llevado a cabo el estudio fase 3 (True North Study)5. En este estudio los pacientes con CU de moderada a grave eran aleatorizados a recibir placebo (n=216) u ozanimod 1 mg/día (n=429), incluyendo, además, una cohorte adicional de 367 pacientes tratados abiertamente con ozanimod 1 mg/d. En la semana 10, el 18.4% de los pacientes tratados con ozanimod y el 6% de los tratados con placebo presentaron remisión clínica (p<0.0001), y el 47.8 y 25.9%, respectivamente, respuesta clínica (p<0.0001). En la semana 52, el 37 y 18.5% de pacientes tratados con ozanimod o placebo, respectivamente, presentaron remisión clínica (p<0.0001), el 69 y 41% respuesta clínica (p<0.0001) y el 29.6 y 14.1% cicatrización mucosa (p<0.001), respectivamente. La frecuencia y características de los efectos adversos fueron similares entre los grupos, con un mayor número de pacientes tratados con ozanimod que presentaron elevación de las transaminasas respecto a placebo (4.8% versus 0.4%). No se reportaron casos de toxicidad cardíaca. Los datos de eficacia y seguridad de ozanimod apoyan su uso en pacientes con CU y es un fármaco ya autorizado para su uso clínico en Estados Unidos.
Etrasimod
Etrasimod es un agonista oral de S1PR1, S1PR4 y S1PR5 que ha sido evaluado en pacientes con CU de moderada a grave en un estudio fase 2 (OASIS)6. Un total de 156 pacientes fueron aleatorizados a recibir etrasimod 1 mg una vez al día (n=52) o 2 mg (n=50) o placebo (n=54). El objetivo primario fue la mejoría en 3 de los componentes del índice de Mayo (datos endoscópicos, sangrado rectal, frecuencia defecatoria) respecto a los basales. En la semana 12, se observó una mejoría dosis-dependiente en todas las medidas de eficacia en los pacientes tratados con etrasimod en comparación con placebo.
Etrasimod 2 mg mejoró significativamente el cambio con respecto al valor inicial en los tres componentes del índice de Mayo frente a placebo (diferencia, 0,99 puntos; IC del 90%, 0,30-1,68; p = 0,009). Además, un mayor número de pacientes tratados con etrasimod 2 mg logró una mejoría endoscópica (41,8% frente a 17,8% para placebo; p = 0,003). En la semana 12, un 33% de pacientes tratados con etrasimod 2 mg/día presentaron remisión clínica frente al 8.1% de los tratados con placebo (p<0.001) (Figura 2).
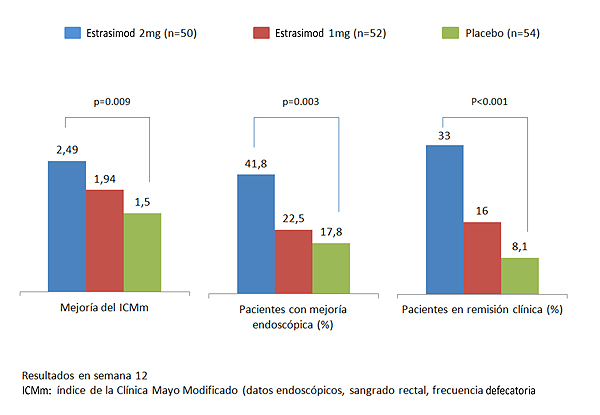
Figura 2. Eficacia de etrasimod en pacientes con colitis ulcerosa: Resultados del estudio fase 2 OASIS
Extraída de 6
Los pacientes que completaron el estudio entraron en el estudio abierto de seguimiento y recibieron etrasimod 2 mg/d durante 34-40 semanas más (n=92)7. Al final del tratamiento, el 64% de los pacientes cumplieron los criterios de respuesta clínica, el 33% de remisión clínica y el 43% de mejoría endoscópica. La respuesta clínica, la remisión clínica o la mejoría endoscópica observadas en la semana 12 se mantuvieron hasta el final del tratamiento en el 85%, 60% y 69% de los pacientes, respectivamente. Los efectos adversos emergentes del tratamiento ocurrieron en el 60% de los pacientes que recibieron etrasimod 2 mg, siendo los más comunes el empeoramiento de la CU y la anemia. El 94% de los efectos adversos fueron leves / moderados. En este estudio de extensión a largo plazo, etrasimod 2 mg demostró un buen perfil de eficacia y seguridad, por lo que su evaluación en estudios fase 3 ya está en marcha.
2. Antiintegrinas
Durante una respuesta inflamatoria, los leucocitos circulantes migran a los tejidos diana a través de la interacción de las integrinas localizadas en la superficie leucocitaria y las moléculas de adhesión expresadas por células endoteliales. La integrina es un receptor heterodimérico formado a partir de subunidades α y β y se divide en varios grupos dependiendo de la estructura de la subunidad α y β. Estas integrinas incluyen α4β1 (que se encuentra en la mayoría de los leucocitos), α4β7 (que se encuentra específicamente en los linfocitos del tracto gastrointestinal) y αEβ7 (que se encuentra en las células T intraepiteliales, células dendríticas, mastocitos o células T reguladoras)8. Las integrinas α4β1, α4β7 y αEβ7 se unen a la molécula de adhesión VCAM1 en las células endoteliales vasculares, la molécula de adhesión MAdCAM1 en las células endoteliales intestinales y la Ecadherina en las células epiteliales mucosas9. El bloqueo de las integrinas y de las moléculas de adhesión ha sido evaluado como diana terapéutica en la EII10 (Figura 3).
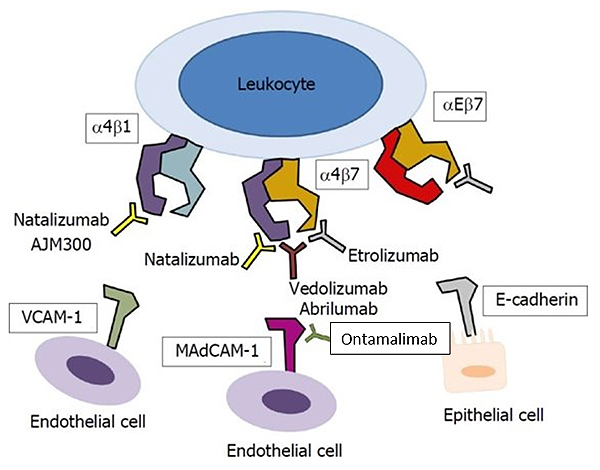
Figura 3. Fármacos antiintegrina evaluados en la Enfermedad Inflamatoria Intestinal
Modificada de 10
El natalizumab (anti-α4) está aprobado para la enfermedad de Crohn (EC) de moderada a grave en Estados Unidos, pero no en Europa, y su uso está limitado por el riesgo potencial de leucoencefalopatía multifocal progresiva (LMP). El vedolizumab (anti-α4β7) está aprobado para el tratamiento de la CU y la EC. Es la terapia antiintegrina más utilizada en la EII y se ha demostrado que es eficaz tanto en la terapia de inducción como en la de mantenimiento, con un perfil de seguridad favorable. En la Tabla 1 se muestran los fármacos antiintegrina aprobados actualmente y en uso o en ensayos clínicos en EII.
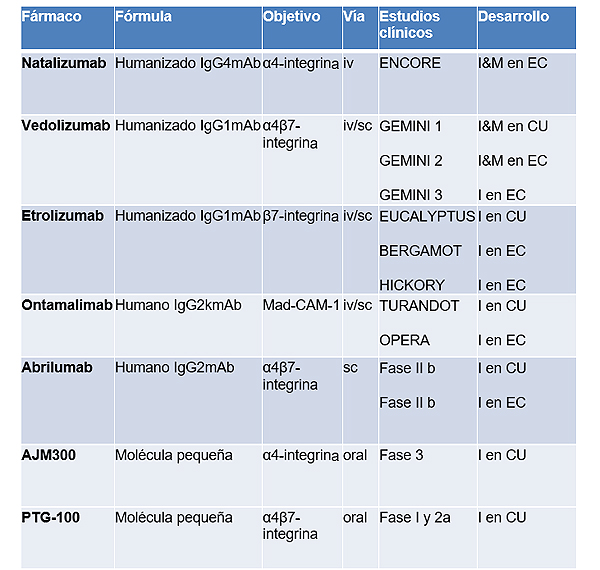
Tabla 1. Antintegrinas en el tratamiento de la Enfermedad Inflamatoria Intestinal
mAb: anticuerpo monoclonal; iv: intravenoso; sc: subcutáneo; I: Inducción; M: Mantenimiento; EC: enfermedad de Crohn; CU: colitis ulcerosa
Elaboración propia
Etrolizumab
Etrolizumab inhibe selectivamente α4β7 y αEβ7, actuando, no sólo sobre el tráfico de células inflamatorias hacia el interior de la pared intestinal, sino también controlando los efectos inflamatorios en el epitelio intestinal. El programa de desarrollo fase 3 de etrolizumab es, con más de 3.000 pacientes, el más grande y completo llevado a cabo hasta la fecha en EII. El programa clínico fase 3 de etrolizumab consta de seis ensayos controlados aleatorizados: HIBISCUS I y II, GARDENIA, LAUREL, HICKORY en CU; BERGAMOT en EC y dos ensayos de extensión abiertos (COTTONWOOD en CU y JUNIPER en EC)11. A destacar que los estudios HIBISCUS I y II y el GARDENIA en CU establecen también la comparación directa con adalimumab e infliximab, respectivamente.
Se dispone ya de algunos datos preliminares de los estudios HIBISCUS I y II12. En la semana 10, el 19.4% de los pacientes con CU de moderada a grave tratados con etrolizumab 105 mg/4semanas sc (subcutáneo) presentaban remisión clínica frente al 6.9% de los tratados con placebo en el HIBISCUS I (p=0.0173). Esta diferencia no se observó, no obstante, en el HIBISCUS II con un diseño idéntico (18.2% versus 11.1%, respectivamente, p=0.1729). Respecto a la comparación con adalimumab, etrolizumab no fue superior a este último en la semana 10 ni en remisión clínica (18.8 versus 23.5%, p=0.1341), respuesta clínica (54.7 versus 53.3%, p=0.7788) o remisión endoscópica (20.2 versus 23.5%, p=0.3011). No hubo diferencias en cuanto a efectos adversos entre los distintos grupos de tratamiento ni se observó ningún caso de LMP.
El estudio fase 3 BERGAMOT es el primer estudio que ha evaluado la eficacia de etrolizumab en pacientes con EC13. En una primera cohorte exploratoria se incluyeron 300 pacientes con EC activa que se randomizaron a un estudio de inducción de 14 semanas con placebo, etrolizumab 105 mg/4semanas subcutáneo (sc) o etrolizumab 210 mg sc en semanas 0, 2, 4, 8, y 12. En la semana 14, el 16.9%, 23.3% y 28.9% tratados con placebo, etrolizumab 105 mg y etrolizumab 210 mg, respectivamente, estaban en remisión clínica (CDAI<150). Paralelamente, los grupos tratados con etrolizumab 105 o 210 presentaron una mejoría endoscópica clínicamente significativa en el 21% y 17.4% respecto al 3.4% de los tratados con placebo. Etrolizumab se toleró bien, con una frecuencia de efectos adversos similar a la del placebo.

Autor/a: George Hodan
Fuente: www.publicdomainpictures.net
Ontamalimab
Ontamalimab es un anticuerpo IgG2κ monoclonal completamente humano dirigido contra MAdCAM1, una CAM endotelial intestinal que se une a la integrina α4β7 en los linfocitos. Ontamalimab ha sido evaluado en CU y en EC.
El estudio TURANDOT I incluyó 357 pacientes con CU de moderada a grave que fueron aleatorizados a recibir ontamalimab sc 7.5 mg, 22.5 mg, 75 mg, 225 mg o placebo en las semanas 0, 4 y 814. En la semana 12, el 11.3%, 16.7% y 15.5% de los pacientes tratados con ontamalimab 7.5 mg, 22.5 mg y 75 mg estaban en remisión clínica (índice de Mayo ≤2, con ninguna subpuntuación >1) respectivamente, en comparación con el 2.7% de los tratados con placebo (p<0.05) y el 5.7% de los tratados con ontamalimab 225 mg. No hubo reacciones adversas significativas y el perfil de seguridad del fármaco fue similar al del placebo. Posteriormente, el estudio TURANDOT II15 evaluó la seguridad y eficacia de ontamalimab 75 mg o 225 mg/4semanas sc a largo plazo sin identificar alarmas de seguridad y con alrededor de un 40% de pacientes con cicatrización mucosa endoscópica (Mayo endoscópico ≤1) al final del seguimiento (semanas 40-72).
El estudio OPERA I incluyó 265 pacientes con EC de moderada a grave que fueron aleatorizados a recibir ontamalimab sc 7.5 mg, 22.5 mg, 75 mg, 225 mg o placebo en las semanas 0, 4 y 816. En las semanas 8 y 12 no hubo diferencias en la respuesta clínica (definida como descenso de al menos 70 puntos del CDAI basal) (47,7% de los pacientes del grupo placebo frente al 52,7%, 60,1% y 62,7% de los pacientes de los grupos de 22,5 mg, 75 mg y 225 mg de ontamalimab, respectivamente). Las proporciones correspondientes en la semana 12 fueron 58,6% en el grupo de placebo y 62,0%, 64,7% y 57,5% en los grupos de ontamalimab 22,5 mg, 75 mg y 225 mg, respectivamente). Cabe destacar que sí que se observaron diferencias significativas en los grupos tratados con 75 y 225 mg de ontamalimab respecto a placebo al evaluar los pacientes con lesiones endoscópicas más graves (SES-CD>17) en la inclusión.
Posteriormente, el estudio OPERA II17 evaluó la seguridad y eficacia de ontamalimab 75 mg /4semanas sc durante 72 semanas sin identificar alarmas de seguridad y con alrededor de un 40% de pacientes en remisión clínica al final del seguimiento.
AJM300
AJM300 es una molécula pequeña de administración oral anti-α4 que ha sido evaluada en un estudio fase 3 japonés en 203 pacientes con CU moderada refractarios o intolerantes a mesalazina. Los pacientes fueron aleatorizados a recibir AJM300 960 mg/8h oral o placebo18. En la semana 8, la proporción de pacientes con respuesta clínica, mejoría endoscópica y remisión endoscópica de los pacientes tratados con AJM300 fue significativamente superior en comparación con placebo (45.1% versus 20.8%, p=0.003; 54.9% versus 26.7%, p<0.0001; 13.7% versus 3%, p=0.0057, respectivamente). A pesar de compartir el mismo mecanismo de acción que natalizumab, no se observó ningún caso de LMP, aunque es importante destacar que el tiempo de seguimiento fue muy corto.
Bibliografía
1. Park SJ, Im DS. Sphingosine 1-phosphate receptor modulators and drug discovery. Biomol Ther 2017;25(1):80–90.
2. Chun J, Giovannoni G, Hunter SF. Sphingosine 1-phosphate receptor modulator therapy for multiple sclerosis: differential downstream receptor signalling and clinical profile effects. Drugs 2021;81(2):207–31.
3. Argollo M, Furfaro F, Gilardi D et al. Modulation of sphingosine-1-phosphate in ulcerative colitis. Expert Opin Biol Ther 2020(4);4:413-20.
4. Sandborn WJ, Feagan BG, Wolf DC, et al. Ozanimod induction and maintenance treatment for ulcerative colitis. N Engl J Med 2016;374(18):1754-62.
5. Sandborn WJ, Feagan BG, D’Haens G, et al. Ozanimod as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2021;385:1280-91.
6. Sandborn WJ, Peyrin-Biroulet L, Zhang J, et al. Efficacy and safety of etrasimod in a phase 2 randomized trial of patients with ulcerative colitis. Gastroenterology 2020;158(3):550-61.
7. Vermeire S, Chiorean M, Panés J, et al. Long-term safety and efficacy of etrasimod for ulcerative colitis: Results from the open-label extension of the OASIS study. J Crohns Colitis 2021;15(6):950-9.
8. Binion DG, West GA, Ina K, et al. Enhanced leukocyte binding by intestinal microvascular endothelial cells in inflammatory bowel disease. Gastroenterology 1997;112(6):1895-907.
9. Zundler S, Becker E, Weidinger C, et al. Anti-Adhesion therapies in inflammatory bowel disease-molecular and clinical aspects. Front Immunol 2017;8:891.
10. Park SC, Jeen YT. Anti-integrin therapy for inflammatory bowel disease. World J Gastroenterol 2018;24(17):1868-80.
11. Sandborn WJ, Vermeire S, Tyrrell H, et al. Etrolizumab for the treatment of ulcerative colitis and Crohn’s disease: An overview of the Phase 3 clinical program. Adv Ther 2020;37(7):3417-31.
12. Dotan I, Panés J, Duvall A, et al. Etrolizumab compared with adalimumab or placebo as induction therapy for ulcerative colitis: Results from the randomized phase 3 HIBISCUS I and II trials. United Eur Gastroenterol J 2020;8(Suppl 1).
13. Sandborn WJ, Panés J, Jones J, et al. Etrolizumab as induction therapy in moderate to severe Crohn’s disease: Results from the BERGAMOT cohort 1. United Eur Gastroenterol J 2017;5(Suppl 1).
14. Vermeire S, Sandborn WJ, Danese S, et al. Anti-MAdCAM antibody (PF-00547659) for ulcerative colitis (TURANDOT): a phase 2, randomised, double-blind, placebo-controlled trial. Lancet 2017;390(10090):135-44.
15. Reinisch W, Sandborn WJ, Danese S, et al. Long-term efficacy of the anti-MAdCAM-1 monoclonal antibody ontamalimab (SHP647) for the treatment of ulcerative colitis: The open-label study TURANDOT II. J Crohns Colitis 2021;15(6):938-49.
16. Sandborn WJ, Lee SD, Tarabar D, et al. Phase II evaluation of anti-MAdCAM antibody PF-00547659 in the treatment of Crohn's disease: report of the OPERA study. Gut 2018;67(10):1824-35.
17. D'Haens GR, Reinisch W, Lee SD, et al. Long-term safety and efficacy of the anti-mucosal addressin cell adhesion molecule-1 monoclonal antibody ontamalimab (SHP647) for the treatment of Crohn's disease: The OPERA II study. Inflamm Bowel Dis 2021;doi: 10.1093/ibd/izab215.
18. Watanabe M, Matsouka K, Ohmori T, et al. AJM300, an oral antagonist of α4-Integrin, as induction therapy for patients with moderately active ulcerative colitis: A phase 3, randomized, double-blind, placebo-controlled induction study. J Crohns Colitis;15, Issue Supplement_1,2021: S031–S032.




