Redacción Farmacosalud.com
Adalimumab tiene potencial de sobra para convertirse en tratamiento de primera elección para aquellos pacientes de uveítis secundaria-enfermedad de Behçet (uveítis secundaria a enfermedad de Behçet), sostiene el doctor Alfredo Adán, presidente de la Sociedad Española de Inflamación Ocular (SEIO) y director del Instituto de Oftalmología (ICOF) del Hospital Clínic de Barcelona. Por ahora, el fármaco ha merecido la opinión positiva de la Agencia Europea de Medicamentos para el tratamiento de la uveítis no infecciosa intermedia, posterior y la panuveítis en pacientes adultos que hayan sido tratados con corticosteroides y la respuesta no haya sido óptima. El síndrome de Behçet es una enfermedad que causa síntomas en varias partes del organismo. Los síntomas más comunes incluyen aftas (llagas) en la boca y en los genitales junto a la afectación ocular en forma de uveítis[1]. También puede incidir en otras zonas del organismo, principalmente la piel, las articulaciones, el sistema nervioso central y el sistema circulatorio. La afectación ocular aparece entre un 50-70% de los pacientes y es más frecuente y grave en los 3-5 primeros años[1].

Doctor Alfredo Adán
Fuente: Dr. Adán
El Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) ha emitido una opinión positiva para adalimumab para el tratamiento de la uveítis no infecciosa intermedia, posterior y la panuveítis en pacientes adultos que hayan tenido una respuesta inadecuada a los corticosteroides o en los cuales el tratamiento con corticosteroides haya resultado inadecuado, informa la compañía AbbVie. La uveítis no infecciosa es un grupo de enfermedades caracterizadas por inflamación de la úvea, la capa media del ojo.[2] Esta patología puede provocar una disminución de la visión o pérdida de visión y es la tercera causa de ceguera prevenible en todo el mundo.[2-6] Si la Comisión Europea concede la autorización, adalimumab se convertiría en el primer y único tratamiento biológico disponible para la uveítis no infecciosa intermedia, posterior y la panuveítis.
Dos grandes grupos de uveítis no infecciosas
Dentro del contexto global de las uveítis no infecciosas, desde el punto de vista anatómico hay dos grandes grupos: las que afectan a la parte anterior de la úvea, que son las uveítis anteriores, y las que afectan a la parte más posterior e intermedia, que englobarían tanto a las uveítis posteriores, como a las intermedias y la panuveítis. En general, las anteriores requieren tratamiento tópico con gotas de corticosteroides y la respuesta en la mayoría de los casos suele ser eficaz, mientras que las posteriores, intermedias y panuveítis son las que producen mayores secuelas visuales, a menudo con presencia de cuadros crónicos que pueden requerir tratamiento de forma prolongada con corticosteroides por vía general o también inmunosupresores. En consecuencia, este segundo grupo de pacientes son los que tienen mayor riesgo de padecer pérdida de agudeza visual y daños estructurales.
La uveítis no infecciosa puede ser difícil de diagnosticar y tratar[7,8] y no existen directrices universalmente aceptadas para el tratamiento del trastorno.[9,10] Actualmente, los corticosteroides son el pilar de tratamiento después de descartar otras patologías subyacentes, como una infección.[11] Sin embargo, pueden no ser eficaces en todos los pacientes y pueden tener efectos secundarios graves oculares a largo plazo, incluido glaucoma y cataratas.[12,13] Algunos pacientes presentan enfermedades subyacentes que impiden el uso de corticosteroides.
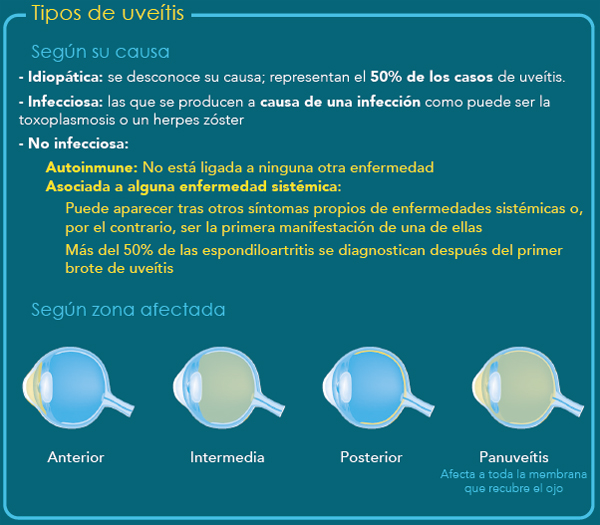
Infografía sobre los tipos de uveítis
Fuente: AbbVie / Agencia Ketchum / AUVEA (Asociación de Pacientes de Uveítis)
El nuevo tratamiento es más selectivo
Adalimumab tiene propiedades terapéuticas para los supuestos de uveítis apuntados anteriormente y, además, también puede reducir el uso de corticosteroides en pacientes dependientes de corticosteroides. “La administración de corticosteroides por vía oral durante un tiempo prolongado comporta efectos secundarios bien conocidos que limitan en muchas ocasiones la calidad de vida de los pacientes”, explica el doctor Adán, quien agrega que, fundamentalmente, los efectos adversos pueden ir desde un síndrome de Cushing inducido por corticosteroides hasta una osteoporosis, pasando por unas alteraciones gastrointestinales. Todo ello “limita en muchas ocasiones la dosis que podemos dar de esta medicación”, apostilla el experto.
Si la Comisión Europea concede la autorización para adalimumab, este fármaco se convertiría en el primer y único tratamiento biológico disponible para la uveítis no infecciosa intermedia, posterior y la panuveítis. Según el oftalmólogo, esta terapia representa “un gran avance” porque se dará “un salto cualitativo muy significativo en el tratamiento de esta patología”. Por un parte, adalimumab actúa sobre una diana terapéutica, en este caso el TNF-α, lo que por tanto constituye “una ventaja respecto al tratamiento con corticosteroides e inmunosupresores”, medicamentos que no ponen el enfoque sobre una diana terapéutica, “sino que actúan sobre muchas líneas celulares. En ese sentido, el nuevo tratamiento va a ser más selectivo y va a actuar sobre una diana terapéutica, factor que aporta ventajas significativas”, especifica. Y, por otra parte, cabe destacar que adalimumab mejora la calidad de vida del paciente y favorece el cumplimiento terapéutico porque se administra por vía subcutánea cada 15 días, lo que “supone una gran ventaja respecto a los tratamientos con corticosteroides e inmunosupresores, que deben ser administrados a diario”, señala el presidente de SEIO.

Infografía sobre los síntomas más frecuentes de uveítis
Fuente: AbbVie / Agencia Ketchum / AUVEA (Asociación de Pacientes de Uveítis)
Con adalimumab, menor riesgo de disminución de la agudeza visual
Adalimumab se dirige e interviene en el bloqueo del TNF-α, una fuente específica de inflamación que puede desempeñar un papel en la uveítis.[14,15] La opinión del CHMP se basa en los resultados de dos estudios fundamentales de fase 3, VISUAL-I y VISUAL-II, los cuales demostraron que los pacientes con uveítis no infecciosa intermedia, posterior activa y controlada y panuevítis tratados con adalimumab tenían un riesgo significativamente menor de exacerbación uveítica o disminución de la agudeza visual, en comparación con el placebo. El perfil de seguridad de los pacientes con uveítis tratados con adalimumab en semanas alternas coincidía con el perfil de seguridad conocido de adalimumab.[14,15]
Los ensayos clínicos fundamentales investigaron la uveítis intermedia, posterior no infecciosa activa e inactiva y la panuveítis. Ambos ensayos fueron doble enmascarado, aleatorizados y controlados con placebo. Los ensayos clínicos VISUAL-I y VISUAL-II siguieron un esquema de aleatorización 1:1 y los pacientes tratados con adalimumab recibieron una dosis de carga basal de 80 mg seguido de 40 mg administrados por inyección subcutánea en semanas alternas durante un período de hasta 80 semanas. El criterio principal de valoración en los estudios VISUAL-I y VISUAL-II fue el tiempo hasta el fracaso del tratamiento (FT). Para que se considerase un FT, debía observarse uno cualquiera de estos cuatro criterios en al menos uno de los ojos: lesiones nuevas, reacción celular en la cámara anterior (AC), opacidad vítrea y agudeza visual.[14,15]
En el estudio VISUAL-I se observó que, en comparación con el placebo, los pacientes tratados con adalimumab tenían menos probabilidades de experimentar FT (cociente de riesgo = 0,5; IC 95%, 0,36–0,70; P<0,001). La mediana del tiempo hasta el FT se prolongó en el 87%, desde los 3 meses para el placebo (PBO) hasta los 5,6 meses para Adalimumab.[14] En el estudio VISUAL-II, la mediana del tiempo hasta el FT fue de 8,3 meses para el placebo (PBO) y no fue estimable para adalimumab (ADA), ya que más de la mitad de los pacientes tratados con ADA no experimentaron FT (cociente de riesgos = 0,57; IC 95%, 0,39-0,84; P=0,004). No se observaron diferencias significativas entre acontecimientos adversos graves (AAG), infecciones graves y la tasa global de acontecimientos adversos (AA) entre adalimumab y placebo.[15]
Adalimumab está en condiciones de beneficiar no solamente a aquellos pacientes refractarios a los corticosteroides -entendiendo por una uveítis refractaria la que precisa un tratamiento diario de corticosteroides mayor de 10 miligramos/día- y a aquellos que, a pesar de tener un control de la uveítis con estos fármacos, sufren los efectos secundarios anteriormente descritos, sino que también puede aportar mucho a un subgrupo de sujetos en los que la uveítis es muy severa debido a la aparición de secuelas visuales importantes: estamos hablando de la uveítis secundaria o enfermedad de Behçet. “Probablemente, con estos pacientes ya de entrada se podría hacer un tratamiento inicial con adalimumab y no tener que esperar al tratamiento crónico con corticosteroides, porque sabemos que adalimumab es efectivo y al mismo tiempo va a evitar los efectos secundarios de la medicación con corticosteroides”, afirma el director del Instituto de Oftalmología (ICOF) del Hospital Clínic de Barcelona.
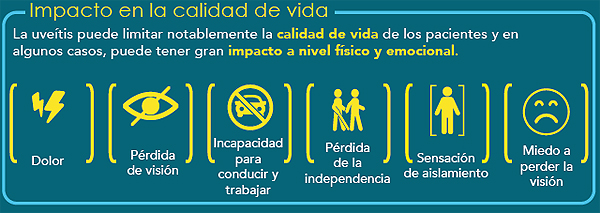
Infografía sobre el impacto de la uveítis en la calidad de vida de los pacientes
Fuente: AbbVie / Agencia Ketchum / AUVEA (Asociación de Pacientes de Uveítis)
Indicaciones terapéuticas de adalimumab en la UE[16]
Adalimumab está aprobado en adultos para su uso en la artritis reumatoide moderada o grave, la espondilitis anquilosante (EA) activa grave, la espondiloartritis axial grave sin signos radiográficos de EA, la psoriasis en placas crónica moderada a grave, la artritis psoriásica activa y progresiva, la enfermedad de Crohn activa moderada o grave, la colitis ulcerosa activa moderada o grave y la hidradenitis supurativa moderada a grave. Adalimumab está aprobado en pacientes pediátricos para su uso en la artritis asociada a entesitis, la psoriasis en placas grave, la enfermedad de Crohn activa grave y la artritis idiopática juvenil poliarticular activa.
Información importante de seguridad en la UE[16]
Adalimumab está contraindicado en pacientes con tuberculosis activa u otras infecciones graves, como sepsis, e infecciones oportunistas y en pacientes con insuficiencia cardiaca de moderada a grave (NYHA clase III/IV). También está contraindicado en pacientes con hipersensibilidad al principio activo o a cualquiera de sus excipientes. El uso de adalimumab aumenta el riesgo de desarrollar infecciones graves que, en casos raros, pueden ser potencialmente mortales. Se han descrito casos raros de linfoma y leucemia en pacientes tratados con adalimumab. Raramente, se ha observado un tipo grave de cáncer llamado linfoma hepatoesplénico de linfocitos T que, con frecuencia, tiene como resultado la muerte. No se puede excluir un riesgo de desarrollo de neoplasias malignas en pacientes tratados con antagonistas del TNF.
Los acontecimientos adversos notificados con mayor frecuencia en todas las indicaciones fueron infecciones respiratorias, reacciones en el sitio de inyección, cefalea y dolor musculoesquelético.
‘Cavidad Anoftálmica y Prótesis Oculares’
En otro orden de cosas, recientemente se ha presentado el libro ‘Cavidad Anoftálmica y Prótesis Oculares’, del que son coautores el profesor de la UPV-EHU Roberto Fernández Hermida y la doctora Bárbara Berasategui Fernández, miembros de la sección de Cirugía de la Órbita y Oculoplástica del Hospital de Cruces, así como del Instituto Clínico Quirúrgico de Oftalmología (ICQO), según se ha sabido con motivo de la celebración en Bilbao de la vigésimo-sexta edición del congreso SECPOO, organizado por la Sociedad Española de Cirugía Plástica Ocular y Orbitaria. El libro recoge también aportaciones de 28 colaboradores procedentes de diversas universidades, hospitales y centros sanitarios de toda España, así como de la empresa AJL Ophthalmic, especializada en la fabricación de implantes de oculoplastia, han indicado desde AJL Ophthalmic.

Fuente: AJL Ophthalmic
Referencias
1. www.alfredoadan.es
2. Durrani OM, Tehrani NN, Marr JE, Moradi P, Stavrou P, Murray PI. Degree, duration, and causes of visual loss in uveitis. Br J of Ophthalmol. 2004;88(9):1159-1162.
3. Siddique SS, Suelves AM, Baheti U. Glaucoma and Uveitis. Survey of Ophthalmology 58(1-10).
4. Wakefield D, Chang JH. Epidemiology of Uveitis. International Ophthalmology Clinics. 2005;45(2):1–13. doi:10.1097/01.iio.0000155938.83083.94.
5. Nussenblatt RB. The natural history of uveitis. Int Ophthalmol. 1990;14:303–308.
6. Rothova A, Suttorp-van Schulten MS, Frits Treffers W, et al. Causes and frequency of blindness in patients with intraocular inflammatory disease. Br J Ophthalmol. 1996;80: 332–336.
7. Jabs DA., Busingye J. Approach to Diagnosis of Uveitides. Am J Ophthal. 2013; 156(2):228–236.
8. Barsani-Asenbauer T, Maca SM, Mejdoubi L, Emminger W, Machold K, Auer H. Uveitis- a rare disease often associated with systemic diseases and infections- a systematic review of 2619 patients. Orphanet J Rare Diseases. 2012; 7(57).
9. Jabs DA, Rosenbaum JT, Foster CS, et al. Guidelines for the use of immunosuppressive drugs in patients with ocular inflammatory disorders: recommendations of an expert panel. Am J Ophthalmol. 2000;130(4):492-513.
10. Harman LE, Margo CE, Roetzheim RG. Uveitis: the collaborative diagnostic evaluation. Am Fam Physician. 2014;90(10):711-716.
11. LeHoang P. The gold standard of noninfectious uveitis: corticosteroids. Dev Ophthalmol. 2012;51:7-28.
12. Agrawal RV, Murthy S, Sangwan V, et al. Current approach in diagnosis and management of anterior uveitis. Indian J Ophthalmol. 2010;58(1):1-23.
13. Lee FF, Foster CS. Pharmacotherapy of uveitis. Expert Opin Pharmacother. 2010;11(7):1135-1146.
14. Brezin AP, Kestelyn P, Van Calster J, Jaffe GJ, Thorne JE, Scales D, Franco P, Dick AD, Nguyen QD, Suhler EB, Camez A, Song AP, Kron M, Tari S, Rosenbaum JT, Heiligenhaus A. Adalimumab in Patients with Active, Noninfectious Uveitis Using High-Dose Corticosteroids [abstract]. Arthritis Rheumatol. 2015; 67 (suppl 10). http://acrabstracts.org/abstract/adalimumab-in-patients-with-active-noninfectious-uveitis-using-high-dose-corticosteroids/. Accessed April 26, 2016.
15. Nguyen QD, Kurup SK, Merrill P, Sheppard J, Van Calster J, Dick AD, Jaffe G, Mackensen F, Rosenbaum JT, Schlaen A, Camez A, Tari S, Kron M, Song A, Brezin A. Adalimumab in Patients with Inactive, Non-Infectious Uveitis Requiring Systemic Treatment [abstract]. Arthritis Rheumatol. 2015; 67 (suppl 10). http://acrabstracts.org/abstract/adalimumab-in-patients-with-inactive-non-infectious-uveitis-requiring-systemic-treatment/. Accessed April 26, 2016.
16. HUMIRA [Summary of Product Characteristics]. AbbVie Ltd. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-Product_Information/human/000481/WC500050870.pdf. Last updated January 28, 2016. Accessed April 26, 2016.




