Dra. Blanca Madurga Patuel / Dr. José María Molero García
1. Introducción
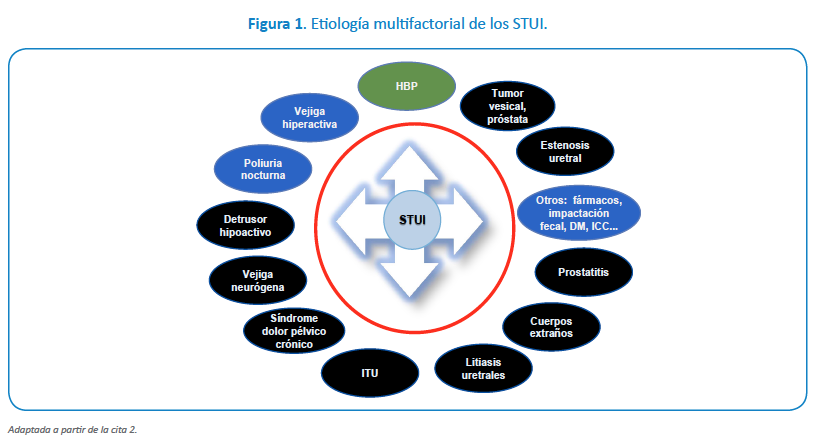
Los síntomas del tracto urinario inferior (STUI) afectan a una elevada proporción de varones a partir de los 40 años (62,5%), aumentando su frecuencia con la edad. Son un motivo frecuente de consulta de AP y de urología. En el estudio EpiLUTS, la prevalencia en varones de al menos un STUI, "a veces" fue del 72,3% y del 47,9% para "a menudo"1. Los STUI en el varón suelen ser mixtos, con predominio en la mayoría de los casos de los síntomas de llenado1. Aunque la hiperplasia benigna de próstata (HBP) puede estar presente hasta en 2/3 de los varones con síntomas, la etiología de los STUI es multifactorial (Figura 1)1,2.

Dra. Blanca Madurga Patuel y Dr. José María Molero García
Fuente: AEU-RG comunicación / Archivo
La HBP es un fenómeno histopatológico caracterizado por la hiperplasia, generalmente multinodular del tejido glandular epitelial-estromal y muscular, para formar adenomas que suele conllevar el crecimiento de la glándula3. La HBP histológica produce obstrucción por compresión o distorsión de la salida de la vejiga3,4. La HBP clínica hace referencia al crecimiento benigno de la próstata, asociado a una obstrucción a la salida de la orina y que se manifiesta clínicamente con STUI de tipo mixto, con molestias y por la presencia de complicaciones3,4. La obstrucción es consecuencia del adenoma, no la causa de la HBP clínica3 y se correlaciona mejor con el riesgo de complicaciones que con la expresión de síntomas. Va a depender más de la localización que del tamaño del adenoma. El adenoma del cuello vesical, en la zona periuretral que forma el lóbulo medio, distorsionaría la salida de la vejiga y causaría una obstrucción grave incluso si es el tamaño pequeño, a diferencia de los ubicados en la zona de transición que forma los lóbulos laterales3,4.
La prevalencia de HBP histológica es muy elevada y aumenta con la edad. Afecta entre el 8-10% en varones de 31 a 40 años, el 40-50% en varones de 50 a 60 años y más del 80% en varones de más de 80 años. Entre el 25-50% de los pacientes que presentan HBP histológica presentan síntomas relacionados5. En relación con la HBP clínica, la prevalencia en España se calculó en el 11,8% en varones mayores de 40 años (0,75% entre 40 y 49 años, 30% en mayores de 70 años)6.
Aunque la HBP esté presente, el origen de los síntomas no se atribuye exclusivamente a la próstata. El tracto urinario inferior del varón se considera como una unidad funcional vesicoprostática y los síntomas van a depender de las tres fases del ciclo miccional. La vejiga juega un papel importante en la presencia y características de los STUI en varones con HBP. El 48-68% de varones con obstrucción infravesical, probablemente relacionada con HBP, presenta signos urodinámicos de VH por hiperactividad del detrusor7.
Aunque los STUI en el varón rara vez amenazan la vida, impactan negativamente en la calidad de vida, interfiriendo con la vida diaria, personal, laboral, hábitos de vida, función sexual y el sueño2,8. Además, la obstrucción grave conduce a mayor riesgo de complicaciones2,8-10. Los síntomas de llenado, principalmente urgencia, nocturia y frecuencia miccional, son los más prevalentes y los que más afectan la calidad de vida pueden aparecer hasta en un 30% de los hombres mayores de 65 años2,8.
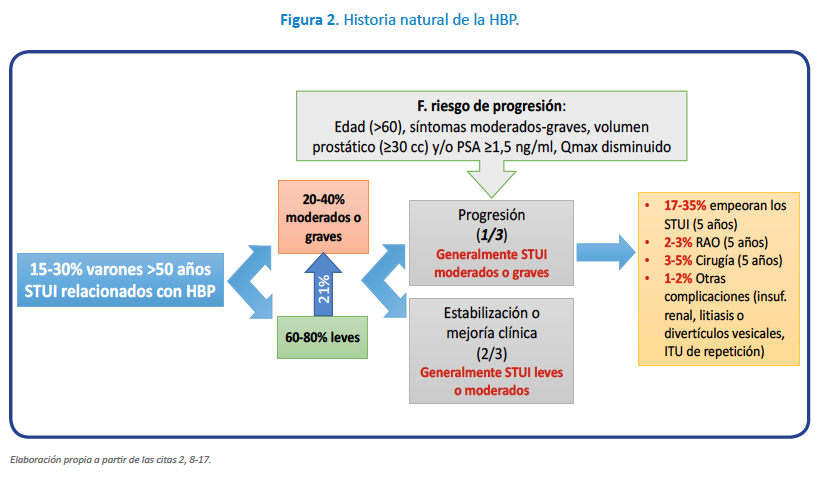
La HBP histológica progresa lentamente con la edad. Múltiples estudios han demostrado una buena correlación entre protrusión prostática intravesical y el volumen de la próstata y grado variable de obstrucción prostática benigna3,4. A nivel clínico, la progresión se caracteriza principalmente por un deterioro de los STUI con el tiempo (1/3 en 5 años), y en algunos pacientes por la aparición de resultados graves, como la retención urinaria aguda (3,7% en 5 años) y la necesidad de cirugía relacionada con la HBP (2-5% en 5 años) (Figura 2)2,8,10-17.
El origen multifactorial y complejo de los STUI obliga a un diagnóstico detallado para planear la mejor estrategia terapéutica. Además, la tendencia a la progresión clínica de la HBP justifica la necesidad de realizar un seguimiento clínico periódico, para comprobar respuesta clínica y el diagnóstico precoz de complicaciones2,7,8. El proceso asistencial debe ser coordinado y compartido entre médicos de familia de AP y urología.
2. Manejo clínico de los STUI en el varón y seguimiento
2.1 Valoración diagnóstica inicial y diagnóstico diferencial
Los objetivos de la valoración inicial de los varones con STUI serían2,8,9:
a) Clasificar a los pacientes con STUI en función de los síntomas predominantes.
b) Realizar un diagnóstico diferencial de los STUI (Figura 1).
c) Conocer el grado de gravedad de los STUI.
d) Establecer un diagnóstico específico de HBP.
e) Detectar la presencia de complicaciones y otras situaciones susceptibles de ampliar el estudio por urología.
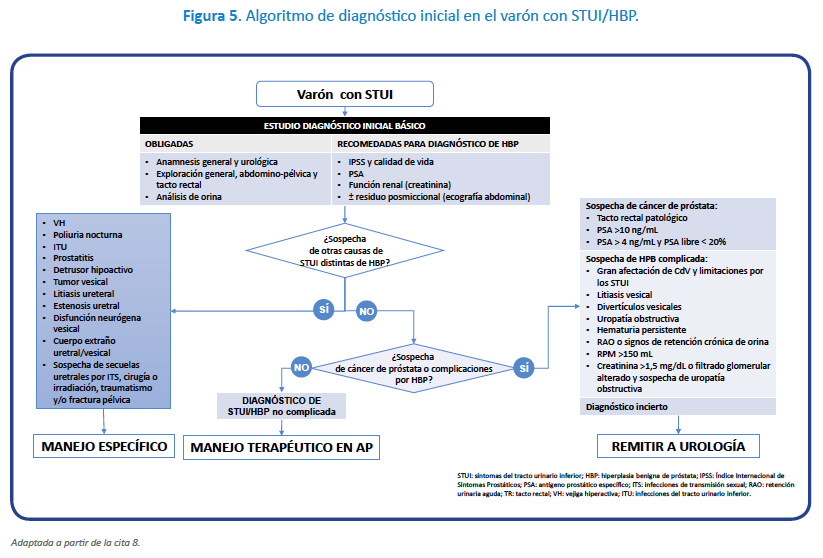
Es preciso racionalizar el uso adecuado y secuencial de las pruebas complementarias en la valoración diagnóstica de los varones con STUI. Las pruebas diagnósticas se pueden clasificar en diferentes categorías en función de la prioridad en su realización y de la necesidad de realizarlas (Figura 3)8,9.
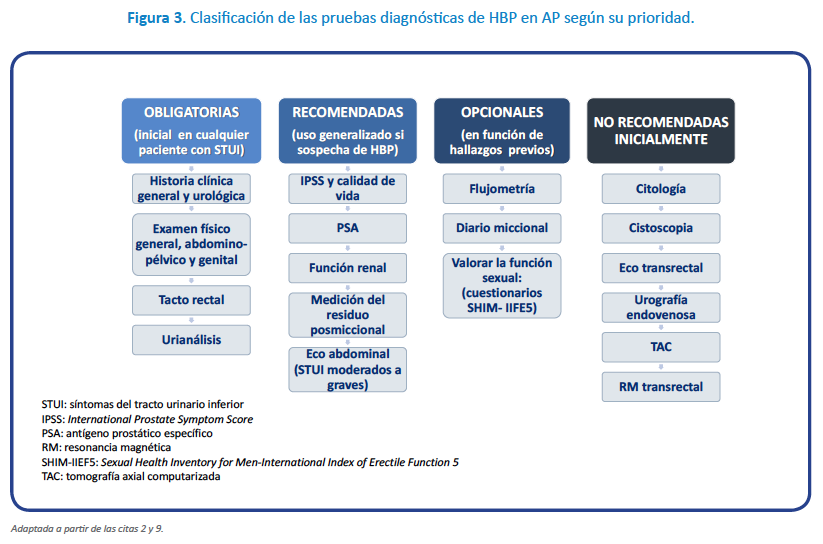
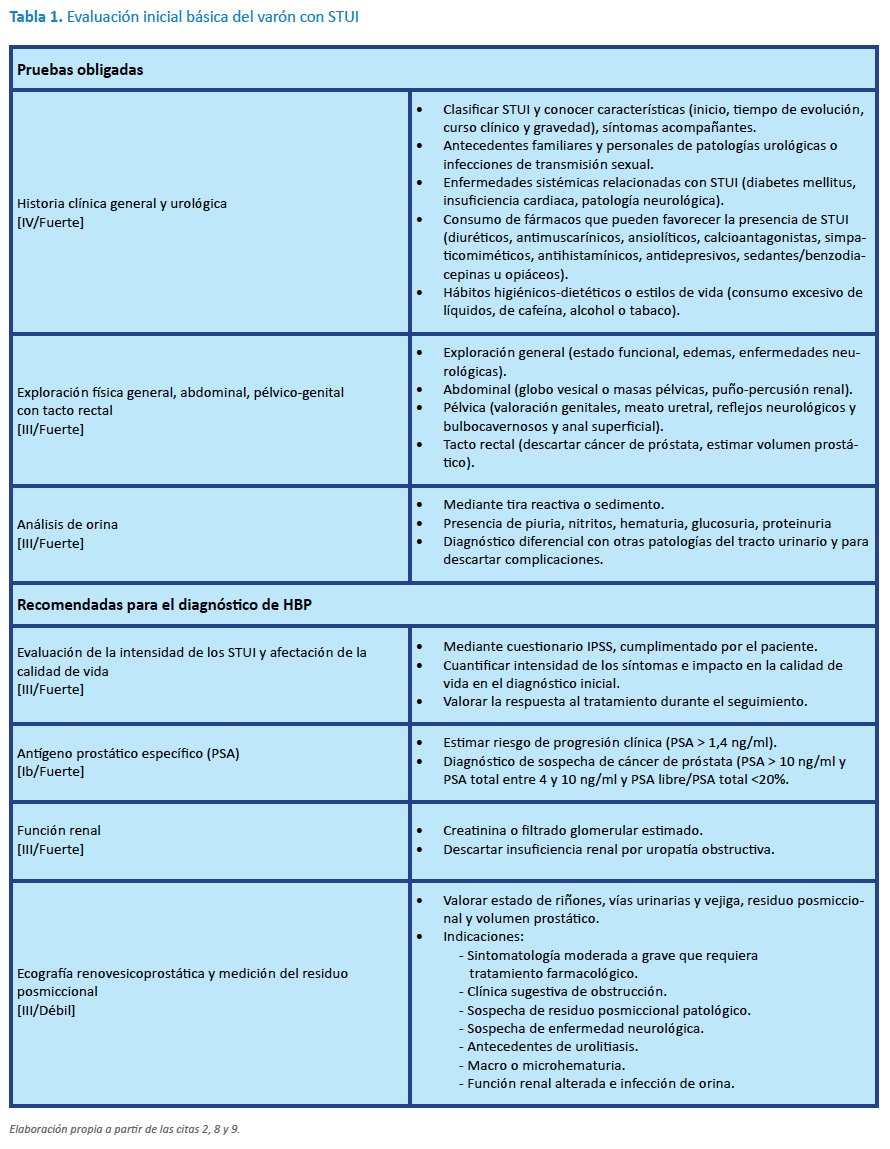
El diagnóstico de la HBP es clínico mediante las pruebas obligatorias y recomendadas (Tabla 1).
Como pruebas opcionales, por la frecuente implicación de la vejiga en la sintomatología, ante la presencia de nocturia, escapes de orina o predominio de los síntomas de llenado, se deberían valorar los hábitos miccionales mediante un diario miccional de 3 días (DM3d) (NdE III, GR fuerte)2,8,9. Ante la presencia de cualquier tipo de disfunción de la función eréctil, se recomienda la valoración de posibles alteraciones de la esfera sexual mediante el cuestionario SHIM, cuestionario abreviado del Índice Internacional de Función Eréctil (IIFE) (NdE IIb, GR débil)2,8,9. La flujometría (NdE IIb, GR débil), es una prueba poco accesible a los médicos de AP. Tiene utilidad en la correlación de los síntomas con los hallazgos objetivos de obstrucción, especialmente cuando hay discordancia y para el seguimiento de los resultados del tratamiento8,9. No obstante, la información que aporta se puede obtener de forma indirecta mediante la cuantificación del residuo posmiccional8,9.
2.2 Seguimiento clínico de los varones con STUI relacionado con HBP
La necesidad de realizar un seguimiento clínico periódico y estandarizado se justifica por la tendencia a la progresión clínica de los varones con HBP con la edad, así como la necesidad de monitorizar la respuesta clínica y la adherencia a las medidas terapéuticas adoptadas. Aunque la progresión es potencialmente una evolución natural de la HBP, atendiendo al proceso histológico, a nivel clínico no se produce en todos los pacientes (Figura 2). La forma más frecuente de progresión es el empeoramiento de los síntomas y en menor grado la aparición de complicaciones como la retención aguda de orina o la necesidad de cirugía por el empeoramiento de la HBP10-17.
El seguimiento del varón con STUI/HBP debe contemplar la valoración de la respuesta al tratamiento inicial, así como la monitorización de la evolución clínica a largo plazo. En los pacientes que no requieren tratamiento quirúrgico, el seguimiento lo realizará el médico de familia en Atención Primaria7,8. Se debe diferenciar entre el seguimiento al inicio del tratamiento farmacológico y el que se realiza en situación estable.
El seguimiento se realiza mediante la anamnesis de síntomas, comprobando también el cumplimiento terapéutico y la repetición del cuestionario IPSS. En cualquier visita de seguimiento, se considera una buena respuesta al tratamiento la reducción de la puntuación ≥ 4 puntos respecto a la obtenida en el momento del diagnóstico inicial. Si se logra esta reducción en la puntuación, se continuará el tratamiento pautado. Cuando se produce un empeoramiento objetivo de los síntomas (la puntuación del cuestionario IPSS respecto a la basal no se reduce ≥ 4 puntos o aumenta), hay que realizar una nueva valoración clínica, similar al diagnóstico inicial, valorar el cambio de tratamiento previo o la derivación a urología, en los pacientes seguidos en AP8,9.
El contenido y la cronología dependerán de la modalidad de tratamiento utilizado. En el caso de varones tratados con 5-ARI, existe la necesidad de interpretar correctamente la variación de las cifras de PSA en la detección de un posible cáncer de próstata, coincidente con la HBP8. Por eso se recomienda la determinación de PSA anual hasta que las expectativas de vida del paciente sean inferiores a 10-15 años. Se debe tomar como referencia el valor más bajo del PSA obtenido durante el tratamiento con finasterida o dutasterida (PSA nadir). Si el valor obtenido en cualquier momento del seguimiento es mayor o igual al PSA nadir, se debe confirmar cumplimiento terapéutico. En ausencia de estas circunstancias, se repetiría la determinación del PSA en 4-6 semanas. Si la nueva determinación indica un valor del PSA ≥ PSA nadir + 0,3, se debería descartar un cáncer de próstata8,9.
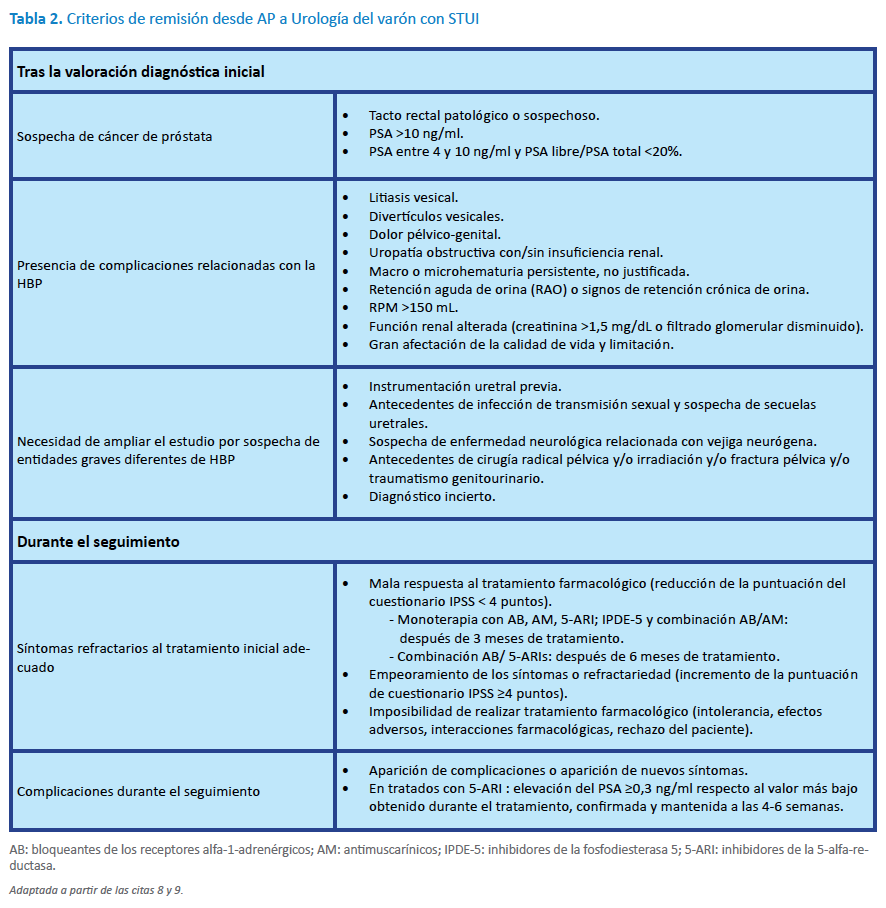
2.3 Criterios de remisión desde AP a urología del varón con STUI
El seguimiento clínico en los casos de STUI-HBP debe realizarse por el médico de familia en el ámbito de Atención Primaria. Existen determinadas situaciones que, a lo largo del diagnóstico y/o seguimiento del paciente, pueden requerir la colaboración conjunta con los urólogos. El objetivo de la derivación es la necesidad de ser sometido a procedimientos diagnósticos específicos, tratamientos quirúrgicos o descartar otras enfermedades simultáneas, en especial el cáncer de próstata (Tabla 2)8,9.
3. Perfiles de pacientes basados en síntomas
Los síntomas del tracto urinario inferior son una fuente constante de consultas de los varones mayores de 40 años, tanto para los especialistas en urología como para los de Atención Primaria, ya que tienen un importante impacto en la calidad de vida y una carga económica sustancial. La comprensión de los STUI como una unidad funcional vesicoprostática y la etiología multifactorial de los síntomas asociados (Figura 1) nos hace ver a los STUI como foco principal, en lugar de solo valorar la HBP, como única responsable de toda la clínica. Las guías clínicas han ido evolucionando con el paso del tiempo y nos han recomendado unas pautas de diagnóstico y tratamiento, pero estas nunca deben reemplazar a la experiencia clínica a la hora de tomar decisiones de tratamiento para pacientes individuales, sino que nos deben ayudar a enfocar la toma de decisiones en dependencia de las preferencias y/o circunstancias individuales de cada paciente que acude a nuestra consulta18.
Basándonos en la anterior reflexión, es fácil comprender la premisa de que “nada sirve para todo”. El enfoque del paciente ha cambiado por uno más amplio y a la vez más individual, ya que tras la valoración de cada paciente podremos proporcionar un tratamiento específico para el perfil que cada uno tenga.
El concepto de unidad funcional vesicoprostática nos hace valorar los STUI en dependencia de las tres fases del ciclo miccional, es decir hablamos de síntomas de llenado, de vaciado y posmiccionales (Figura 4)19.
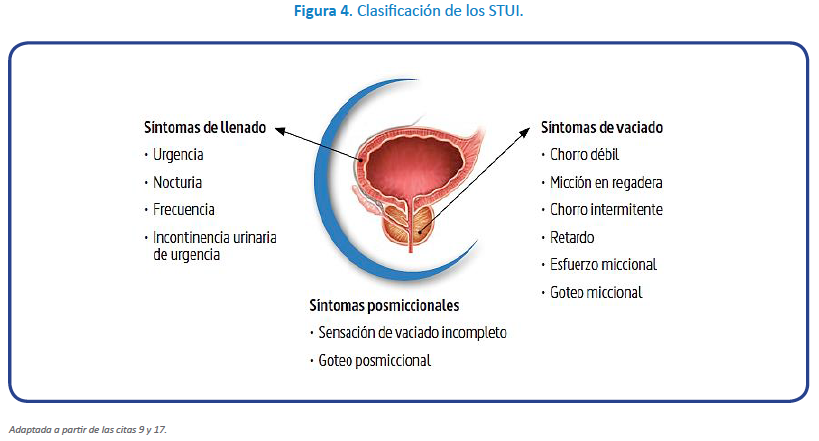
Por tanto, la evaluación del paciente es algo más compleja que en los tiempos en los que se pensaba que la HBP era la causante de todos los síntomas y la cirugía era la mejor solución. No obstante, esta orientación diagnóstica es posible gracias a las nuevas herramientas que están a nuestro alcance y tras la anamnesis, el tacto rectal y el sedimento urinario, el IPSS20 reorganizado por tipos de síntomas, nos da una muy buena aproximación de los síntomas predominantes en cada paciente, así como una orientación fácil y fiable de la calidad de vida de cada uno de ellos (Figura 3)14. A esto se le añade un diario miccional de 3 días, una analítica con función renal y PSA y la medición del residuo posmiccional y la orientación diagnóstica está prácticamente establecida para empezar un tratamiento de los síntomas del paciente.
Las opciones de manejo de los STUI/HBP que tenemos actualmente disponibles son8:
a) Tratamiento conservador: vigilancia expectante, cambios en el estilo de vida con revisiones periódicas.
b) Tratamiento farmacológico.
c) Tratamiento quirúrgico.
3.1. Tratamiento conservador
Este tratamiento irá destinado a aquellos varones cuyos síntomas son leves-moderados, pero no les ocasiones un deterioro significativo de su calidad de vida. La vigilancia expectante es una buena opción, ya que son pocos los pacientes que presentarán una evolución con RAO y/o complicaciones, y el resto puede permanecer estable durante años14. Una buena recomendación es añadir revisiones cada 6 meses y recomendar el seguimiento de las medidas higiénico-dietéticas y cambios en el estilo de vida.
3.2. Tratamiento farmacológico
Las alternativas farmacológicas son muy variadas, tanto individualmente como las posibles combinaciones existentes para tratar los STUI/HBP. Van a variar en función de los síntomas que más afecten a cada uno de nuestros pacientes; de ahí la necesidad de individualizar y analizar a cada enfermo. Vamos a explicar brevemente los distintos fármacos disponibles según las recomendaciones (Fuerte) de la European Association of Urology (EAU)2.
3.2.1. Bloqueadores de los receptores alfa-1-adrenérgicos
Reducen los síntomas prostáticos en un 30-40% y aumentan el Qmáx hasta en un 25%2. La mejoría aparece a partir de la cuarta semana. No tienen ningún efecto sobre el volumen prostático, no modifican la evolución de la enfermedad o los valores del PSA. Están recomendados en varones con STUI moderados-graves y se debe advertir de los posibles efectos secundarios relacionados con el sistema cardiovascular, como la hipotensión postural, mareos, síncopes y la eyaculación retrógrada.
3.2.2. Inhibidores de la 5 alfa-reductasa (5-ARI)
La eficacia clínica de estos fármacos se valora después de 2-4 años de tratamiento con una mejoría del IPSS del 15-30%, disminuye el tamaño de la próstata un 18-28% y aumenta el Qmáx entre 1,5-2 ml en pacientes con STUI por agrandamiento prostático2. Los efectos clínicos se consiguen al menos a los 6 meses. Están recomendados en pacientes con síntomas moderados-graves en pacientes con próstatas agrandadas (>40 ml) y se debe informar a los pacientes que la mejoría empezará a partir de los 6 meses de tratamiento.
3.2.3. Inhibidores de la fosfodiesterasa 5
Dada la relación existente entre STUI y disfunción eréctil, se realizaron diferentes estudios entre 12 y 64 semanas que demostraron no sólo una mejoría en la función sexual, sino también una disminución de 6 puntos en el IPSS, en pacientes con síntomas especialmente de vaciado2. Solo el tadalafilo 5 mg. ha recibido la autorización de su uso en varones adultos con STUI, con o sin disfunción eréctil.
3.2.4. Agonistas de los receptores beta-3 adrenérgico
El mirabegrón ha sido el primer fármaco de esta clase, y hasta ahora el único, que ha sido aprobado para el tratamiento de la vejiga hiperactiva. Se trata de un potente agonista selectivo de los receptores beta-3 adrenérgicos que a través de la acción sobre dichos receptores aumenta la capacidad de llenado vesical21. Los efectos secundarios de mirabegrón son comparables a los mostrados por placebo, y solo está contraindicado en pacientes con HTA grave no controlada, por lo que siguiendo las Guías de la EAU se recomienda para el tratamiento de varones con STUI moderados-graves con predominio de los síntomas de llenado.
3.2.5. Anticolinérgicos
Estos fármacos son inhibidores competitivos de la acetilcolina, por lo que inhibe la contracción colinérgica de la musculatura vesical. Por este mecanismo de acción, estos fármacos aumentan la capacidad funcional de la vejiga, mejorando los síntomas de llenado. Es frecuente la coexistencia entre VH y obstrucción infravesical por HBP. En el 48-68% de los varones con obstrucción infravesical, se detectan signos urodinámicos de VH/detrusor hiperactivo7,22. La recomendación de su uso es para varones con STUI moderados-graves con predominio de los síntomas de llenado, pero no en varones con un residuo posmiccional > 150 cc2.
3.2.6. Tratamiento combinado con alfabloqueantes y antimuscarínicos
En el caso de asociación entre STUI/ HBP/VH, el tratamiento con monoterapia puede resultar incompleto para estos varones con síntomas mixtos. En el estudio NEPTUNE, la combinación solifenacina 6 mg + 0,4 mg tamsulosina OCAS en pacientes con IPSS ≥ 13 demostró una reducción estadísticamente significativa frente a placebo tanto de la puntuación global del IPSS como de los episodios de urgencia/frecuencia (medido por Total Urgency and Frequency Score [TUFS]), demostrando su mayor eficacia frente a la monoterapia con TOCAS en urgencia/frecuencia23. Según las guías de la EAU, esta terapia combinada está indicada en pacientes con síntomas moderados-graves si el alivio de los síntomas de llenado ha sido insuficiente con monoterapia. Existe un bajo riesgo de retención aguda de orina en varones con residuo posmiccional < 150 ml.
La combinación de tamsulosina OCAS 0,4 mg y solifenacina a dosis de 6 mg mostraba ventajas estadísticamente significativas respecto a monoterapia con tamsulosina en cuanto a los síntomas de llenado, así como mejorías importantes en los parámetros de calidad de vida23. En otro estudio, el tratamiento con terapia de combinación de 6 mg de solifenacina y 0,4 mg tamsulosina OCAS fue eficaz a largo plazo (52 semanas), mostrando una reducción del IPSS total de hasta 9 puntos, a expensas de las subpuntuaciones de llenado (4,3 puntos) y de vaciado (4,7 puntos). La combinación a dosis fija de solifenacina 6 mg y tamsulosina 0,4 mg OCAS está autorizada por la Agencia Española del Medicamento desde 2014. Su indicación aprobada es tratamiento de los síntomas de llenado de moderados a graves (urgencia, aumento de la frecuencia miccional) y de los síntomas de vaciado asociados a la HBP en varones que no responden adecuadamente al tratamiento en monoterapia24. Según un estudio retrospectivo, la combinación de dosis fija (CDF) pudo demostrar frente a la combinación de dosis libre (CDL) una mayor persistencia a los 12 meses (CDF 51,3% vs CDL 29,9%) y un mayor número de días en tratamiento hasta abandono (CDF 414 días vs CDL 112 días)25.
3.2.7. Tratamiento combinado con alfabloqueante y 5-ARI
En varios estudios se ha investigado la eficacia del tratamiento combinado de un alfabloqueante y un 5-ARI en comparación con la eficacia de estos fármacos en monoterapia y placebo. En los estudios iniciales con un seguimiento de 6 a 12 meses se empleó la variación en el IPSS como variable principal de eficacia. En estos ensayos se demostró de forma sistemática que el alfabloqueante fue superior a finasterida en cuanto a reducción de los síntomas, mientras que el tratamiento combinado fue superior al alfabloqueante en monoterapia. En estudios con un grupo placebo, el alfabloqueante fue sistemáticamente más eficaz que placebo, mientras que finasterida no fue sistemáticamente más eficaz que placebo2.
Dos grandes estudios prospectivos, multicéntricos, aleatorizados y doble ciego (MTOPS y CombAT) han demostrado que a largo plazo (5 años) esta terapia combinada es más eficaz que las monoterapias respectivas en la reducción de la evolución clínica global y la incidencia de las complicaciones, incluidos los episodios de RAO y la necesidad de cirugía asociada a la HBP14,15. A diferencia del estudio MTOPS, en el estudio CombAT se utilizó una selección de los pacientes en base al conocimiento previo de los factores de evolución. Se incluyeron a pacientes con igual intensidad de síntomas y mayor volumen prostático. La principal crítica que algunos autores hacen de este estudio es la falta de grupo placebo. Así, en el estudio MTOPS solamente el 17% de los pacientes incluidos en la rama placebo progresaban, y en su mayor parte lo hacían a síntomas (14%), únicamente un 5% precisaron cirugía por la HBP y un 2% sufrieron un episodio de RAO. En el estudio CombAT, el 4,2% de los pacientes tratados con la asociación dutasterida/tamsulosina sufrieron RAO o fueron sometidos a cirugía, frente al 5,2% en el grupo dutasterida y el 11,9% en el grupo tamsulosina. Siguiendo las indicaciones de la EAU, esta combinación está indicada en pacientes con STUI moderados-graves con riesgo de evolución con próstatas mayores de 40 gramos.
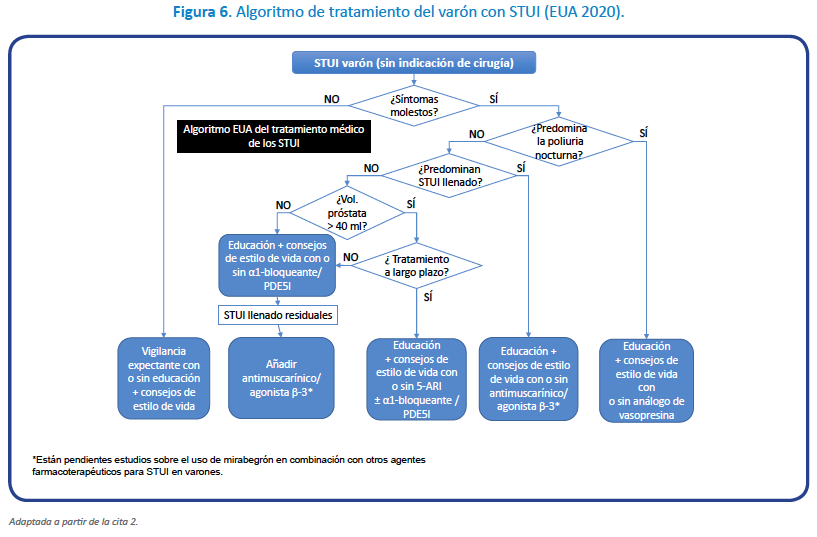
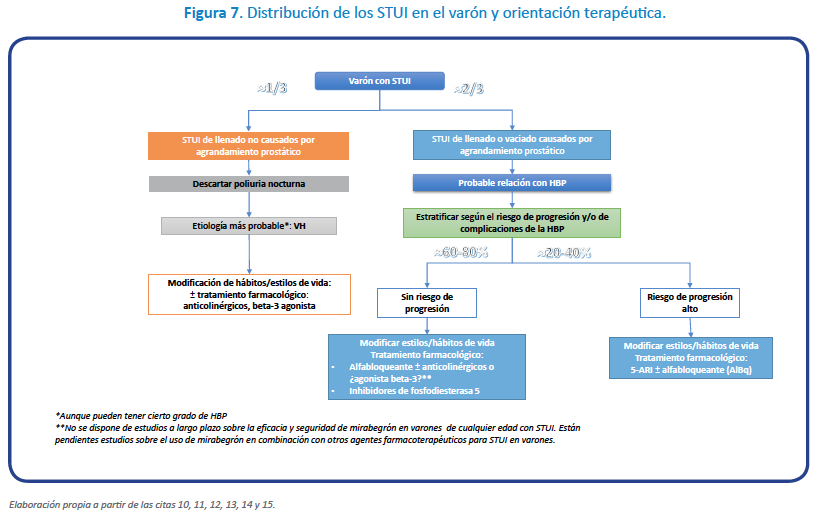
Como vemos, nos encontramos con distintos escenarios que precisan distintos tratamientos individuales, basados en los distintos mecanismos de acción que poseen cada uno de ellos y las características de cada paciente. Todo queda resumido en las figuras 5 a 7.
4. Algoritmos de decisión sobre el manejo diagnóstico y terapéutico del varón con STUI

Bibliografía
1. Coyne KS, Sexton CC, Thompson CL, et al. The prevalence of lower urinary tract symptoms (LUTS) in the USA, the UK and Sweden: results from the Epidemiology of LUTS (EpiLUTS) study. BJU Int. 2009;104(3):352-60.
2. Gravas S (Chair), Cornu JN, Gacci M, et al. EAU guidelines on the management of non-neurogenic male lower urinary tract symptoms (LUTS). [Internet]. Arnhem: EAU; 2020. [Consulta: 24-04-2020]. Disponible en: https://uroweb.org/guideline/treatment-of-non-neurogenic-male-luts/
3. Foo KT. Pathophysiology of clinical benign prostatic hyperplasia. Asian J Urol. 2017;4(3):152-7.
4. Foo KT. What is a disease? What is the disease clinical benign prostatic hyperplasia (BPH)? World J Urol. 2019;37(7):1293-6.
5. Berry SJ, Coffey DS, Walsh PC, et al. The development of human benign prostatic hyperplasia with age. J Urol. 1984;132(3):474-9.
6. Chicharro JA, Burgos R, Sanchez JJ, et al. Prevalence of benign prostatic hyperplasia in Spanish men 40 years old or older. J Urol. 1998;159(3):878-82.
7. Kaplan SA, Roehrborn CG, Abrams P, et al. Antimuscarinics for treatment of storage lower urinary tract symptoms in men: a systematic review. Int J Clin Pract. 2011;65(4):487-507.
8. Brenes FJ, Brotons F, Castiñeiras J, et al. Documento de consenso SEMG, Semergen, semFYC, AEU, sobre Criterios de derivación en HBP para AP. 5G. Madrid: fmaguire.net; 2019. Disponible en: http://mgyf.org/criterios-de-derivacion-en-hiperplasia-benigna-de-prostata-para-atencion-primaria-5g-4a-ed/
9. Esteban M, Alcántara A, Bernal MR, et al. Criterios de derivación y manejo integral del paciente con STUI. Hiperplasia benigna de próstata en varón (HBP). Madrid. Sanidad y Ediciones, S. L. 2018. https://statics-correofarmaceutico.uecdn.es/cms/sites/11/2018/12/criterios_paciente_STUI.pdf
10. Roehrborn CG. BPH progression: concept and key learning from MTOPS, ALTESS, COMBAT, and ALF-ONE. BJU Int. 2008;101(Suppl 3):17–21.
11. Fitzpatrick JM. The natural history of benign prostatic hyperplasia. BJU Int. 2006;97(Suppl 2):3-22.
12. Roehrborn CG. Definition of at-risk patients: baseline variables. BJU Int. 2006;97(Suppl 2):7-22.
13. Jacobsen SJ, Jacobson DJ, Girman CJ, et al. Natural history of prostatism: risk factors for acute urinary retention. J Urol. 1997;158(2):481-7.
14. McConnell JD, Roehrborn CG, Bautista OM, et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med. 2003;349(25):2387-98.
15. Roehrborn CG, Siami P, Barkin J, et al. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT study [published correction appears in Eur Urol. 2010 Nov;58(5):801]. Eur Urol. 2010;57(1):123-31.
16. Kim JH, Lee KS, Kim TH. Evaluation of Clinical Outcomes of Prostatic Urethral Lift for Benign Prostatic Hyperplasia: An Asian Population Study. World J Mens Health. 2019;doi:10.5534/wjmh.190015
17. Cambronero J, Arlandis S, Errando C, et al. Profile of lower urinary tract symptoms in the male and their impact on quality of life. Actas Urol Esp. 2013;37(7):401-7.
18. Burkhard FC (Chair), Bosch JLHR, Cruz F, et al. EAU guidelines on Urinary Incontinence. [Internet]. Arnhem: EAU; 2020. [Consulta: 24-04-2020]. Disponible en: https://uroweb.org/guideline/urinary-incontinence/
19. Chapple CR, Roehrborn CG. A shifted paradigm for the further understanding, evaluation, and treatment of lower urinary tract symptoms in men: focus on the bladder. Eur Urol. 2006;49(4):651-58.
20. Badía X, García-Losa M, Dal-Ré R. Ten-language translation and harmonization of International Prostate Symptom Score: developing a methodology for multinational clinical trials. Eur Urol. 1997;31(2):129-40.
21. Alcántara Montero A. Novedades en el tratamiento médico de la vejiga hiperactiva. Semergen. 2016;42(8):557-65.
22. Hernández C, Brenes F, Moncada I. Utilidad de los alfabloqueantes en el tratamiento de distintos trastornos urológicos. Med Clin. 2012;139(13):582-7.
23. Van Kerrebroeck P, Chapple C, Drogendijk T, et al. Combination therapy with solifenacin and tamsulosin oral controlled absorption system in a single tablet for lower urinary tract symptoms in men: efficacy and safety results from the randomized controlled NEPTUNE trial. Eur Urol. 2013;64(6):1003-12.
24. Drake MJ, Chapple C, Sokol R, et al. Long-term safety and efficacy of single-tablet combinations of solifenacin and tamsulosin oral controlled absorption system in men with storage and voiding lower urinary tract symptoms: results from the NEPTUNE Study and NEPTUNE II open-label extension. Eur Urol. 2015;67(2):262-70.
25. Drake MJ, Bowditch S, Arbe E, et al. A retrospective study of treatment persistence and adherence to α-blocker plus antimuscarinic combination therapies, in men with LUTS/BPH in the Netherlands. BMC Urol. 2017;17:36.
Ficha técnica disponible en el siguiente link:
https://www.astellasapp.es/material/Ficha_Tecnica_Vesomni.pdf




