La Enfermedad de Crohn (EC) y la Colitis Ulcerosa (CU) son las dos formas más frecuentes de Enfermedad Inflamatoria Intestinal (EII). Forman parte de las denominadas Enfermedades Inmunomediadas (IMID), pudiendo presentar, además de la afectación propiamente intestinal, manifestaciones dermatológicas, articulares, cutáneas, hepáticas y oculares, denominadas manifestaciones extraintestinales. La fisiopatología de la EII es compleja y no ha sido aún del todo bien definida, habiéndose identificado hasta el momento algunos factores genéticos y medioambientales que podrían contribuir a su desarrollo[1,2]. Su prevalencia se sitúa, según una revisión sistemática de 2018[3], en torno al 0,3% en países de Europa, América del Norte y Oceanía. Presenta dos picos fundamentales de diagnóstico: uno entre la segunda-cuarta década de la vida y otro en torno a los 60-70 años[4]. No se ha identificado una mayor prevalencia en ninguno de los dos sexos, aunque algunas publicaciones sí que han reportado mayores cifras de EC en mujeres y de CU en hombres[5].
Su diagnóstico se alcanza tras la suma de un conjunto de hallazgos clínicos, endoscópicos, radiológicos y anatomopatológicos compatibles[6,7]. La endoscopia es, por tanto, un pilar fundamental para alcanzar el diagnóstico de la EII, pero también juega un papel muy importante en otros aspectos de la enfermedad, como en la prevención de neoplasias y el tratamiento de complicaciones.

Dr. Alejandro Viejo Almanzor
Fuente: SEED
Endoscopia en el diagnóstico inicial de la EII
La ileo-colonoscopia se considera la prueba de elección a realizar ante la sospecha clínica de EII del adulto. Con esta técnica se consigue hacer una valoración detallada de la mucosa recto-colónica y del íleon terminal, así como tomar biopsias para un posterior estudio histológico. Los propios hallazgos endoscópicos, tanto en términos morfológicos como de extensión y de actividad inflamatoria, serán en muchas ocasiones suficientes para alcanzar un diagnóstico y poder así clasificar al paciente según escalas de riesgo, e iniciar un tratamiento eficaz de forma precoz. Además de su papel diagnóstico y su capacidad para la toma de muestras, la endoscopia ofrece la posibilidad de realizar terapéutica mediante la resección de lesiones y el tratamiento de complicaciones asociadas a la EII, como se detallará más adelante[8].
A pesar de que la endoscopia digestiva es una técnica invasiva, se considera una prueba segura si se realiza en las condiciones adecuadas y por personal entrenado. Actualmente se recomienda la realización de la endoscopia digestiva bajo sedación, mejorando así el confort del paciente y la calidad de la exploración[9]. En la mayoría de las ocasiones, ésta podrá ser controlada por el propio endoscopista y el equipo de Enfermería siempre que se cuente con los medios y la formación adecuada en la Unidad de Endoscopia, y se haya hecho una correcta valoración previa del paciente[10].
Además del avance en la sedación, en los últimos años también se ha mejorado en la preparación intestinal previa necesaria a la colonoscopia[11,12]. Actualmente se prefieren soluciones de bajo volumen frente a las clásicas de alto volumen, por su mejor tolerancia y cumplimiento, siendo las más habituales aquellas basadas en polietilenglicol (PEG) con ácido ascórbico o en picosulfato de sodio con citrato de magnesio. No se han demostrado diferencias significativas entre el uso de ambas preparaciones, siendo preferible el uso de PEG en pacientes con enfermedad renal conocida, por tener un mejor perfil de seguridad que el resto de preparaciones. Además del cambio en el volumen de la preparación intestinal, también hay recomendaciones acerca del horario de la toma de la preparación, siendo mejor la tolerancia cuando se utiliza la estrategia de dosis partida (Split-dose), la cual consiste en administrar el preparado en dos tomas, una el día antes de la exploración y otra el propio día de la exploración, unas 4-6 h antes en función de las guías que se revisen. Acercar el fin de la toma de la preparación al momento de la colonoscopia mejora la limpieza intestinal, permitiendo detectar lesiones más sutiles.
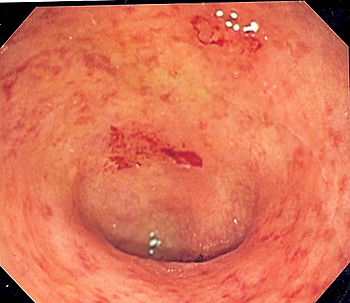
Imagen endoscópica de colon sigmoide afecto de colitis ulcerosa
Endoscopic image of ulcerative colitis showing loss of vascular pattern of the sigmoid colon, granularity and some friability of the mucosa. -- Samir
User: Kauczuk
Fuente: Wikipedia
Los hallazgos endoscópicos típicos de la Colitis Ulcerosa[8] consisten en la afectación continua y difusa desde el margen anal interno en sentido proximal, hasta llegar a la zona no afecta, donde se apreciará un cambio brusco del patrón mucoso. Los cambios que se encontrarán serán pérdida del patrón vascular, edema, eritema, friabilidad y granularidad de la mucosa, exudados de fibrina y moco, erosiones y úlceras confluentes superficiales y/o profundas. La magnitud de los hallazgos dependerá de la gravedad de la afectación. Se debe realizar una adecuada descripción de las lesiones y es recomendable que se utilicen índices endoscópicos de actividad. El más utilizado es el índice de Mayo, el cual es sencillo de utilizar y, en paralelo, es el más reproducible con buena correlación entre endoscopistas expertos[13]. Estratifica a los pacientes en 4 grados, del 0 al 3, siendo 3 el mayor grado de inflamación y 0 la ausencia de ésta. Es importante también valorar la extensión de la enfermedad para poder clasificarla siguiendo los criterios de Montreal en: Proctitis-E1, inflamación exclusivamente rectal; Colitis Distal-E2, inflamación no sobrepasa el ángulo esplénico; Colitis Extensa-E3, inflamación extensa proximal al ángulo esplénico[6].
Además de la afectación continua desde recto hacia tramos proximales típica de la CU, existen también otras formas menos frecuentes de afectación intestinal como son la presencia de un parche de inflamación periapendicular asociado a una colitis distal, y la afectación ileal conocida como ‘ileítis por reflujo’, que se puede apreciar en algunas formas extensas de CU. Tanto la extensión como el grado de actividad de la enfermedad tendrán importante valor pronóstico en el curso natural y serán también de utilidad a la hora de elegir el tratamiento más adecuado, sobre todo en lo que a formulaciones tópicas se refiere, por su galénica especial.
El hallazgo endoscópico típico en la Enfermedad de Crohn[8] es la presencia de una afectación parcheada, discontinua, que se intercala con áreas de mucosa respetada. Las lesiones más características son la úlcera aftoide, la úlcera en sacabocados, las úlceras profundas serpiginosas y el patrón mucoso en empedrado. Dada la naturaleza transmural de la afectación, también es posible encontrar orificios fistulosos y áreas de estenosis durante la exploración endoscópica.
Al igual que en la CU, existen índices endoscópicos que permiten clasificar la patología, aunque son más complejos de realizar, lo que limita su uso en práctica clínica. Los más conocidos son el CDEIS (Crohn's disease endoscopic index of severity) y el SES-CD (simple endoscopic score for Crohn's disease), siendo este último más utilizado en práctica clínica por su menor complejidad a la hora de calcularlo. Ambos valoran la actividad luminal de la EC, en función del tamaño de las úlceras, la superficie y tramos afectados, así como la presencia de estenosis[8]. Existen otros índices de actividad en la EC, como es el índice de Rutgeerts, que se utiliza para valorar recurrencia postquirúrgica y que se detallará más adelante.
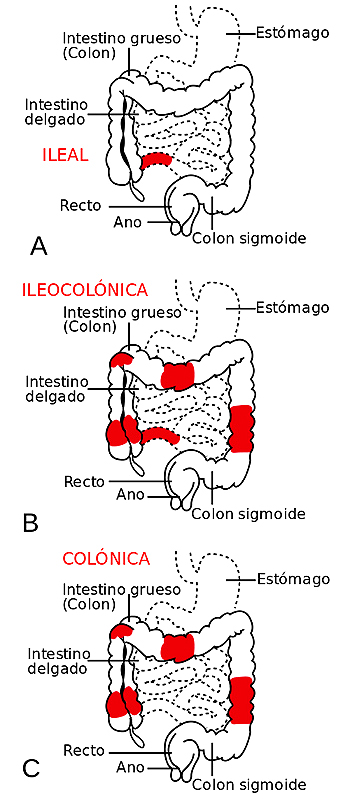
Los tres tipos más frecuentes de Crohn atendiendo a la zona afectada de los intestinos: A- ileal, B- ileocolónica y C- colónica
Autor/a de la imagen: Patterns_of_CD.svg: Samir, vectorized by Fvasconcellos derivative work: Ortisa (talk) - Patterns_of_CD.svg
Fuente: Wikipedia
Dado que la EC es una entidad que puede afectar a cualquier tramo del tubo digestivo, la ileocolonoscopia en ocasiones no será suficiente para hacer el diagnóstico completo de extensión de la enfermedad, siendo necesario complementarla con otras técnicas que estudien el intestino delgado. La afectación de tramos altos (esófago, estómago y duodeno) es excepcional en la edad adulta, por lo que la gastroscopia no está recomendada de forma rutinaria en este grupo de pacientes salvo que presenten síntomas altos, haya sospecha de Enfermedad Celíaca o no se haya podido diferenciar entre EC o CU[14]. Por el contrario, en la edad pediátrica, la gastroscopia se incluye de rutina en el estudio endoscópico de la EII[15], ya que la afectación de tramos altos es frecuente en forma de gastritis o duodenitis. Además, ciertas alteraciones de la mucosa gástrica que aparecen en la EC, como es la presencia de gastritis crónica activa focal no asociada a infección por Helicobacter Pylori, pueden ayudar al diagnóstico diferencial entre ambas entidades (CU vs EC).
Para el estudio del intestino delgado se dispone fundamentalmente de dos técnicas, las cuales son, en muchas ocasiones, complementarias entre sí: la videocápsula endoscópica (VCE) y la enterografía, que puede realizarse por RMN o TC. La enteroscopia es una técnica que no está disponible de forma rutinaria en todos los centros, y dada su mayor complejidad, tiene mayor potencial de complicaciones, con lo que habitualmente se recurre a ella en casos seleccionados, y cuando es necesario realizar algún tipo de gesto terapéutico.
La VCE es un dispositivo que permite el estudio de cualquier parte del tracto gastrointestinal, mediante la toma continuada de fotografías, si bien su mayor desarrollo y aplicación en práctica clínica es para el estudio del intestino delgado. Es una técnica con una alta sensibilidad para la detección de lesiones mucosas del intestino delgado, pero presenta una baja especificidad, lo que obliga a realizar un diagnóstico diferencial con otras entidades, como la enteropatía por AINES, que en muchas ocasiones pueden simular lesiones propias de una EC. Además, presenta la desventaja de que no se pueden tomar muestras para estudio histológico. La principal complicación que puede aparecer en esta técnica es la retención de la cápsula en intestino delgado. El uso de VCE está contraindicado, por tanto, en pacientes con obstrucción intestinal o con sospecha de presentar áreas estenóticas. El riesgo de retención descrito en pacientes con EC sospechada es del 1-2%, y con EC confirmada del 5-13%, mientras que en pacientes con clínica suboclusiva llega al 20%[16]. Se considera retención cuando la cápsula no avanza tras 15 días desde su ingesta, si bien este intervalo temporal ha sido definido de forma arbitraria en base a opiniones de expertos. En caso de que no se produzca paso espontáneo, a veces se puede corregir la situación tras instaurar un tratamiento médico que disminuya la inflamación que provoca la estenosis, con el fin de que la cápsula avance hacia tramos distales y sea expulsada, siendo requerida su extracción en casos concretos. Dicha extracción se puede abordar mediante técnicas endoscópicas, como la enteroscopia, si bien en otras ocasiones habrá que recurrir a la cirugía.
La enterografía, por su parte, permite el estudio del intestino delgado mediante RMN o TC, valorando la extensión de la enfermedad y su patrón inflamatorio, estenosante o penetrante[17]. Tiene como ventaja sobre la VCE su capacidad para el diagnóstico de la enfermedad transmural y de sus complicaciones locales asociadas, como fístulas y abscesos, pero presenta menor sensibilidad para la detección de las lesiones mucosas, así como de la afectación de los tramos más proximales (marco duodenal, yeyuno proximal).
Además del papel en el diagnóstico inicial de la EII, la endoscopia también es útil en otros escenarios como son la valoración de la curación mucosa en una estrategia de tratamiento por objetivos (treat-to-target), la valoración de la recurrencia postquirúrgica, el diagnóstico y seguimiento de la reservoritis, y el cribado de displasia colorrectal.
Endoscopia en la monitorización de la EII
Ilustración sobre la colonoscopia
(Imagen ligeramente modificada) Autor/a del original: Cancer Research UK - Original email from CRUK
Fuente: Wikipedia
Con el mayor conocimiento de la fisiopatología de la EII, la identificación de nuevas dianas terapéuticas con el consiguiente desarrollo de fármacos dirigidos frente a éstas, y la mayor experiencia acumulada en el tratamiento y seguimiento de los pacientes con EC y CU, los objetivos terapéuticos se han ido haciendo cada vez más estrictos. Ya no es suficiente con conseguir que el paciente esté libre de síntomas, sino que el objetivo es que estén libres de síntomas, sin necesidad de corticoides, y con curación mucosa[18]. Esta estrategia parece relacionarse con mejor evolución a largo plazo, y menor necesidad de hospitalización y cirugías. El problema radica fundamentalmente en que no está del todo bien definido qué es curación mucosa, ya que los estudios consideran puntos de corte diferente. De forma general, se considera curación en CU un índice de Mayo endoscópico <1, y en EC un CDEIS <3 o SES-CD <2. De todo esto se deriva que el papel de la endoscopia es fundamental en este escenario de seguimiento de los pacientes, puesto que de los hallazgos endoscópicos se podría derivar un cambio de tratamiento, en función de si se alcanzaron o no los objetivos terapéuticos.
Además de los tratamientos farmacológicos, en el arsenal terapéutico disponible para la EII se incluye la cirugía, siendo ésta más frecuente en la EC que en la CU[6,19]. Según las series, casi el 50% de los pacientes con EC precisarán cirugía en los 5 años posteriores al diagnóstico[20]. Dado que la afectación por EC más frecuente es la ileocecal, la cirugía será mayoritariamente sobre esta zona. Tras la cirugía resectiva, que no es curativa, la enfermedad puede volver a aparecer, y lo hace de forma general sobre la anastomosis ileo-cólica. Diferentes consensos de sociedades científicas, como el del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU), han identificado numerosos factores de riesgo para la recurrencia postquirúrgica (edad joven, hábito tabáquico, enfermedad penetrante, enfermedad perianal, etc.), en función de los cuales se trata a los pacientes con diferentes estrategias que prevengan la recurrencia de la afección[21]. En todos los casos se recomienda la realización de una ileo-colonoscopia de control tras 6-12 meses de la cirugía. La recurrencia postquirúrgica vendrá definida en el índice de Rutgeerts (iR), mediante el cual -en función de la presencia o no de aftas, úlceras e inflamación difusa tanto en la anastomosis como en el neoíleon terminal- se clasificará a los pacientes en diferentes grupos: iR0: ausencia de recurrencia, iR1-2: recurrencia leve-moderada, iR3-4: recurrencia grave. Dicha clasificación tendrá un valor pronóstico en cuanto a la evolución de la EC, y es por ello que, en función de estos hallazgos, se mantendrá la estrategia terapéutica seguida hasta el momento o bien será necesaria una modificación de la misma.
Material quirúrgico
Autor/a de la imagen: E. Arandes / www.farmacosalud.com
Fuente: Gentileza del Hospital Sagrat Cor de Barcelona (IMAGEN DE ARCHIVO)
En el caso de la cirugía de la CU, hasta un 30% de los pacientes pueden requerirla a lo largo de la vida, y de estos, casi el 50% lo harán en los 10 primeros años tras el diagnóstico[22]. La técnica quirúrgica de elección es la proctocolectomía restauradora con reservorio ileoanal, para mantener la continuidad intestinal, si bien en algunas ocasiones no es factible la creación del reservorio o se producen complicaciones inflamatorias (reservoritis) que no responden a los tratamientos y obligan a la creación de una ileostomía definitiva. La reservoritis puede ser aguda o crónica, y asocia disfunción del reservorio con aumento del número de deposiciones, urgencia defecatoria, tenesmo e incontinencia. La endoscopia será útil para evaluar la distribución de la inflamación y cuantificarla, tomar biopsias, monitorizar la respuesta a tratamientos, hacer cribado de displasia y realizar terapéutica endoscópica en caso de complicaciones estenosantes[23]. Los hallazgos endoscópicos incluyen el edema, granularidad y friabilidad de la mucosa, pérdida del patrón vascular y presencia de úlceras. El índice más utilizado para la valoración de los pacientes con reservoritis es el PDAI (Pouchitis Disease Activity Index), que incluye síntomas clínicos y hallazgos endoscópicos e histológicos.
Endoscopia en la prevención de neoplasias colorrectales
Los pacientes con EII de larga evolución, formas extensas de CU y afectación mayor de un tercio en EC de colon, presentan un riesgo aumentado de cáncer colorrectal (CCR). Clásicamente se había descrito un aumento importante de la incidencia de CCR en estos pacientes, llegando a describirse tasas de incidencias cercanas a 4.3/1000 pacientes-año, pero estudios más recientes han observado que el mejor control de la inflamación y la mejoría en la vigilancia ha conllevado una disminución de esta incidencia, cercana a 1.2/1000 pacientes-año, haciéndose similar a la de la población general[24]. Entre los factores de riesgo se encuentran la duración prolongada de la enfermedad superior a 7 años, la afectación extensa, la inflamación crónica mantenida, antecedentes familiares de CCR y ciertas comorbilidades como la Colangitis Esclerosante Primaria (CEP). El CCR en esta población no siempre sigue la vía clásica de adenoma-carcinoma, y la displasia puede aparecer de forma focal, difusa o multifocal sobre lesiones macroscópicamente visibles. Es por ello que está indicado realizar colonoscopia de cribado en esta población.
Los intervalos recomendados varían en función del riesgo individual de cada paciente. Así, se recomienda colonoscopia anual en aquellos pacientes de ‘alto riesgo’, que incluye: colitis extensas con inflamación grave, antecedente de displasia en los últimos 5 años, presencia de estenosis, asociación con CEP o antecedente familiar de CCR en menores de 50 años. Se recomienda colonoscopia cada 2-3 años en aquellos pacientes de ‘riesgo moderado’, que incluye: colitis extensas con inflamación moderada, pólipos inflamatorios o antecedente familiar de CCR en mayores de 50 años. Se recomienda colonoscopia cada 5 años en aquellos pacientes de ‘bajo riesgo’, lo que incluye a las colitis extensas sin inflamación y a todos los demás pacientes que no cumplan criterios de riesgo moderado ni alto riesgo[25].
Clásicamente, las colonoscopias de cribado de displasia se han realizado con endoscopios convencionales con luz blanca incluyendo la toma aleatoria de 2-4 biopsias cada 10 cm, y la toma dirigida de biopsias de lesiones sospechosas de malignidad.
Con la publicación del Consenso SCENIC[26], y mediante la aplicación de cromoendoscopia, se detectó un número importante de lesiones preneoplásicas que habían pasado desapercibidas a la técnica clásica de las biopsias aleatorias. Consiste en la aplicación de un colorante a través del colonoscopio, por lo general índigo carmín o azul de metileno, los cuales delimitan la arquitectura de la mucosa colónica y todas las lesiones que sobre ella se producen, mejorando su detección. Tras ello, habitualmente se utilizan escalas predictoras de patrones mucosos neoplásicos, siendo la escala de Kudo la más utilizada.
Esta técnica se ha ido extendiendo progresivamente[27] hasta convertirse actualmente en la de elección para el cribado de displasia en EII, recomendándose la realización de colonoscopias con endoscopios de alta definición y cromoendoscopia con biopsias dirigidas. Dado que este equipamiento no está disponible en todos los centros, y que precisa de una formación previa por parte de los endoscopistas para el reconocimiento de las lesiones, la colonoscopia clásica con toma de biopsias aleatorias sigue siendo aceptada[25].
Aparte de la cromoendoscopia con colorantes, se han desarrollado otras técnicas para mejorar la detección de lesiones en el contexto del cribado de displasia en EII, como son la cromoendoscopia virtual y la endomicroscopía confocal láser[28].

Autor/a: ractapopulous
Fuente: Pixabay (free photo)
La cromoendoscopia virtual busca conseguir el mismo resalte de lesiones mucosas conseguido con la aplicación de colorantes, pero mediante un sistema digital que modifica la longitud de onda del haz de luz del colonoscopio con posterior procesamiento de la imagen. De este modo, mediante la pulsación de un botón, el procesador del colonoscopio nos devuelve a la pantalla una imagen procesada del colon, donde se resaltan patrones mucosos y vasculares. Este sencillo gesto busca simplificar la técnica de la cromoendoscopia y disminuir así el tiempo de la exploración. Se han desarrollado diferentes sistemas de cromoendoscopia virtual que son comercializados con endoscopios de alta definición. El primero fue el NBI (Narrow Band Imaging) de Olympus, y posteriormente han ido apareciendo otros como FICE de Fuji y i-SCAN de Pentax. Por el momento, diferentes ensayos clínicos han comparado la cromoendoscopia virtual frente a la luz blanca para la detección de displasia en EII, sin que se haya demostrado un aumento en la detección de lesiones pero sí una disminución significativa en el número de biopsias tomadas por paciente. Cuando se comparó la cromoendoscopia virtual con la clásica, el tiempo de retirada fue menor para el grupo de cromoendoscopia virtual, el número de falsos positivos fue mayor en el grupo de cromoendoscopia clásica y la tasa de detección de neoplasias fue menor en el grupo virtual, aunque no llegó a alcanzar diferencias significativas[29]. En la actualidad no está recomendada su realización de forma sistemática.
La endomicroscopía confocal láser es una técnica que consiste en la visualización en tiempo real de la imagen endoscópica con un aumento de hasta 1500x, permitiendo así la valoración de la estructura celular en detalle y su diferenciación entre neoplásica o no neoplásica. Se puede realizar mediante un sistema integrado en el endoscopio o mediante el uso de una sonda por el canal de trabajo. A diferencia de la cromoendoscopia, no aumenta la tasa de detección de lesiones, pero sí que mejora la capacidad diagnóstica y su clasificación en lo que a su naturaleza se refiere, por lo que sería una técnica complementaria a la cromoendoscopia. Actualmente es escasa la experiencia con esta técnica y de momento sus resultados no son de aplicación general.
Terapéutica endoscópica en EII
Además del papel diagnóstico de la endoscopia en la EII, mediante la detección de lesiones sugestivas de EC o CU, la valoración de la actividad mucosa o recurrencia posquirúrgica que implique cambios en la terapéutica, y el papel preventivo en la detección de displasia colorrectal, la endoscopia también tiene un importante papel terapéutico [30-32].
Las principales aplicaciones en este campo son la resección de lesiones y el tratamiento de complicaciones propias de la enfermedad, fundamentalmente las estenosis y la hemorragia. En los últimos años se están desarrollando técnicas para el tratamiento de otras patologías asociadas como fístulas, abscesos y fugas anastomóticas.

Una lámpara de quirófano
Autor/a de la imagen: E. Arandes / www.farmacosalud.com
Fuente: Gentileza del Hospital Sagrat Cor de Barcelona (IMAGEN DE ARCHIVO)
Como se ha comentado anteriormente, se debe realizar cribado sistematizado de la displasia colorrectal en los pacientes con EII. Al igual que en la población general que se somete a una colonoscopia, cuando se detecta una lesión se deben analizar sus características endoscópicas y valorar si es posible su resección de forma completa. Posteriormente debe ser recuperada para su posterior estudio histológico, el cual definirá la naturaleza exacta de la lesión y si el tratamiento endoscópico fue satisfactorio. Las técnicas habituales para realizar este procedimiento incluyen la Resección Endoscópica Mucosa (REM) y la Disección Endoscópica Submucosa (DES). El objetivo del endoscopista debe ser la resección en bloque de la lesión con márgenes libres.
Tanto en la EC como en la CU pueden aparecer estenosis, generalmente como consecuencia del proceso de remodelación tisular que se produce tras la secuencia repetida de inflamación y curación de la mucosa. Dichas estenosis se clasifican en función de su localización (pueden aparecer en cualquier parte del intestino como consecuencia de la propia enfermedad, o sobre anastomosis quirúrgicas), de su número (únicas o múltiples), de su longitud, de su naturaleza (inflamatorias o fibróticas) y de si van asociadas a otras complicaciones como fístulas o abscesos. En función de sus características, se puede valorar un tratamiento médico, endoscópico o quirúrgico. De forma general, las estenosis cortas (<4cm), rectas, con predominio fibrótico y que son accesibles desde el punto de vista endoscópico, pueden ser tratadas mediante esta vía. La técnica más utilizada es la dilatación progresiva con balón hasta 15-20 mm. El éxito técnico, entendido como poder sobrepasar la estenosis, se alcanza hasta en el 90% de los casos en función de las series, pero el éxito clínico, entendido como la resolución de síntomas suboclusivos, es algo menor. La recurrencia de la estenosis es frecuente, pero se trata de una técnica que se puede repetir, alcanzándose de nuevo la resolución. Las complicaciones más frecuentes son la hemorragia y la perforación, si bien se suelen presentar en menos del 5% de los casos. Se han ensayado otros tratamientos endoscópicos, como la colocación de prótesis, la inyección de sustancias antiinflamatorias como esteroides y fármacos anti-TNF, así como la realización de terapia incisional, con resultados prometedores en casos seleccionados.
Otras técnicas endoscópicas intervencionistas que se están desarrollando en el campo de la EII, más cercanas a la cirugía que a la propia endoscopia, incluyen la fistulotomía endoscópica, el drenaje de abscesos perianales e intraabdominales, la inyección intrafístula de sustancias como pegamentos o terapia con células madre, y el tratamiento de complicaciones como fugas anastomóticas agudas y crónicas. La mayoría de estas técnicas se encuentran en desarrollo o se realizan en centros muy especializados, por lo que su papel y posicionamiento en práctica clínica aún está por establecerse.
Referencias
1. Burke KE, Boumitri C, Ananthakrishnan AN. Modifiable Environmental Factors in Inflammatory Bowel Disease. Curr Gastroenterol Rep. 2017; 19(5): 21
2. Jostins L, Ripke S, Weersma RK, Duerr RH, McGovern DP, Hui KY, et al. Host–microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature 2012; 491:119–124
3. Ng SC, Shi HY, Hamidi N, Underwood FE, Tang W, Benchimol EI, et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. Lancet. 2018; 390(10114): 2769-2778
4. Cosnes J, Gower-Rousseau C, Seksik P, Cortot A. Epidemiology and natural history of inflammatory bowel diseases. Gastroenterology. 2011; 140(6): 1785-94
5. Bernstein CN, Wajda A, Svenson LW, MacKenzie A, Koehoorn M, Jackson M, et al. The epidemiology of inflammatory bowel disease in Canada: a population-based study. Am J Gastroenterol 2006; 101:1559–1568
6. Magro F, Gionchetti P, Eliakim R, Ardizzone S, Armuzzi A, Barreiro-de Acosta M, et al, for the European Crohn’s and Colitis Organisation [ECCO], Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis. Part 1: Definitions, Diagnosis, Extra-intestinal Manifestations, Pregnancy, Cancer Surveillance, Surgery, and Ileo-anal Pouch Disorders, J Crohns Colitis. 2017;11(6):649-670
7- Gomollón F, Dignass A, Annese V, Tilg H, Van Assche G, Lindsay JO, et al, on behalf of ECCO. 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 1: Diagnosis and Medical Management. J Crohns Colitis. 2017;11(1):3-25
8. Annese V, Daperno M, Rutter MD, Amiot A, Bossuyt P, East J, et al, on behalf of ECCO, European evidence based consensus for endoscopy in inflammatory bowel disease. J Crohns Colitis. 2013;7(12):982-1018
9. Igea F, Casellas JA, González-Huix F, Gómez-Oliva C, Baudet JS, Cacho G, et al. Sedación en endoscopia digestiva. Guía de prácticaclínica de la Sociedad Española de Endoscopia Digestiva.Rev Esp Enferm Dig 2014;106:195-211
10. Bejarano García A, Martínez-Cara JG, Rodríguez Téllez M. Romero Gómez M. Requisitos para la sedación en Unidades de Endoscopia Digestiva. Recomendaciones de la Sociedad Andaluza de Patología Digestiva. RAPD Online. 2019;42(1):8-17
11. Hassan C, Bretthauer M, Kaminski MF, Polkowski M, Rembacken B, Saunders B, et al. Bowel preparation for colonoscopy: ESGE Guideline. Endoscopy. 2013;45(2):142-50
12. ASGE Standards of Practice Committee, Saltzman JR, Cash BD, Pasha SF, Early DS, Muthusamy VR, et al. Bowel preparation before colonoscopy. Gastrointest Endosc. 2015;81(4):781-94
13. Osada T, Ohkusa T, Yokoyama T, Shibuya T, Sakamoto N, Beppu K, et al. Comparison of several activity indices for the evaluation of endoscopic activity in UC: inter- and intraobserver consistency. Inflamm Bowel Dis 2010;16:192-7
14. Annunziata ML, Caviglia R, Papparella LG, Cicala M. Upper gastrointestinal involvement of Crohn's disease: a prospective study on the role of upper endoscopy in the diagnostic work-up. Dig Dis Sci. 2012;57(6):1618-23
15. Levine A, Griffiths A, Markowitz J, Wilson DC, Turner D, Russell RK, et al. Pediatric modification of the Montreal classification for inflammatory bowel disease: the Paris classification. Inflamm Bowel Dis. 2011;17(6):1314-21
16. Rondonotti E, de Franchis R. Contraindications, complications and special situations. In: Atlas of Capsule Endscopy 2. Herrerías JM, Mascarenhas-Saraiva M. Ed. Sulime diseño de soluciones SL. Pag.94-97
17. Maaser C, Sturm A, Vavricka SR, Kucharzik T, Fiorino G, Annese V, et al. ECCO-ESGAR Guideline for Diagnostic Assessment in IBD Part 1: Initial diagnosis, monitoring of known IBD, detection of complications. J Crohns Colitis. 2019;13(2):144-164
18. Peyrin-Biroulet L, Sandborn W, Sands BE, Reinisch W, Bemelman W, Bryant RV, et al. Selecting therapeutic targets in inflammatory bowel disease (STRIDE): Determining therapeutic goals for treat-to-target. Am J Gastroenterol 2015:110:1324-1338
19. Bemelman WA, Warusavitarne J, Sampietro GM, Serclova Z, Zmora O, Luglio G, et al, on behalf of the European Crohn’s and Colitis Organisation [ECCO] and the European Society of Colo-Proctology [ESCP], ECCO-ESCP Consensus on Surgery for Crohn’s Disease. J Crohns Colitis. 2018;12(1):1-16
20. Frolkis AD, Dykeman J, Negrón ME, Debruyn J, Jette N, Fiest KM, et al. Risk of surgery for inflammatory bowel diseases has decreased over time: a systematic review and meta-analysis of population-based studies. Gastroenterology. 2013;145(5):996-1006
21. Domènech E, López-Sanromán A, Nos P, Vera M, Chaparro M, Esteve M, et al. Recommendations of the Spanish Working Group on Crohn's Disease and Ulcerative Colitis (GETECCU) on the monitoring, prevention and treatment of post-operative recurrence in Crohn's disease. Gastroenterol Hepatol. 2017;40(7):472-483
22. Costa J, Magro F, Caldeira D, Alarcão J, Sousa R, Vaz-Carneiro A. Infliximab reduces hospitalizations and surgery interventions in patients with inflammatory bowel disease: a systematic review and meta-analysis. Inflamm Bowel Dis. 2013;19(10):2098-110
23. Shen B. Endoscopy of the pouch. In: Endoscopy in Inflammatory Bowel Disease. Abreu L, Calvo M, Gonzalez Y, Matallana V, Vera MI. Ed.Elsevier España 2015. Pag. 95-102.
24. Castaño-Milla C, Chaparro M, Gisbert JP. Systematic review with meta-analysis: the declining risk of colorectal cancer in ulcerative colitis. Aliment Pharmacol Ther. 2014;39(7):645-59.
25. Vera Mendoza, MI. Cáncer y enfermedad inflamatoria intestinal. En: Enfermedad Inflamatoria Intestinal, IV Edición. Gomollón F, Hinojosa J, Gassull MA. Ed. Ergon. Pag. 477-484.
26. Laine L, Kaltenbach T, Barkun A, McQuaid KR, Subramanian V, Soetikno R for the SCENIC Guideline Development Panel. SCENIC International Consensus Statement on Surveillance and Management of Dysplasia in Inflammatory Bowel Disease. Gastroenterology 2015;148: 639 – 645
27. Caballal S, Maisterra S, Lopez-Sanroman A, Gimeno-García AZ, Vera MI, Marín-Gabriel JC, et al. Real-life chromoendoscopy for neoplasia detection and characterisation in long-standing IBD. Gut. 2018;67(1):70-78
28. Pellise Urquiza M, Carballal ramil S. Endoscopic technique for colorrectal cancer screening. In: Endoscopy in Inflammatory Bowel Disease. Abreu L, Calvo M, Gonzalez Y, Matallana V, Vera MI. Ed.Elsevier España 2015. Pag. 123-129
29. Pellisé M, López-Cerón M, Rodríguez de Miguel C, Jimeno M, Zabalza M, Ricart E, et al. Narrow-band imaging as an alternative to chromoendoscopy for the detection of dysplasia in long-standing inflammatory bowel disease: a prospective, randomized, crossover study. Gastrointest Endosc. 2011 Oct;74(4):840-8
30. Modha K, Navaneethan U. Advanced therapeutic endoscopist and inflammatory bowel disease: dawn of a new role. World J Gastroenterol. 2014 Apr 7;20(13):3485-94
31. Shen B. Interventional IBD: The Role of Endoscopist in the Multidisciplinary Team Management of IBD. Inflamm Bowel Dis. 2018 Jan 18;24(2):298-309
32. Shen B, Kochhar G, Navaneethan U, Liu X, Farraye FA, Gonzalez-Lama Y, et al, Global Interventional Inflammatory Bowel Disease Group. Role of interventional inflammatory bowel disease in the era of biologic therapy: a position statement from the Global Interventional IBD Group. Gastrointest Endosc. 2019 Feb;89(2):215-237





