El estudio SINGLE, a 48 semanas, demostró que dolutegravir 50mg + abacavir/lamivudina una vez al día fue superior a la combinación de efavirenz/tenofovir/emtricitabina en pacientes VIH-1 naïve al tratamiento antirretroviral (1): un 88% vs un 81% de los pacientes alcanzaron el objetivo primario de eficacia, con una diferencia en la respuesta del 7,4% (IC 95% 2,5% a 12,3%), alcanzándose el criterio de no inferioridad y, además, cumpliéndose el criterio de superioridad predeterminado en el protocolo del estudio. El brazo dolutegravir 50mg + abacavir/lamivudina también mostró mejores resultados desde el punto de vista de tolerabilidad y seguridad. Los resultados presentados en la ponencia corresponden a 96 semanas(2).
SINGLE es un ensayo fase III, aleatorizado, doble ciego, proyectado a 96 semanas con una extensión abierta posterior hasta las 144 semanas, en el que han participado 136 centros de América del Norte, Europa y Australia, que compara las pautas citadas anteriormente (1,2). La aleatorización se estratificó en función de la carga viral basal (mayor o menor de 100.000 c/mL) y la cifra de CD4 (mayor o menor de 200 células/mm3).
“Cuando empezó el estudio, hubo una enmienda mediante la cual se ofrecía a los pacientes continuar el ensayo desde la semana 96 hasta la 144, tras firma de un nuevo consentimiento informado. Prácticamente todos lo hicieron (menos uno en cada brazo). Por otro lado, toda la muestra de 833 pacientes se reclutó entre el 1 de febrero y el 1 de junio de 2011. El último paciente que ha completado las 144 semanas lo hizo a finales de marzo de 2014”, recordó el Dr Berenguer.
En cuanto a las características basales de los pacientes, no hay diferencias entre los dos brazos y debe destacarse que eran pacientes jóvenes, con una mediana de edad de 35 años, con un 16% de mujeres, un 24% de raza negra y coinfectados por virus C de la hepatitis un 7%. El 4% había tenido previamente enfermedades definitorias de SIDA y el 32% tenía una carga viral superior a cinco logaritmos, con una mediana de CD4 de 338 células/mm3, un 14% con una cifra menor de 200 células/mm3 (1,2).
El objetivo primario del estudio era la proporción de pacientes con menos de 50 c/mL según el algoritmo de “Foto fija” (Snapshot) de la FDA, con el resultado ya comentado a favor de dolutegravir 50mg + abacavir/lamivudina y con un intervalo de confianza que confirma la superioridad de esta pauta frente a la de Atripla®.
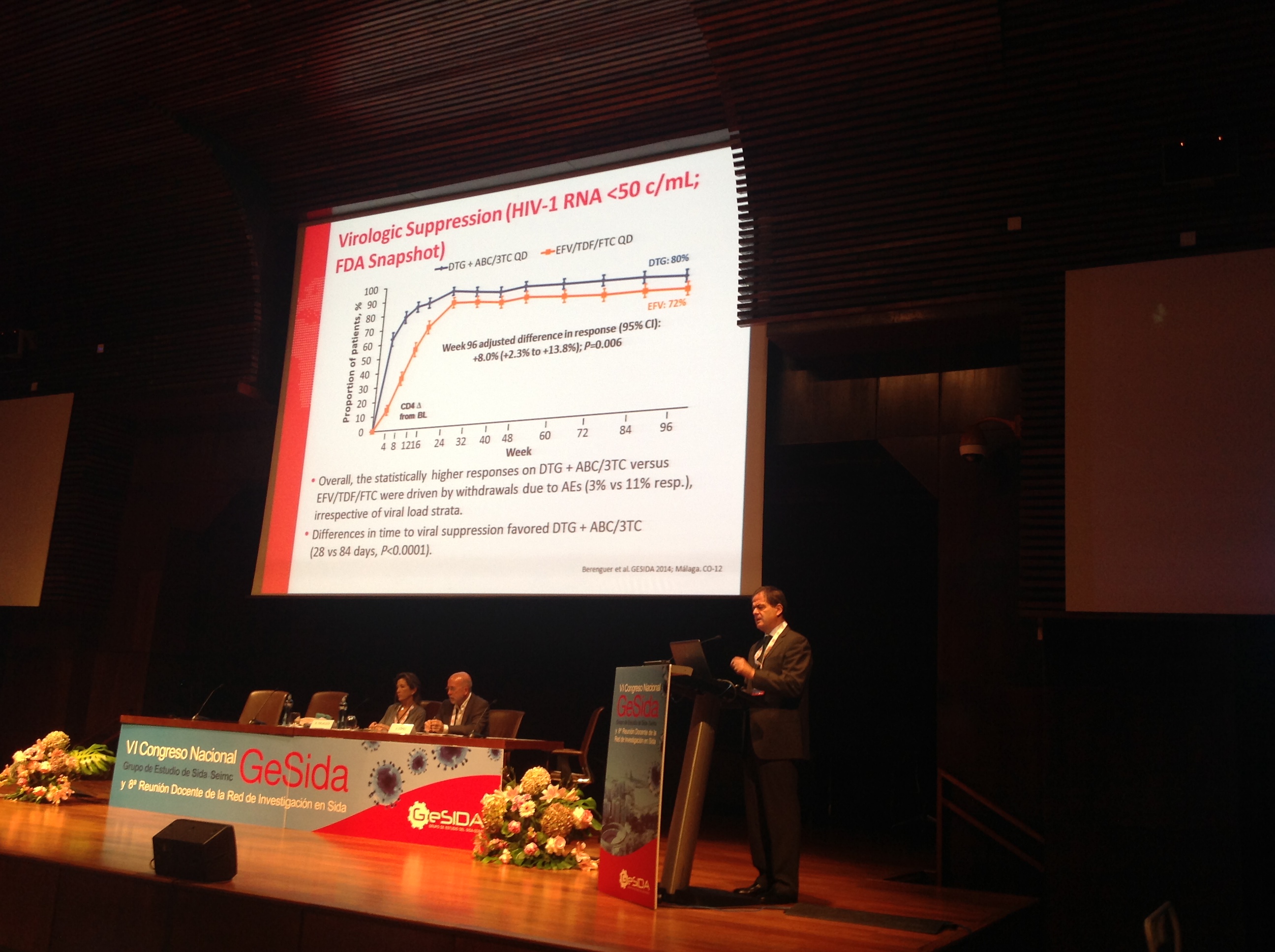
“Las diferencias se deben fundamentalmente a discontinuaciones por razones de seguridad y tolerabilidad: hay menos efectos adversos y menos discontinuaciones por efectos adversos en el brazo de dolutegravir. Desde el punto de vista de la respuesta inmunológica, que es uno de los objetivos secundarios, la ganancia de CD4 en la semana 96 es significativamente superior para los pacientes incluidos en este brazo (325,3 células/mm3 vs 281,4 células/mm3 de la rama efavirenz) (2).
El fallo virológico definido por protocolo fue tener una carga viral por encima de 50 c/mL en o después de la semana 24. Tras dos años, los resultados son iguales, con un 6% en ambas ramas (2). Como recalcó el ponente, “son, en su mayoría, fallos virológicos de bajo grado, con menos de 200 c/mL en el 80% del brazo de dolutegravir y en el 68% en el de efavirenz”.
A todos los pacientes que cumplieron la definición de fracaso virológico se les hizo prueba de resistencia en la primera muestra en la que se documentó dicho fracaso: en ningún paciente del brazo de dolutegravir se demostraron resistencias primarias a ITIAN, a ITINAN y a inhibidores de la integrasa. Sin embargo, sí se registraron en siete pacientes en el brazo efavirenz: uno con resistencia primaria a análogos (K65R) y seis en los que se detectaron mutaciones de resistencia a no nucleósidos (2).
En cuanto a los efectos adversos, se registraron globalmente más relacionados con el tratamiento en el brazo de efavirenz (67% vs 44%). Las principales diferencias se registraron en el ámbito neuropsiquiátrico: mareo (33% con la pauta efavirenz vs 7%), sueños anormales (16% vs 7%), con más insomnio en el brazo dolutegravir (6% vs 10%). Los efectos adversos no globales grado 2-4 fueron de un 5% en el brazo efavirenz y menos del 1% en el de dolutegravir (2).
El resumen de los efectos adversos que motivaron la discontinuación del régimen muestra que un 12% tuvieron que hacerlo en la semana 96 en el brazo efavirenz frente al 3% con la pauta de dolutegravir: a causa de trastornos neuropsiquiátricos un 5% y menos de un 1%, respectivamente; por trastornos del sistema nervioso un 4% y menos de un 1%, con más exantemas en el brazo efavirenz (2).
Desde el punto de vista renal, no se vio ninguna alteración en la proteinuria, medida como el cociente de albúmina/creatinina en orina. Sí se demostró un aumento –esperable y ya conocido– en la creatinina sérica en el brazo de dolutegravir, ya que este fármaco inhibe el transportador OCT2, involucrado en la secreción renal de creatinina (2).
En conclusión, globalmente, dolutegravir + abacavir/lamivudina una vez al día fue superior a la combinación de efavirenz/tenofovir/emtricitabina, con unas diferencias debidas a que se documentó una menor tasa o frecuencia de discontinuación por efectos adversos en el brazo de dolutegravir.
También la pauta basada en dolutegravir fue superior a la basada en efavirenz con respecto a la mejoría inmunológica, con una recuperación de CD4 en la semana 96. Y, en general, la seguridad y tolerabilidad fue superior en el brazo dolutegravir que en el de efavirenz, fundamentalmente porque se dieron menos efectos adversos en el sistema nervioso central y menos exantemas, con menor frecuencia de elevaciones de las transaminasas”, recalcó.
Otro dato destacado por el ponente fue que no se documentó ningún paciente a 96 semanas en el brazo dolutegravir en el que hubiera la emergencia de mutaciones de resistencia a inhibidores de la integrasa o a análogos de nucleósidos acompañantes.
Referencias
(1) Walmsley S et al. Dolutegravir plus abacavir-lamivudine for the treatment of HIV-1 infection. NEJM 2013;369:1807-18
(2) Berenguer et al, GESIDA 2014; Málaga.CO-12
Abreviaturas:
ITIAN: Inhibidor de la transcriptasa inversa análogo de nuclueósido.
ITINAN: Inhibidor de la transcriptasa inversa no análogo de nuclueósido.




