Redacción Farmacosalud.com
“Es bastante mejorable la cuota de mercado de los biosimilares”, sostuvo el Dr. José Antonio Marcos, profesional de Farmacia Hospitalaria del Hospital Virgen Macarena (Sevilla), quien en cierto modo apostó por incrementar dicha cuota teniendo en cuenta el ahorro asociado al uso de ese tipo de fármacos, ya que los biosimilares permiten tratar a un “mayor número de pacientes con el mismo presupuesto”. Marcos participó en el webinar ‘6 preguntas prácticas sobre… Biosimilares en oncología: una nueva forma de innovación en cáncer’ contestando tres de esas seis preguntas, mientras que las otras tres fueron atendidas por el Dr. Joan Albanell, jefe del Servicio de Oncología Médica del Hospital del Mar (Barcelona). La Dra. Ruth Vera, jefa del Servicio de Oncología Médica del Complejo Hospitalario de Navarra, se ocupó de moderar la sesión, cuyo cierre fue a cargo del Dr. Carlos Camps, jefe del Servicio de Oncología Médica del Hospital General de Valencia. El webinar, organizado por la Fundación ECO (Fundación para la Excelencia y la Calidad de la Oncología), contó con el patrocinio de Pfizer y el aval científico de la Sociedad Española de Oncología Médica (SEOM).

Difusión: www.farmacosalud.com
-¿Qué acciones propondría para aumentar el uso de los biosimilares?
Informar y formar sobre los medicamentos biosimilares a los profesionales de la salud (médicos, farmacéuticos, personal de Enfermería) es una de las medidas apuntadas por el Dr. José Antonio Marcos para incrementar el uso de estas moléculas. Desarrollar diferentes programas de educación sanitaria dirigida a los ciudadanos y pacientes para “que se entienda bien qué es un biosimilar y qué nos aporta este fármaco” es otra acción que permitiría eliminar los “miedos o prejuicios” que pueda haber en relación a estos medicamentos, indicó Marcos. Otras acciones pasarían por llevar a cabo iniciativas con impacto mediático o social (creación del Día o la Semana del Biosimilar), y, por otro lado, implantar incentivos destinados a aumentar la prescripción de estos fármacos, entre otras medidas:

SNS: Sistema Nacional de Salud
Difusión: www.farmacosalud.com
Reducir la necesidad de realizar estudios confirmatorios con el fin de que los biosimilares “puedan ser incorporados antes” a la oferta farmacológica, disminuir la barrera de fijación de precios y reembolso, intentar que los biosimilares “tengan un precio justo que sea atractivo para la industria que desarrolla y comercializa estos medicamentos”, y favorecer mediante algún tipo de incentivo su fabricación en la Unión Europea, “más que nada para intentar evitar el desabastecimiento que a veces tenemos de algunos fármacos importantes”, son otras de las medidas propuestas por el Dr. Marcos.
-¿Cuál es el grado de evidencia actual que respalda la intercambiabilidad?
El desarrollo de un biosimilar es diferente con respecto al desarrollo observado en un medicamento de referencia. En el caso del biosimilar, las autoridades regulatorias recomiendan una estrategia escalonada en la que poco a poco se vaya demostrando la similitud de este fármaco: en una primera etapa, en un estudio in vitro se procede a una caracterización analítica destinada a determinar que esta molécula es muy similar a la molécula de referencia; posteriormente, se hacen estudios in vivo (por ejemplo en animales) para comprobar la semejanza en términos de toxicología o de actividad biológica; le siguen investigaciones de farmacocinética y farmacodinámica encaminadas a verificar que la exposición del biosimilar es equivalente a la exposición del medicamento de referencia y que, lógicamente, la versión farmacológica tiene una actividad biológica similar, y se termina con un estudio clínico en el que se confirma la ausencia de diferencias clínicamente significativas entre ambos, valorándose criterios de seguridad, eficacia e inmunogenicidad.
¿Cómo se hace la extrapolación? Respondiendo a 4 preguntas:

PK y PD: farmacocinética y farmacodinámica
Difusión: www.farmacosalud.com
“Cuando respondemos a estas cuatro preguntas y son afirmativas, podemos confirmar que la molécula puede ser extrapolada a otras indicaciones. Por lo tanto, esa molécula es similar”, afirmó el profesional de Farmacia Hospitalaria del Hospital Virgen Macarena. “Yo creo que la extrapolación está totalmente basada en evidencia”, remarcó el Dr. Marcos. Entendiendo que un biosimilar “es equivalente”, ello significa que “es similar en eficacia”, con lo que “podríamos utilizar el biosimilar sin ningún tipo de problema con respecto a la marca comercial”, explicó.
-¿Cómo puede impactar el uso de los biosimilares en la sostenibilidad del SNS?
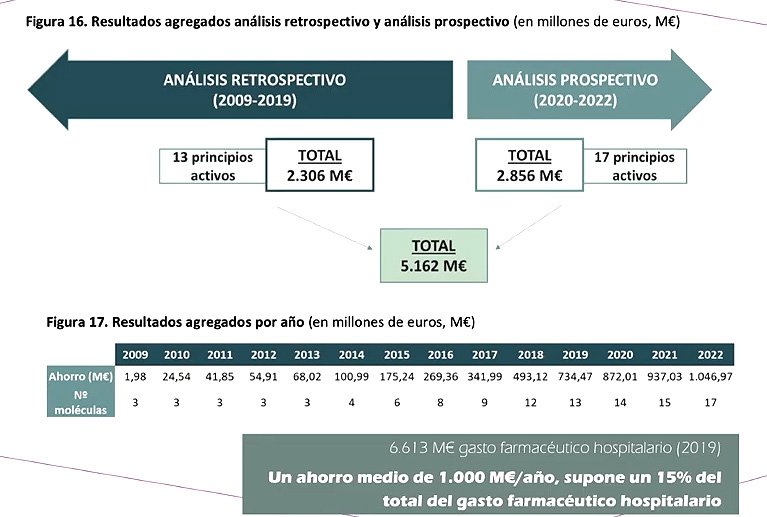
Según diferentes trabajos, el uso de los biosimilares comportó un ahorro entre los años 2009 y 2019 de 2.306 millones de euros. En un análisis prospectivo, se prevé que entre 2020 y 2022, con la utilización de 17 principios activos de biosimilares, el ahorro ascienda hasta los 2.856 millones de euros.
Difusión: www.farmacosalud.com
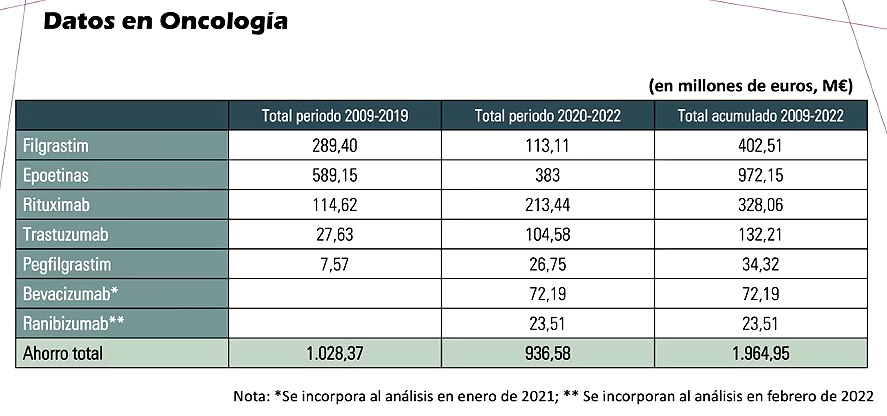
“Es bastante mejorable la cuota de mercado de los biosimilares”, aseveró el especialista. En un análisis de sensibilidad se estimó que, si se alcanzaran cuotas de mercado de un 80%, “podríamos incrementar el ahorro de ese estudio prospectivo en 431 millones de euros”, detalló Marcos. En el caso concreto de la oncología, el ahorro también es muy marcado:
Difusión: www.farmacosalud.com
A juicio del Dr. Marcos, el impacto del uso de biosimilares se traduce en una “mejora del acceso de la innovación a los pacientes y a los médicos”. Además -prosiguió-, “los biosimilares nos aportan innovación en la gestión sanitaria… nos permiten tratar mayor número de pacientes con el mismo presupuesto; incentivan y aceleran la investigación y aumentan la competencia y bajan los precios. En definitiva, lo que conseguimos es tratar a los pacientes con una misma eficacia y seguridad, pero a un coste menor”.
Para conocer en su totalidad la intervención del Dr. Marcos, acceder al siguiente video:
El debate que tuvo lugar a continuación puede verse en la grabación que se inserta aquí:
Finalmente, el Dr. Carlos Camps se encargó de exponer las conclusiones derivadas del webinar:




