Redacción Farmacosalud.com
El Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) concluye por consenso que los datos sobre la vacuna de la compañía Janssen para prevenir el COVID-19 son sólidos y que cumplen los criterios de eficacia, seguridad y calidad exigidos. Este preparado es el cuarto recomendado en la UE para prevenir el COVID-19, tras los de las compañías Pfizer/BioNTech, Moderna y AstraZeneca.
Los resultados de un ensayo clínico en el que han participado personas en Estados Unidos, Sudáfrica y países de América Latina evidencian que la vacuna de Janssen es eficaz para prevenir el COVID-19 en sujetos a partir de los 18 años de edad. Este estudio involucró a más de 44.000 personas, la mitad de las cuales recibió una dosis única del preparado vacunal y la otra mitad placebo (una inyección ficticia). Los participantes no sabían si se les había administrado la vacuna COVID-19 Janssen o un placebo. El ensayo encontró una reducción del 67% en el número de casos sintomáticos de COVID-19 después de 2 semanas en sujetos que recibieron la vacuna en comparación con los que recibieron placebo. Esto significa que este medicamento -que requiere una sola dosis y no 2- tuvo una eficacia del 67%.
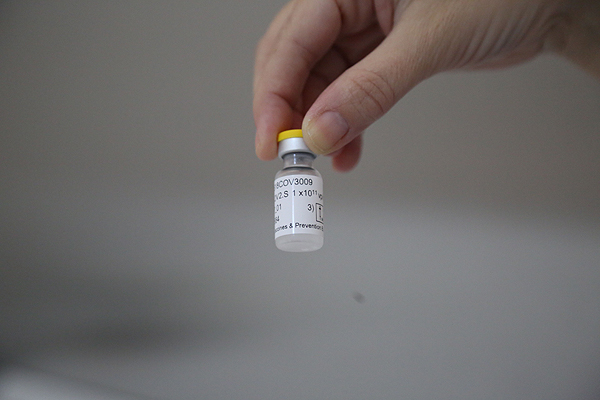
La vacuna de Janssen
Fuente: Hospital Universitario Vall d’Hebron (ARCHIVO)
VIR-7831 reduce el riesgo de muerte en fases tempranas
Por otro lado, Vir Biotechnology y GSK han anunciado que un Comité Independiente de Monitorización de Datos (IDMC por sus siglas en inglés) ha recomendado que la fase III del estudio COMET-ICE (COVID-19 Monoclonal antibody Efficacy Trial - Intent to Care Early), que evalúa VIR-7831 (GSK4182136) como monoterapia para el tratamiento en fases tempranas de la COVID-19 en adultos con alto riesgo de hospitalización, detenga la incorporación de más pacientes debido a la evidencia de una gran eficacia.
La recomendación del IDMC se basa en un análisis intermedio de datos de 583 pacientes que han participado en el ensayo COMET-ICE, que ha demostrado una reducción del 85% (p=0,002) en la hospitalización o muerte en pacientes que recibieron VIR-7831 como monoterapia en comparación con placebo. VIR-7831 ha sido bien tolerado. Dado que el estudio es ciego y sigue en curso, se seguirá realizando un seguimiento de los pacientes durante 24 semanas y se obtendrán resultados adicionales, incluidos datos epidemiológicos y virológicos, una vez que se complete el ensayo.
Con base en estos resultados, Vir y GSK planean solicitar una Autorización de Uso de Emergencia (EUA por sus siglas en inglés) a la FDA de Estados Unidos, así como solicitar autorizaciones en otros países. Los datos de esta investigación también sentarán la base para la presentación de una solicitud de licencia para productos biológicos (BLA, por sus siglas en inglés) a la FDA.

Actividad en la Unidad de Vigilancia Intensiva Respiratoria (UVIR) del Hospital Clínic de Barcelona
Autoría de la imagen y fuente: Franciso Àvia / Hospital Clínic
Las compañías, asimismo, han anunciado los resultados de un nuevo estudio presentado y pendiente de su publicación online en bioRxiv, que demuestra que VIR-7831 mantiene actividad frente a las variantes circulantes de especial interés para la salud pública (VOC, por sus siglas en inglés), incluidas las del Reino Unido, Sudáfrica y Brasil, según datos in vitro de ensayos con virus pseudotipados. A diferencia de otros anticuerpos monoclonales, VIR-7831 se une a un epítopo altamente conservado de la proteína spyke, lo cual puede dificultar que se desarrolle la resistencia.




