Dra. Mª Estrella Petrina Jáuregui

Dra. Mª Estrella Petrina Jáuregui
Fuente: Dra. Petrina Jáuregui / Complejo Hospitalario de Navarra
Riesgo de malnutrición en la Enfermedad Inflamatoria Intestinal
Siendo como es el intestino el órgano encargado de la digestión y absorción de nutrientes, resulta evidente que la patología órgano específica conlleve en sí misma un grado de malnutrición aguda o crónica en función del propio proceso patológico y de las secuelas y tratamiento de éste.
En este sentido, el 75% de los pacientes ingresados con Enfermedad Inflamatoria Intestinal (EII) sufren malnutrición y un 33% presentan un índice de masa corporal (IMC) <20. Entre los pacientes que acuden a consultas externas, la prevalencia de malnutrición es de alrededor del 16%1.
La prevalencia de malnutrición es más frecuente en la Enfermedad de Crohn (EC) debido a la propia naturaleza y curso de esta (afectación transmural, en cualquier tramo del tubo digestivo y de curso crónico e insidioso), si bien, en el caso de la Colitis Ulcerosa (CU), se desarrolla de forma más aguda e intensa (afectación limitada a colon).
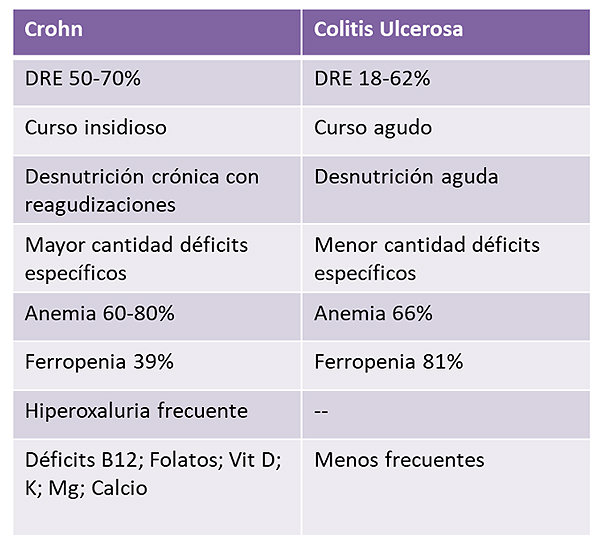
Tabla 1. Diferencias en el curso y afectación nutricional entre la E. de Crohn y la Colitis Ulcerosa
Elaboración propia de la Dra. Mª Estrella Petrina Jáuregui
Las causas que originan la malnutrición en estos enfermos son múltiples y confluyen en el paciente afecto de EII. Entre ellas podemos destacar2:
• Reducción de la ingesta: por anorexia; dolor abdominal y reactivación de la clínica digestiva con la ingesta; disgeusia inducida por fármacos (mesalacina); restricciones dietéticas inadecuadas voluntarias, …
El 86% de los pacientes restringen alimentos durante el brote para aliviar síntomas, el 77% de los pacientes restringen algún alimento para evitar la recurrencia y el 67% modifican sus hábitos alimentarios tras el primer brote. Los pacientes con resecciones intestinales, enfermedad activa y dietas restrictivas son los de mayor incidencia de malnutrición.
• Malabsorción y maladigestión: por interacción fármaco-nutrientes (corticoides, sulfasalacina, ciclosporina); incremento de las pérdidas intestinales (edema, sangrado, fístulas, …); en directa relación con el tramo intestinal afectado (duodeno; íleon; …)
La localización de la enfermedad en una zona intestinal específica y resecciones intestinales previas condicionan que puedan aparecer y/o agravarse déficits nutricionales específicos.
• Incremento de las demandas metabólicas: inflamación, fiebre, manifestaciones inflamatorias sistémicas e infecciones asociadas.
Fuente: Archivo
Las consecuencias de esta malnutrición suponen un incremento de la morbimortalidad por:
-Ingresos prolongados, readmisiones precoces
-Incremento del número de brotes de la enfermedad y/o retraso en su remisión
-Incremento de las complicaciones: fenómenos trombóticos, infecciones, retraso en la cicatrización de heridas, necesidad de cirugía urgente
-Desarrollo en mayor grado de sarcopenia, osteopenia, retraso del crecimiento y maduración sexual en el caso de afectación en la infancia-adolescencia
-La prevalencia de sujetos con intestino corto y nutrición parenteral domiciliaria en España por EII (EC) continúa siendo del 5% del total de pacientes registrados con nutrición parenteral domiciliaria según datos del registro NADYA 20173.
Todas ellas -las consecuencias- con importante decremento en la calidad de vida del paciente.
• La propia enfermedad ocasiona cambios en la composición corporal de estos enfermos, que necesitan ser mejor conocidos y estudiados.
Estos enfermos, comparados con grupos controles, presentaban una reducción del índice de masa corporal (IMC) de aproximadamente un 20% en los pacientes con CU y un 37% en sujetos con EC, y una reducción de la masa libre de grasa del 13 y 28%, respectivamente. A pesar de todo ello, sólo un 5% de los pacientes tienen un IMC por debajo de 18’5, considerado como bajo peso, y un 5% presentan obesidad (IMC>30)4.
Prevención de la malnutrición: cribado, valoración y diagnóstico
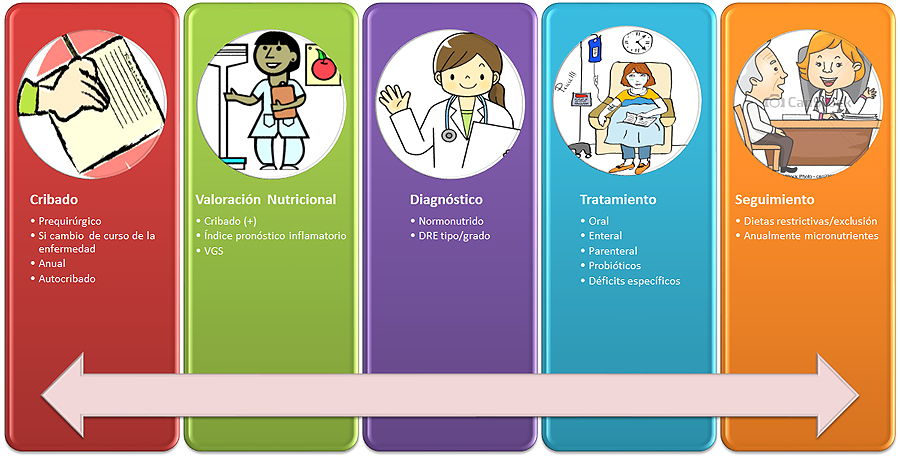
Infografía 1. Proceso de atención nutricional en la EII
Elaboración propia de la Dra. Mª Estrella Petrina Jáuregui
Cribado nutricional
Disponemos de múltiples test de cribado nutricional, no específicos para EII, pero útiles en la práctica clínica diaria para realizar el despistaje de enfermos malnutridos y/o con riesgo de malnutrición.
En general, engloban parámetros antropométricos (peso y talla) así como preguntas acerca de la pérdida de peso reciente, modificaciones en la ingesta y gravedad de la enfermedad.
Uno de los test más empleados y extendidos en la práctica clínica habitual es el MUST (Malnutrition Universal Screening Tool)5. Diseñado por el Malnutrition Advisory Group de la Sociedad Británica de Nutrición Enteral y Parenteral (BAPEN), puede ser aplicado a todos los pacientes adultos en cualquier nivel asistencial. El ‘MUST’ es un instrumento de cribado sencillo, de cinco pasos, diseñado para identificar a adultos malnutridos, con riesgo de malnutrición (desnutrición) u obesos. Incluye además unas directrices de tratamiento que pueden emplearse para desarrollar un plan de cuidados (MUST >1 indica riesgo nutricional intermedio y necesidad de observación, y ≥2 indica riesgo nutricional alto y necesidad de tratamiento nutricional).
Debemos realizarlo una vez al año, en la revisión rutinaria establecida y siempre que exista un cambio clínico, reactivación de la enfermedad y/o se remita al paciente a cirugía.
Un test de cribado positivo exige la realización de una valoración nutricional más completa.
Además, y de forma complementaria, deberemos realizar un cribado de sarcopenia que nos va a orientar acerca de la capacidad funcional del paciente, y complementar el cribado nutricional realizado. Hay también herramientas que nos ayudan en su cribado como la SARC-F6. Resulta ser un test sencillo de cinco preguntas en relación con la funcionalidad muscular (SARC-F ≥4 es predictivo de sarcopenia).
Disponemos de herramientas online y apps que nos aportan ambos test de forma conjunta y nos permiten un cribado rápido: R-MAPP7; Nutrición interactiva SEEN; Calculadora nutricional Educa Inflamatoria.
La valoración nutricional exige una historia cínica (médica, quirúrgica, farmacológica) y dietética detallada junto con datos antropométricos, funcionales, bioquímicos y registros de ingesta. Tenemos test como la Valoración Global Subjetiva (VSG) y el MNA (Mini nutritional assessment) que pueden ser útiles y asistirnos en el diagnóstico8.
Fuente: www.piqsels.com / Creative Commons
Fuente: www.piqsels.com (free photo)
Existen, además, índices-pronóstico de riesgo nutricional como el MIRT (Malnutrition Index Risk Tool9), en el cual en función de los valores de IMC, pérdida ponderal y PCR, estima el riesgo relativo de morbilidad asociada.
Diagnóstico nutricional
La correcta valoración nutricional nos posibilitará un diagnóstico cualitativo y cuantitativo de la malnutrición.
La desnutrición relacionada con la enfermedad puede aparecer asociada o no a inflamación sistémica, y ésta a su vez ser aguda o crónica.
En septiembre de 2018 se publicaron los criterios GLIM de diagnóstico de la desnutrición10. Suponen un sistema consensuado por todas las comunidades científicas para el diagnóstico de la desnutrición en adultos en contextos clínicos de enfermedad. Los cinco criterios incluyen tres criterios fenotípicos (pérdida de peso no voluntaria, índice de masa corporal bajo y masa muscular reducida) y dos criterios etiológicos (ingesta o asimilación reducida de alimentos e inflamación o carga de enfermedad). Para diagnosticar la desnutrición debe estar presente al menos un criterio fenotípico y un criterio etiológico. Se proponen métricas fenotípicas para clasificar la gravedad como desnutrición en etapa 1 (moderada) y etapa 2 (grave).
Además, en el paciente con EII, podemos encontrar: sarcopenia; osteopenia, obesidad y déficits de micronutrientes específicos, según resecciones previas y tramos de intestino afecto.
Intervención: tratamiento médico nutricional11
La intervención propuesta dependerá del estado nutricional del paciente y los objetivos terapéuticos que nos planteamos, la capacidad de ingesta y la capacidad absortiva del tracto digestivo de cada paciente.
Dieta Oral
La vía oral es la de elección siempre, pero no disponemos de un modelo de dieta a establecer como eficaz en el control y prevención de los brotes de enfermedad.

Autor/a: George Hodan
Fuente: www.publicdomainpictures.net
Los requerimientos nutricionales en estos enfermos se ven incrementados en función de la intensidad de la actividad inflamatoria. El aporte proteico debe incrementarse hasta 1,2 a 1,5 gr/kg peso /d en los brotes de actividad de la enfermedad y/o si precisa tratamiento quirúrgico.
La restricción más justificada en la dieta oral de los pacientes con EII es la de limitar el contenido en fibra insoluble en aquellos pacientes que presentan zonas intestinales con estenosis, y en los que limitando y/o excluyendo la fibra insoluble de su ingesta, se evitan obstrucciones intestinales.
Las dietas de exclusión (veganas; con hidratos de carbono específicos (SCD); IgG;…) no se han mostrado eficaces en el control del brote inflamatorio.
La exclusión de lactosa, en el brote agudo fundamentalmente, puede aliviar los síntomas en algunos pacientes. La prevalencia de intolerancia a la lactosa no es mayor que en la población general. En aquellos enfermos que excluyen la lactosa de forma total, se debe plantear la suplementación oral con calcio y vitamina D.
En aquellos pacientes que cursan con sintomatología de hinchazón abdominal y/o molestias similares al síndrome de intestino irritable se puede plantear una dieta Fodmaps12 de prueba hasta constatar alivio o no de la sintomatología con algún hidrato de carbono específico. En ningún caso significa que tenga un papel preventivo y/o curativo de la enfermedad, sino que ayuda en el alivio sintomático.
No obstante, cualquier restricción de la dieta oral de un paciente debe monitorizarse en el sentido de evitar la malnutrición y/o déficit nutricional que pudiera causar.
Podemos encontrar beneficio en el incremento del aporte de fibra soluble en enfermos con colitis ulcerosa pero no existe un tipo ni cantidad recomendada establecida.
El contenido en grasas saturadas de la dieta, palmítico; ácidos grasos libres, fosfatidil colina, carnitina, …, pueden jugar un papel inflamatorio directo e indirecto a través de modificaciones en la flora intestinal en estos pacientes. Los ácidos grasos omega-3 tienen un papel antiinflamatorio preventivo en este sentido.

Autor/a: Juanedc
Fuente: Flickr / Creative Commons
Por otra parte, pueden presentar malabsorción de grasa aquellas personas con afectación extensa ileal y/o malabsorción de sales biliares. En estos casos, además se puede acompañar de hiperoxaluria y necesitar dietas pobres en oxalatos para evitar la nefrolitiasis.
El tratamiento con los probióticos VSL3 y E. Coli Nissle está validado para inducir remisión en el brote agudo leve-moderado de colitis ulcerosa y pouchitis13.
No está justificada la suplementación oral de vitaminas y oligoelementos salvo déficits específicos asociados a interacciones farmacológicas, exclusión con dietas o déficit por incremento de gasto. Así, podemos encontrar déficit de ácido fólico en pacientes en tratamiento con metrotexate o sulfasalacina; de vitamina D en tratamientos corticoideos prolongados; de zinc en pacientes con fístula de alto débito; de magnesio y vitaminas A, D, E y K en caso de malabsorción de grasa; hierro fundamentalmente en niños, mujeres y adolescentes; y, vitamina B12 en aquellos pacientes con íleon afecto.
En los periodos de remisión y entre los brotes, se debe mantener una dieta oral variada y equilibrada, así como una vida activa con ejercicio físico que ayude a mantener una buena masa ósea y muscular y/o a recuperar la pérdida en los brotes, y como medida preventiva frente al desarrollo de obesidad.
Nutrición Enteral
Los suplementos de nutrición enteral artificial se emplean cuando con la dieta oral no se cubren más del 75% de los requerimientos del paciente. Es difícil cumplir con aportes calóricos de más de 600 Kcal /d de suplementación oral diaria mantenidos en el tiempo.
La nutrición enteral por sonda nasogástrica/ostomía (gastro/yeyunostomía) es de elección en pacientes jóvenes (edad pediátrica y adolescentes) para tratamiento del brote agudo frente al empleo de corticoides (eficacia del 68-80% en la remisión de la enfermedad en niños y adolescentes).
En cuanto a la composición de las fórmulas de nutrición enteral empleadas, no se ha demostrado superioridad de las dietas peptídicas frente a las poliméricas. Hay una tendencia a emplear fórmulas con menor contenido lipídico. Las fórmulas específicas desarrolladas no han mostrado superioridad en el tratamiento de estos pacientes.

(imagen modificada) Autor/a del original: Alvimann
Fuente: morguefile.com (free photo)
Con respecto a la pauta de administración, va a depender fundamentalmente del estado nutricional previo del paciente, siendo mejor toleradas en administración continua, con bomba de infusión en 16-24 h, cuanta mayor sea la afectación clínica y peor el estado nutricional del paciente. De forma progresiva puede plantearse su administración en bolus diurnos. También se puede plantear una administración cíclica y mixta. La elección de una u otra forma va a depender de la tolerancia fundamentalmente, además de la preferencia del paciente.
Nutrición Parenteral
La nutrición parenteral se reserva para los casos en que no podamos emplear el intestino (íleo; fístula de alto débito, suboclusión intestinal; diarrea incoercible, …) y/o sea tal la intensidad del brote que no logremos la administración de los requerimientos completos por la vía oral/enteral. Los nutrientes específicos tampoco han mostrado utilidad en la remisión de los brotes por esta vía.
En los últimos años, y gracias a los nuevos tratamientos surgidos para la EII, la prevalencia de síndrome de intestino corto (SIC) por EII ha ido descendiendo. No obstante, no debemos olvidar que la EII es una de las causas de éste y que hay pacientes que van a depender de la administración parenteral de nutrientes para subsistir. El entrenamiento en la técnica de administración y cuidados van a ser las piezas claves del tratamiento. Disponemos de material de apoyo educativo para pacientes y profesionales en páginas web: www.fallointestinal.com; Nadya.
Una de las complicaciones de mayor riesgo vital a prevenir en los enfermos que presenten una desnutrición grave es la aparición de un síndrome de realimentación14. Éste puede ocasionarse con la administración de nutrientes vía oral, enteral y parenteral, y será más grave e intenso cuanto más rápida se produzca la realimentación de estos pacientes y mayor sea la desnutrición de la que parte el enfermo. La monitorización de las funciones vitales y los niveles de glucemia, magnesio, potasio y fosfato junto con la administración preventiva de tiamina son vitales para evitar complicaciones fatales.
Seguimiento y herramientas de apoyo

Autor/a: Jaroslav Tokarcik
Fuente: www.pexels.com (free photo)
Anualmente debemos constatar el estado nutricional de los pacientes afectos de EII (incluida monitorización de vitaminas liposolubles y micronutrientes) y vigilar unos hábitos nutricionales correctos y variados que no excluyan grupos alimentarios completos y favorezcan una dieta rica en antioxidantes, pobre en grasas saturadas, e hidratos de carbono de absorción rápida.
Disponemos de herramientas en la red y asociaciones de pacientes que van a ayudar a estos pacientes en el conocimiento y manejo del día a día de su enfermedad: Educa Inflamatoria; Asociación de Crohn y Colitis Ulcerosa España.
Conclusiones
• Es frecuente la prevalencia de malnutrición y déficits de micronutrientes asociados en la EII, aún entre brotes.
• La recuperación del estado nutricional es importante para el devenir de la enfermedad y complicaciones asociadas.
• Se debe valorar periódicamente el estado nutricional en estos enfermos y tratar precozmente en caso de desnutrición. Prestar especial atención a los déficits asociados en función del tramo intestinal afecto.
• Las dietas de exclusión no se han mostrado efectivas para el tratamiento de estos pacientes. Se precisan más estudios de rigor en este sentido.
• La nutrición enteral ha demostrado ser el tratamiento de elección en los brotes de EC en la edad pediátrica y adolescencia.
• La mejor prevención es el mantenimiento de una dieta equilibrada y hábitos de estilo de vida activos que aseguren un correcto estado nutricional y funcional.
• Disponemos de herramientas en red para pacientes y profesionales que nos van a ayudar en el manejo nutricional de la enfermedad.
Bibliografía
1. María José Casanova, et al. Prevalence of Malnutrition and Nutritional Characteristics of Patients With Inflammatory Bowel Disease, Journal of Crohn's and Colitis, Volume 11, Issue 12, December 2017, Pages 1430–1439, https://doi.org/10.1093/ecco-jcc/jjx102
2. F. Scaldaferri, et al. Nutrition and IBD: Malnutrition and/or Sarcopenia? A Practical Guide. Gastroenterology Research and Practice Volume 2017, Article ID 8646495, 11 pageshttps://doi.org/10.1155/2017/8646495
3. Nutrición parenteral domiciliaria en España 2018. Informe del Grupo de Nutrición Artificial Domiciliaria y Ambulatoria NADYA Nutr Hosp 2020;37(2):403-40.
4. Csontos Ágnes Anna, Molnár Andrea, Piri Zsolt, Pálfi Erzsébet, Miheller Pál. Malnutrition risk questionnaire combined with body composition measurement in malnutrition screening in inflammatory bowel disease. Rev. esp. enferm. dig. [Internet]. 2017 Ene [citado 2020 Dic 15] ; 109( 1 ): 26-32. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1130-01082017000100005&lng=es. http://dx.doi.org/10.17235/reed.2016.4557/2016.
5. Weekes CE, Elia M, Emery PW. The development, validation and reliability of a nutrition screening tool based on the recommendations of the British, Association for Parenteral and Enteral Nutrition (BAPEN). Clin Nutr 2004;23:1104–1112.
6. Malmstrom TK, Morley JE. SARC-F: a simple questionnaire to rapidly diagnose sarcopenia. J Am Med Dir Assoc. 2013 Aug;14(8):531-2. doi: 10.1016/j.jamda.2013.05.018. Epub 2013 Jun 25. PMID: 23810110.
7. -Krznarić Z, Vranešić D, Laviano A, Cuerda C, Landi F, Monteiro, R, Pirlich M y Barazzoni R. A simple remote nutritional screening tool and practical guidance for nutritional care in primary practice during the COVID-19 pandemic. Clinical Nutrition 2020; https://doi.org/10.1016/j.clnu.2020.05.006.
8. Test de Cribado y Valoración Nutricional: https://www.alianzamasnutridos.es/metodos-de-cribado/
9. Jansen, Irene & Prager, Matthias & Valentini, Luzia & Büning, Carsten. (2016). Inflammation-driven malnutrition: a new screening tool predicts outcome in Crohn’s disease. British Journal of Nutrition. -1. 1-7. 10.1017/S0007114516003044.
10. Cederholm T, Jensen GL, Correia MITD, Gonzalez MD, Fukushima R, Higashiguchi T, Baptista G. GLIM criteria for the diagnosis of malnutrition – A consensus report from the global clinical nutrition community. Clin Nutr 2019;38(1):1-9.
11. Bischoff SC, Escher J, Hébuterne X, Kłęk S, Krznaric Z, Schneider S, Shamir R, Stardelova K, Wierdsma N, Wiskin AE, Forbes A. ESPEN practical guideline: Clinical Nutrition in inflammatory bowel disease. Clin Nutr. 2020 Mar;39(3):632-653. doi: 10.1016/j.clnu.2019.11.002. Epub 2020 Jan 13. PMID: 32029281.
12. Ana Zugasti Murillo, Fermín Estremera Arévalo, Estrella Petrina Jáuregui. Dieta pobre en FODMAPs (fermentable oligosaccharides, disaccharides, monosaccharides and polyols) en el síndrome de intestino irritable: indicación y forma de elaboración. Endocrinología y Nutricion, Vol. 63. Núm. 3.Páginas 132-138, marzo 2016. DOI: 10.1016/j.endonu.2015.10.009.
13. Francisco Guarner. Prebióticos y Probióticos. Guías Mundiales de la Organización Mundial de Gastroenterología. Febrero 2017. https://www.worldgastroenterology.org/guidelines/global-guidelines/probiotics-and-prebiotics/probiotics-and-prebiotics-spanish.
14. Khan LU, Ahmed J, Khan S, Macfie J. Refeeding syndrome: a literature review. Gastroenterol Res Pract. 2011;2011:410971. doi:10.1155/2011/410971




