Redacción Farmacosalud.com
En el presente informe se reseñan los medicamentos ya evaluados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), considerados de mayor interés para el profesional sanitario. Se trata de opiniones técnicas positivas de la AEMPS correspondientes al mes de septiembre de 2020 que son previas a la autorización y puesta en el mercado del medicamento, lo que sucederá dentro de algunos meses, informa este organismo mediante un comunicado. Una vez los nuevos fármacos se hayan autorizado, toda la información de cada uno de ellos (desde la ficha técnica y prospecto, hasta sus condiciones de prescripción, uso y disponibilidad real en el mercado) se podrá consultar en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.
Exparel (BUPIVACAÍNA)
Indicación aprobada: Indicado para el bloqueo del plexo braquial o del nervio femoral para el tratamiento del dolor postoperatorio en adultos, y el bloqueo de campo para el tratamiento del dolor posoperatorio somático de las heridas quirúrgicas de tamaño pequeño o mediano en adultos. Exparel estará disponible como dispersión para inyección (133 mg/10 ml y 266 mg/20 ml).
MenQuadfi (VACUNA CONJUGADA DE LOS GRUPOS MENINGOCÓCICOS A, C, W e Y)
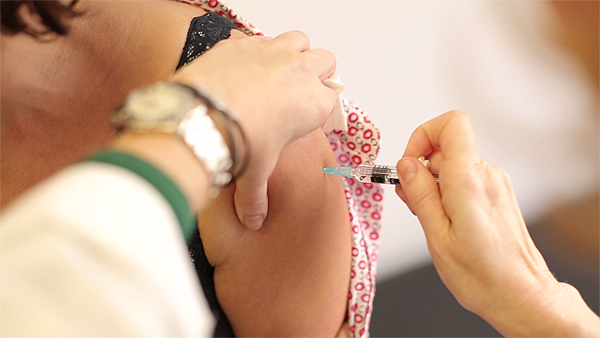
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Indicación aprobada: MenQuadfi está indicado para la inmunización activa de individuos a partir de los 12 meses de edad en adelante, para la enfermedad meningocócica invasiva causada por los serogrupos A, C, W e Y de Neisseria meningitidis. MenQuadfi estará disponible como solución inyectable.
Obiltoxaximab SFL (OBILTOXAXIMAB)
Indicación aprobada: Indicado en todos los grupos de edad en combinación con los medicamentos antibacterianos apropiados para el tratamiento del carbunco por inhalación debido al Bacillus anthracis. Indicado en todos los grupos de edad para la profilaxis posterior a la exposición del carbunco por inhalación cuando las terapias alternativas no son apropiadas o no están disponibles. Obiltoxaximab SFL estará disponible como concentrado para solución para perfusión (100 mg/ml). Obiltoxaximab SFL fue designado medicamento huérfano el 24 de agosto de 2018
Phelinun (MELFALÁN)
Indicación aprobada: Phelinun utilizada a dosis elevadas, solo o en combinación con otros medicamentos citotóxicos y/o la irradiación corporal total, está indicada en el tratamiento de: mieloma múltiple, linfoma maligno (Hodgkin, linfoma no Hodgkin), leucemia linfoblástica y mieloblástica aguda, neuroblastoma infantil, cáncer de ovario, y adenocarcinoma de mama. Phelinun estará disponible en polvo y disolvente para concentrado para solución para perfusión (50 mg y 200 mg). Phelinun, en combinación con otros medicamentos citotóxicos, está indicado como tratamiento de acondicionamiento de intensidad reducida antes del trasplante de células madre hematopoyéticas alogénicas (allo-HSCT) en enfermedades hematológicas malignas en adultos. Phelinun, en combinación con otros medicamentos citotóxicos, está indicado como régimen de acondicionamiento previo al trasplante de células madre hematopoyéticas alogénicas en enfermedades hematológicas de la población pediátrica como: el tratamiento de acondicionamiento mieloablativo en caso de enfermedades hematológicas malignas, y el tratamiento de acondicionamiento de intensidad reducida en caso de enfermedades hematológicas no malignas.
Supemtek (VACUNA CONTRA LA GRIPE CUADRIVALENTE RECOMBINANTE, PREPARADA EN CULTIVO CELULAR)
Indicación aprobada: Indicado en adultos para la inmunización activa para la prevención de la enfermedad del virus de la gripe. Supemtek estará disponible como solución para inyección en jeringas precargadas.
Autor/a: Bicanski
Fuente: Pixnio / Public Domain
Biosimilares
Nyvepria (PEGFILGRASTIM)
Indicación aprobada: Reducción de la duración de la neutropenia y de la incidencia de neutropenia febril en pacientes adultos con tumores malignos tratados con quimioterapia citotóxica (con excepción de leucemia mieloide crónica y síndromes mielodisplásicos).
Cambios de especial interés sanitario en medicamentos ya autorizados
Nuevas indicaciones con dictamen positivo para su autorización
Para las indicaciones ya autorizadas se recomienda consultar el texto completo de las mismas en las fichas técnicas disponibles en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS. Se indican los medicamentos que han recibido una opinión del Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos.
Deltyba (DELAMANID)
Extensión de la indicación (en negrita): Deltyba está indicado como parte de un régimen de combinación adecuado para la tuberculosis pulmonar multirresistente a medicamentos (MDR-TB) en adultos, adolescentes y niños con un peso corporal de al menos 30 kg cuando no es posible establecer un régimen de tratamiento eficaz por razones de resistencia o tolerabilidad.
Fycompa (PERAMPANEL)
Extensión de la indicación (en negrita): Fycompa está indicado para el tratamiento concomitante de: las crisis de inicio parcial con o sin generalización secundaria en pacientes de 4 años de edad y mayores. Y las crisis tonicoclónicas generalizadas primarias en pacientes de 7 años de edad y mayores con epilepsia idiopática generalizada.
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Flucelvax Tetra [VACUNA ANTIGRIPAL (ANTÍGENO DE SUPERFICIE, INACTIVADO, PREPARADA EN CULTIVOS CELULARES)]
Extensión de la indicación (en negrita): Profilaxis de la gripe en adultos y niños a partir de 2 años.
Kalydeco (IVACAFTOR comprimidos)
Extensión de la indicación (en negrita): Adición de una nueva presentación de 75 mg comprimidos recubiertos con película. Kalydeco comprimidos está indicado para el tratamiento de adultos, adolescentes y niños de 6 años o mayores con un peso de 25 kg o más con fibrosis quística (FQ) y una mutación R117H en el gen CFTR o una de las siguientes mutaciones de apertura del canal (clase III) en el gen CFTR: G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N o S549R. Kalydeco comprimidos también está indicado en un esquema combinado con comprimidos de tezacaftor / ivacaftor para el tratamiento de adultos, adolescentes y niños de 6 años de edad o mayores con fibrosis quística (FQ) homocigóticos para la mutación F508del o heterocigóticos para la mutación F508del con una de las siguientes mutaciones en el gen regulador de la conductancia transmembrana de la fibrosis quística (CFTR): P67L, R117C, L206W, R352Q, A455E, D579G, 711+3A→G, S945L, S977F, R1070W, D1152H, 2789+5G→A, 3272-26A→G y 3849+10kbC→T.
En combinación con comprimidos de ivacaftor 75 mg/tezacaftor 50 mg/elexacaftor 100 mg para el tratamiento de adultos y adolescentes mayores de 12 años con fibrosis quística (FQ) que son homocigotos para la mutación F508del en el gen CFTR o heterocigotos para F508del en el gen CFTR con una mutación de función mínima (MF).
Kalydeco (IVACAFTOR granulado)
Extensión de la indicación (en negrita): Kalydeco granulado está indicado para el tratamiento de lactantes de al menos 4 meses y niños con un peso de 5 kg a menos de 25 kg con fibrosis quística (FQ) y una mutación R117H en el gen CFTR o una de las siguientes mutaciones de apertura del canal (clase III) en el gen CFTR: G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N o S549R.
Lynparza (OLAPARIB)
Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Extensión de la indicación (en negrita): Cáncer de ovario. Lynparza está indicado como monoterapia para el: tratamiento de mantenimiento de pacientes adultas con cáncer de ovario epitelial de alto grado avanzado (estadios FIGO III y IV) con mutación BCRA1/2 (germinal o somática), de trompa de Falopio o peritoneal primario, que están en respuesta (completa o parcial) tras haber completado una primera línea de quimioterapia basada en platino. Y tratamiento de mantenimiento de pacientes adultas con cáncer de ovario epitelial de alto grado, trompa de Falopio, o peritoneal primario, en recaída, sensible a platino, que están en respuesta (completa o parcial) a quimioterapia basada en platino.
Lynparza en combinación con el bevacizumab está indicada para el: tratamiento de mantenimiento de pacientes adultos con cáncer de ovario epitelial de alto grado avanzado (estadios FIGO III y IV), cáncer de las trompas de Falopio o cáncer del peritoneo primario que responden (completa o parcialmente) a la quimioterapia de primera línea basada en platino en combinación con bevacizumab y cuyo cáncer está asociado a estado positivo de una deficiencia de recombinación homóloga definida por una mutación BRCA1/2 y/o inestabilidad genómica.
Cáncer de mama. Lynparza está indicado como monoterapia para el tratamiento de pacientes adultos con cáncer de mama localmente avanzado o metastásico HER2 negativo, que tiene mutaciones germinales en BRCA1/2. Los pacientes deben haber recibido tratamiento previo con una antraciclina y un taxano en (neo)adyuvancia o para la enfermedad metastásica, a menos que no fuesen aptos para estos tratamientos. Los pacientes con cáncer de mama con receptor hormonal (HR) positivo también deben haber progresado durante o después de la terapia endocrina previa o ser considerados no aptos para la terapia endocrina. Adenocarcinoma de páncreas. Lynparza está indicado como monoterapia para el tratamiento de mantenimiento de pacientes adultos con mutaciones germinales en BRCA1/2 que tienen adenocarcinoma de páncreas metastásico, cuya enfermedad no ha progresado tras un mínimo de 16 semanas de tratamiento con platino como parte de un régimen de primera línea de quimioterapia.
Cáncer de próstata. Lynparza está indicada como monoterapia para el tratamiento de pacientes adultos con cáncer de próstata resistente a la castración metastásica y mutaciones BRCA1/2 (germinales y/o somáticas) que han progresado después de una terapia previa que incluía un nuevo agente hormonal.
Olumiant (BARICITINIB)
Extensión de la indicación (en negrita): Artritis reumatoide. Olumiant está indicado para el tratamiento de la artritis reumatoide activa de moderada a grave en pacientes adultos con respuesta inadecuada o intolerancia a uno o más fármacos antirreumáticos modificadores de la enfermedad. Olumiant se puede utilizar en monoterapia o en combinación con metotrexato. Dermatitis atópica. Olumiant está indicado para el tratamiento de la dermatitis atópica de moderada a grave en pacientes adultos que son candidatos para la terapia sistémica.
Opdivo (NIVOLUMAB)

Fuente: PharmaMar (IMAGEN DE ARCHIVO)
Extensión de la indicación (en negrita): Melanoma. Opdivo en monoterapia o en combinación con ipilimumab está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos. Tratamiento adyuvante del melanoma. Opdivo en monoterapia está indicado para el tratamiento adyuvante en adultos con melanoma con afectación de los ganglios linfáticos o enfermedad metastásica que hayan sido sometidos a resección completa. Cáncer de pulmón no microcítico (CPNM). Opdivo, en combinación con el ipilimumab y dos ciclos de quimioterapia basada en platino, está indicado para el tratamiento de primera línea del cáncer de pulmón no microcítico en adultos cuyos tumores no presentan una mutación sensibilizante del EGFR o una translocación del ALK. Opdivo en monoterapia está indicado para el tratamiento del cáncer de pulmón no microcítico, localmente avanzado o metastásico después de quimioterapia previa, en adultos. Carcinoma de células renales (CCR). Opdivo en monoterapia está indicado para el tratamiento del carcinoma de células renales avanzado después de tratamiento previo, en adultos. Opdivo en combinación con ipilimumab está indicado para el tratamiento de primera línea de pacientes adultos con carcinoma de células renales avanzado de riesgo intermedio/alto.
Linfoma de Hodgkin clásico (LHc). Opdivo en monoterapia está indicado para el tratamiento de pacientes adultos con linfoma de Hodgkin clásico en recaída o refractario después de un trasplante autólogo de progenitores hematopoyéticos (TAPH) y de tratamiento con brentuximab vedotina. Cáncer de células escamosas de cabeza y cuello (CCECC). Opdivo en monoterapia está indicado para el tratamiento de pacientes adultos con cáncer de células escamosas de cabeza y cuello recurrente o metastásico que progresa durante o después de un tratamiento basado en platino. Carcinoma urotelial. Opdivo en monoterapia está indicado para el tratamiento de pacientes adultos con carcinoma urotelial irresecable localmente avanzado o metastásico después del fracaso a un tratamiento previo basado en platino.
Orfadin (NITISINONA)
Extensión de la indicación (en negrita): Tirosinemia hereditaria tipo I (TH-1). Orfadin está indicado para el tratamiento de pacientes adultos y pediátricos (de cualquier intervalo de edad) con diagnóstico confirmado de tirosinemia hereditaria tipo I (TH-1) en combinación con dieta restrictiva de tirosina y fenilalanina. Alcaptonuria. Orfadin está indicado para el tratamiento de pacientes adultos con alcaptonuria.
Symkevi (TEZACAFTOR/IVACAFTOR)
Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Extensión de la indicación (en negrita): Adición de una nueva dosis de 50 mg/75 mg comprimidos recubiertos con película. Symkevi está indicado en una pauta de administración combinada con comprimidos de ivacaftor para el tratamiento de pacientes con fibrosis quística (FQ) de 6 años de edad o mayores homocigóticos para la mutación F508del o heterocigóticos para la mutación F508del con una de las siguientes mutaciones en el gen regulador de la conductancia transmembrana de la fibrosis quística (CFTR): P67L, R117C, L206W, R352Q, A455E, D579G, 711+3A→G, S945L, S977F, R1070W, D1152H, 2789+5G→A, 3272-26A→G y 3849+10kbC→T.
Tecentriq (ATEZOLIZUMAB)
Extensión de la indicación (en negrita): Carcinoma urotelial. Tecentriq en monoterapia está indicado para el tratamiento de pacientes adultos con carcinoma urotelial (CU) localmente avanzado o metastásico: después de quimioterapia previa que contenga platino, o en los que no son considerados aptos para el tratamiento con cisplatino y cuyos tumores tengan una expresión de PD-L1 > 5%. Cáncer de pulmón no microcítico. Tecentriq, en combinación con bevacizumab, paclitaxel y carboplatino, está indicado para el tratamiento de primera línea de cáncer de pulmón no microcítico (CPNM) no escamoso metastásico en pacientes adultos. En pacientes con mutaciones de EGFR o ALK positivo, Tecentriq en combinación con bevacizumab, paclitaxel y carboplatino está indicado solamente tras fallo de las terapias dirigidas. Tecentriq en monoterapia está indicado para el tratamiento de pacientes adultos con CPNM localmente avanzado o metastásico después de quimioterapia previa. Los pacientes con mutaciones de EGFR o ALK positivo deben haber sido tratados también con terapias dirigidas antes de ser tratado con Tecentriq. Tecentriq, en combinación con nab-paclitaxel y carboplatino, está indicado para el tratamiento de primera línea de CPNM no escamoso metastásico en pacientes adultos que no presentan mutaciones de EGFR o ALK positivo.
Cáncer de mama. Tecentriq en combinación con nab-paclitaxel está indicado para el tratamiento de pacientes adultos con cáncer de mama triple negativo (CMTN) localmente avanzado irresecable o metastásico cuyos tumores tengan una expresión de PD-L1 ≥ 1% y que no hayan recibido quimioterapia previa frente a la metástasis. Cáncer de pulmón microcítico. Tecentriq, en combinación con carboplatino y etopósido, está indicado para el tratamiento de primera línea de cáncer de pulmón microcítico en estadio extendido (CPM-EE) en pacientes adultos. Carcinoma hepatocelular. Tecentriq, en combinación con bevacizumab, está indicado para el tratamiento de pacientes adultos con carcinoma hepatocelular avanzado o no resecable que no hayan recibido una terapia sistémica previa.
Velphoro (OXIHIDRÓXIDO SUCROFÉRRICO)
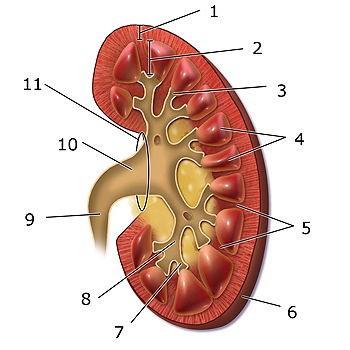
Esquema del riñón: 1. Corteza renal, 2. Médula renal, 3. Papila renal, 4, Pirámide renal, 5. Columna renal, 6. Cápsula fibrosa, 7. cáliz menor, 8. cáliz mayor, 9. Uréter, 10. Pelvis renal, 11. Hilio renal.
Autor/a de la imagen: Modificado de BruceBlaus - Wikimedia Commons file:Blausen 0593 KidneyAnatomy 02.png
Fuente: Wikipedia
Extensión de la indicación (en negrita): Adición de una nueva dosis de 125 mg polvo para suspensión oral. Velphoro está indicado para el control de los niveles de fósforo sérico en pacientes adultos con enfermedad renal crónica (ERC) en hemodiálisis (HD) o diálisis peritoneal (DP). Velphoro está indicado para el control de los niveles de fósforo sérico en pacientes pediátricos de 2 años de edad y mayores con enfermedad renal crónica en etapas 4-5 (definidas por una tasa de filtración glomerular <30 ml/min/1,73 m²) o con enfermedad renal crónica en diálisis.
Yervoy (IPILIMUMAB)
Extensión de la indicación (en negrita): Melanoma. Yervoy en monoterapia está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos y adolescentes de 12 años y mayores. Yervoy en combinación con nivolumab está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos. Carcinoma de Células Renales (CCR). Yervoy en combinación con nivolumab está indicado para el tratamiento de primera línea de pacientes adultos con carcinoma de células renales avanzado de riesgo intermedio/alto. Cáncer de pulmón no microcítico (CPNM). Yervoy en combinación con el nivolumab y dos ciclos de quimioterapia basada en platino, está indicado para el tratamiento de primera línea del cáncer de pulmón no microcítico metastásico en adultos cuyos tumores no presentan una mutación sensibilizante del EGFR o una translocación del ALK.
Zejula (NIRAPARIB)
Extensión de la indicación (en negrita): Zejula está indicado: como tratamiento de mantenimiento en monoterapia de pacientes adultas con cáncer de ovario epitelial de alto grado avanzado (estadios FIGO III y IV), cáncer de las trompas de Falopio o cáncer del peritoneo primario que responden (completa o parcialmente) a la quimioterapia de primera línea basada en platino. Y como tratamiento de mantenimiento en monoterapia de pacientes adultas con cáncer de ovario epitelial seroso de alto grado, trompas de Falopio o peritoneal primario, en recaída, sensible a platino, que están en respuesta (completa o parcial) a la quimioterapia basada en platino.
Zavicefta (CEFTAZIDIMA Y AVIBACTAM SÓDICO)
Extensión de la indicación (en negrita): Zavicefta está indicado en adultos y niños de 3 meses en adelante para el tratamiento de las siguientes infecciones: Infección intraabdominal complicada (IIAc); infección complicada del tracto urinario (ITUc), incluyendo pielonefritis; neumonía adquirida en el hospital (NAH), incluyendo neumonía asociada a ventilación mecánica (NAV), y el tratamiento de pacientes con bacteriemia que se produce en asociación con, o que se sospecha que está asociada con cualquiera de las infecciones mencionadas anteriormente. Zavicefta está también indicado para el tratamiento de infecciones por microorganismos aerobios Gram-negativos en adultos y niños de 3 meses en adelante con opciones terapéuticas limitadas.




