Redacción Farmacosalud.com
En el presente informe se reseñan los medicamentos ya evaluados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), considerados de mayor interés para el profesional sanitario. Se trata de opiniones técnicas positivas de la AEMPS correspondientes al mes de mayo de 2020 que son previas a la autorización y puesta en el mercado del medicamento, lo que sucederá dentro de algunos meses, informa este organismo mediante un comunicado. Una vez los nuevos fármacos se hayan autorizado, toda la información de cada uno de ellos (desde la ficha técnica y prospecto, hasta sus condiciones de prescripción, uso y disponibilidad real en el mercado) se podrá consultar en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.
Hepcludex (BULEVIRTIDA)
Indicación aprobada: Indicado para el tratamiento de la infección crónica por el virus de la hepatitis delta (VHD) en plasma (o suero) en pacientes adultos VHD-ARN positivos con enfermedad hepática compensada. Hepcludex estará disponible como polvo para solución inyectable (2 mg). Hepcludex fue designado medicamento huérfano durante su desarrollo. La EMA revisará ahora la información disponible hasta la fecha para determinar si se puede mantener la designación de huérfano.
Autor/a: Andres Rueda
Fuente: Wikimedia (originalmente en Flickr)
Mvabea (MVA-BN-FILO MULTIVALENTE, RECOMBINANTE, NO- REPLICATIVO) VACUNA FRENTE AL ÉBOLA
Indicación aprobada: Mvabea, como parte del régimen de la vacuna de Zabdeno, está indicado para la inmunización activa para la prevención de la enfermedad causada por el virus del Ébola (especies de ebolavirus Zaire) en individuos ≥ 1 año de edad. El uso de Mvabea debe realizarse de acuerdo con las recomendaciones oficiales. Mvabea estará disponible como suspensión inyectable.
Piqray (ALPELISIB)
Indicación aprobada: Piqray está indicado en combinación con fulvestrant para el tratamiento de mujeres pos-menopáusicas y hombres con receptor hormonal positivo (RH), con receptor 2 del factor de crecimiento epidérmico humano (HER2) negativo y cáncer de mama localmente avanzado o metastásico con mutación PIK3CA tras la progresión de la enfermedad después de recibir tratamiento endocrino como monoterapia. Piqray estará disponible como comprimidos recubiertos con película (50 mg, 150 mg y 200 mg).
Rozlytrek (ENTRECTINIB)
Indicación aprobada: Rozlytrek como monoterapia está indicado para el tratamiento de pacientes adultos y pediátricos de 12 años de edad y mayores, con tumores sólidos que expresan un gen de fusión del receptor de tirosina quinasa neutrófico (NTRK), 1-que tienen una enfermedad localmente avanzada, metastásica o donde es probable que la resección quirúrgica resulte en grave morbilidad, 2-que no han recibido previamente un inhibidor NTRK, y 3-que no tienen opciones de tratamiento adecuados. Rozlytrek como monoterapia está indicado para el tratamiento de pacientes adultos con cáncer de pulmón no microcítico avanzado (CPNM) ROS1 positivo, que no han sido tratados previamente con inhibidores de ROS1. Rozlytrek estará disponible como cápsulas duras (100 mg y 200 mg).
Xenleta (LEFAMULINA)
Indicación aprobada: Indicado en adultos para el tratamiento de la neumonía adquirida en la comunidad (NAC) cuando se considera inapropiado el uso de antibióticos que son comúnmente recomendados para el tratamiento inicial de la NAC o cuando este ha fallado. Xenleta estará disponible como concentrado y solvente para solución para perfusión (150 mg) y comprimidos recubiertos con película (600 mg).
Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Zabdeno VACUNA FRENTE AL ÉBOLA (VACUNA MONOVALENTE RECOMBINANTE INCAPAZ DE REPLICAR CON VECTOR AD26 QUE CODIFICA LA LONGITUD COMPLETA DE GLICOPROTEÍNA (GP) DE EBOLAVIRUS ZAIRE)
Indicación aprobada: Zabdeno, como parte del régimen de la vacuna Mvabea, está indicado para la inmunización activa para la prevención de la enfermedad causada por el virus del Ébola (especies de ebolavirus Zaire) en individuos ≥ 1 año de edad. El uso de Zabdeno debe realizarse de acuerdo con las recomendaciones oficiales. Zabdeno estará disponible como suspensión inyectable.
Biosimilares
Zercepac (TRASTUZUMAB)
Indicación aprobada: Zercepac está indicado para el tratamiento de: cáncer de mama metastásico. Zercepac está indicado para el tratamiento de pacientes adultos con cáncer de mama metastásico (CMM) HER2 positivo: en monoterapia para el tratamiento de aquellos pacientes que hayan recibido al menos dos regímenes quimioterápicos para su enfermedad metastásica. La quimioterapia previa debe haber incluido al menos una antraciclina y un taxano a menos que estos tratamientos no estén indicados en los pacientes. Los pacientes con receptores hormonales positivos también deben haber fracasado al tratamiento hormonal a menos que éste no esté indicado; en combinación con paclitaxel para el tratamiento de aquellos pacientes que no hayan recibido quimioterapia para su enfermedad metastásica y en los cuales no esté indicado un tratamiento con antraciclinas; en combinación con docetaxel para el tratamiento de aquellos pacientes que no hayan recibido quimioterapia para su enfermedad metastásica; en combinación con un inhibidor de la aromatasa para el tratamiento de pacientes posmenopáusicas con CMM y receptor hormonal positivo, que no hayan sido previamente tratadas con trastuzumab.
Cáncer de mama precoz. Zercepac está indicado para el tratamiento de cáncer de mama precoz (CMP) en pacientes adultos con HER2 positivo: después de cirugía, quimioterapia (adyuvante o neoadyuvante) y radioterapia (si procede); después de quimioterapia adyuvante con doxorubicina y ciclofosfamida, en combinación con paclitaxel o docetaxel; en combinación con quimioterapia adyuvante consistente en docetaxel y carboplatino; en combinación con quimioterapia neoadyuvante seguido de tratamiento en adyuvancia con Zercepac para enfermedad localmente avanzada (incluyendo enfermedad inflamatoria) o tumores > 2 cm de diámetro. Zercepac debe emplearse únicamente en pacientes con cáncer de mama metastásico o cáncer de mama precoz, cuyos tumores sobreexpresen HER2 o tengan amplificación del gen HER2 determinados mediante un método exacto y validado.
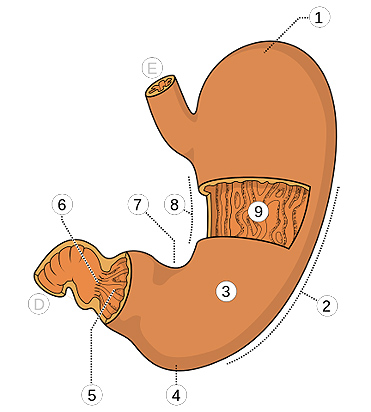
Estructuras del estómago:
1. Fundus 2. Curvatura mayor 3. Cuerpo 4. Antro pílorico 5. Región pilórica 6. Canal pilórico 7. Incisura angular 8. Curvatura menor 9. Pliegues gástricos E. Esófago D. Duodeno
Autor/a de la imagen: Olek Remesz (wiki-pl: Orem, commons: Orem) - Own work, based on Image:Illu stomach.jpg
Fuente: Wikipedia
Cáncer gástrico metastásico. Zercepac en combinación con capecitabina o 5-fluoracilo y cisplatino, está indicado para el tratamiento de pacientes adultos con adenocarcinoma gástrico o unión gastroesofágica metastásico, HER2-positivo, que no hayan recibido un tratamiento previo para metástasis. Zercepac debe emplearse únicamente en pacientes con cáncer gástrico metastásico (CGM), cuyos tumores sobreexpresen HER2, definida por IHQ2+ y confirmada por un resultado SISH o FISH o por un resultado IHQ3+. Se deben emplear métodos de valoración exactos y validados. Zercepac estará disponible como polvo para concentrado para solución para perfusión (150 mg). Zercepac es un medicamento biosimilar, altamente similar al medicamento de referencia Herceptin (trastuzumab), que fue autorizado en la Unión Europea el 28 de agosto de 2000.
Cambios de especial interés sanitario en medicamentos ya autorizados
Nuevas indicaciones con dictamen positivo para su autorización
Para las indicaciones ya autorizadas se recomienda consultar el texto completo de las mismas en las fichas técnicas disponibles en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos de la AEMPS.
Invokana (CANAGLIFLOZINA)
Extensión de la indicación (en negrita): Invokana está indicado para el tratamiento de adultos con diabetes mellitus tipo 2 no suficientemente controlada, asociado a dieta y ejercicio: en monoterapia cuando la metformina no se considera adecuada debido a intolerancia o contraindicaciones, o añadido a otros medicamentos para el tratamiento de la diabetes. Para consultar los resultados de los ensayos respecto a las combinaciones, los efectos en control glucémico, los acontecimientos cardiovasculares y acontecimientos renales, así como las poblaciones estudiadas, ver las secciones 4.4, 4.5 y 5.1.
Lynparza (OLAPARIB)
Extensión de la indicación (en negrita): cáncer de ovario. Lynparza está indicado como monoterapia para el: tratamiento de mantenimiento de pacientes adultas con cáncer de ovario epitelial de alto grado avanzado (estadios FIGO III y IV) con mutación BRCA1/2 (germinal o somática), de trompa de Falopio o peritoneal primario, que están en respuesta (completa o parcial) tras haber completado una primera línea de quimioterapia basada en platino; tratamiento de mantenimiento de pacientes adultas con cáncer de ovario epitelial de alto grado, trompa de Falopio, o peritoneal primario, en recaída, sensible a platino, que están en respuesta (completa o parcial) a quimioterapia basada en platino.
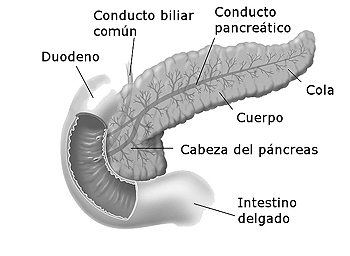
Anatomía del páncreas con su distribución en cabeza, cuerpo y cola
Autor/a de la imagen: Modificado de Don Blis (artist) - Wikimedia Commons Duodenumandpancreas.jpg. User: Posible2006
Fuente: Wikipedia
Cáncer de mama. Lynparza está indicado como monoterapia para el tratamiento de pacientes adultos con cáncer de mama localmente avanzado o metastásico HER2 negativo, que tienen mutaciones germinales en BRCA1/2. Los pacientes deben haber recibido tratamiento previo con una antraciclina y un taxano en (neo) adyuvancia o para la enfermedad metastásica, a menos que no fuesen aptos para estos tratamientos. Los pacientes con cáncer de mama con receptor hormonal (HR) positivo también deben haber progresado durante o después de la terapia endocrina previa o ser considerados no aptos para la terapia endocrina. Adenocarcinoma pancreático. Lynparza está indicado como monoterapia para el tratamiento de mantenimiento de pacientes adultos con mutaciones germinales en BRCA1/2 que tienen adenocarcinoma metastásico de páncreas y no han progresado después de un mínimo de 16 semanas de tratamiento con platino dentro de un régimen de quimioterapia de primera línea.
Ofev (NINTEDANIB)
Extensión de la indicación (en negrita): Ofev está indicado en adultos para tratar la fibrosis pulmonar idiopática (FPI). Ofev está indicado en adultos para tratar la enfermedad pulmonar intersticial asociada a la esclerosis sistémica (EPI ES). Ofev está también indicado en adultos para tratar otras enfermedades pulmonares intersticiales fibrosantes crónicas con un fenotipo progresivo.
Sivextro (TEDIZOLID FOSFATO)
Extensión de la indicación (en negrita): Sivextro está indicado para el tratamiento de infecciones bacterianas agudas de la piel y tejidos blandos (ABSSSI por sus siglas en inglés) en adultos y adolescentes de 12 años de edad y mayores.
Taltz (IXEKIZUMAB)
Extensión de la indicación (en negrita): Psoriasis en placas. Taltz está indicado para el tratamiento de la psoriasis en placas de moderada a grave en adultos que son candidatos a tratamientos sistémicos. Psoriasis pediátrica en placas. Taltz está indicado para el tratamiento de la psoriasis en placa de moderada a grave en niños desde los 6 años de edad y con un peso corporal de al menos 25 kg y en adolescentes que son candidatos a tratamientos sistémicos. Artritis psoriásica. Taltz, en monoterapia o en combinación con metotrexato, está indicado para el tratamiento de la artritis psoriásica activa en pacientes adultos con respuesta insuficiente o intolerantes a uno o más tratamientos con fármacos antirreumáticos modificadores de la enfermedad (FAME). Espondiloartritis axial. Espondilitis anquilosante (espondiloartritis axial radiográfica). Taltz está indicado para el tratamiento de adultos con espondilitis anquilosante activa que no han respondido adecuadamente al tratamiento convencional. Espondiloartritis axial no radiográfica. Taltz está indicado para el tratamiento de adultos con espondiloartritis axial no radiográfica activa con signos objetivos de inflamación confirmados por un aumento de la proteína C reactiva (PCR) y/o por resonancia magnética (RM) que no han respondido adecuadamente a medicamentos antinflamatorios no esteroideos (AINE).




