Introducción
Los probióticos son ampliamente usados por pacientes con Enfermedad Inflamatoria Intestinal (EII) y frecuentemente recomendados por sus médicos.
Los pacientes con EII tienen una mayor capacidad de permeabilidad intestinal, lo que lleva a una excesiva translocación bacteriana y a la disbiosis -una ruptura del equilibrio entre bacterias intestinales protectoras y dañinas-. Una barrera mucosa defectuosa también promueve la exposición al contenido lumínico y puede desencadenar una activación inmunológica persistente. La microbiota de los pacientes con EII tiene un número reducido de bacterias protectoras (Bifidobacterium y Lactobacillus) y un número mayor de bacterias con potencial patógeno (géneros Escherichia coli y Clostridium), en comparación con la microbiota de los individuos sanos. Además, existe una alteración en la actividad metabólica de los microorganismos presentes en la microbiota intestinal, reduciéndose la síntesis de ácidos grasos de cadena corta (acetato, butirato y propionato) y aumentando la síntesis de toxinas. En este contexto, dada la capacidad de modular la composición de la microbiota intestinal, la administración de probióticos puede ofrecer un método terapéutico complementario para el tratamiento de la EII[1].

Dra. Silvia Gómez Senent
Fuente: Hospital Universitario La Paz
Probióticos
El término ‘probiótico’ se refiere a ‘microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud del huésped’ (FAO y OMS 2002). Por ahora, la definición de probiótico exige que los organismos incluidos en la preparación estén vivos y supone que cualquier efecto biológico o clínico depende de la viabilidad de la bacteria; los estudios que demuestran (aunque en modelos in vitro o animales) que los organismos muertos o las moléculas bioactivas producidas por las bacterias, como proteínas, polisacáridos, ácidos nucleicos o péptidos, también ejercen efectos biológicos que podrían ser beneficiosos en la EII, sugieren que esta definición podría ampliarse en el futuro.
Probióticos: mecanismos de acción relevantes en EII
Muchos probióticos se derivan de la microbiota comensal del intestino humano sano; sus propiedades, comprensiblemente, imitan las de los efectos homeostáticos de la microbiota intacta, y varias son relevantes para la EII.
Las especies de Lactobacillus y Bifidobacterium son las más utilizadas como probióticos, pero también se utiliza la levadura Saccharomyces boulardii y algunas de las especies E. coli y Bacillus.
Las cepas de probióticos se identifican según su género, especie, subespecie (si corresponde) y una designación alfanumérica que identifique una determinada cepa.
En el caso de los probióticos, es importante usar las designaciones de las cepas, ya que la evidencia de los probióticos consiste en atribuir los beneficios a determinadas cepas o combinaciones de cepas de probióticos a una dosis eficaz[1-2].
En primer lugar, una importante bibliografía atestigua los efectos antiinflamatorios de los probióticos que, a su vez, reflejan la tolerancia inmunitaria que existe entre el huésped y su microbiota. Los estudios demuestran que los probióticos alteran el sistema inmunitario de la mucosa a través de un proceso mediado por receptores similares a Toll para promover la diferenciación de las células TH1, aumentando así la producción de anticuerpos; aumentando la actividad de las células fagocitarias y las células asesinas naturales; inhibiendo el factor nuclear kappa, potenciador de la cadena de luz de la vía de las células B activadas; induciendo la apoptosis de las células T; aumentando la regulación de las citoquinas antiinflamatorias, como la interleucina (IL)-10 y el factor de crecimiento transformante beta, y, simultáneamente, aumentando la producción de anticuerpos.
Otra de sus funciones es reducir las citoquinas proinflamatorias como el factor de necrosis tumoral alfa, el interferón gamma y la IL-8.
Fuente: Archivo
Faecalibacterium prausnitzii ha sido identificada como protectora contra la EII en humanos, como lo demuestra su supresión entre los pacientes con esta enfermedad. Esta bacteria induce la IL-10 en las células dendríticas humanas y murinas y previene el desarrollo de la inflamación crónica.
Por otro lado, los probióticos mejoran (o restauran) la función de barrera, cuya interrupción se cree que es otro factor clave en la patogénesis de la EII, al inhibir la apoptosis de las células epiteliales intestinales y promover la síntesis de proteínas que son componentes críticos de las uniones estrechas.
En tercer lugar, y de nuevo reflejando las propiedades de los comensales normales, los probióticos modulan de forma beneficiosa la composición de la microbiota al inhibir el crecimiento de las bacterias patógenas potenciales a través de la producción de bacteriocinas y la creación de un medio más ácido que es contrario a las bacterias proinflamatorias, pero que promueve el crecimiento de especies beneficiosas como los lactobacilos y las bifidobacterias. Los probióticos aumentan la diversidad bacteriana y disminuyen la diversidad de hongos, y también pueden aumentar la producción de ácidos grasos que tienen propiedades antiinflamatorias y anticancerígenas[3].
Probióticos en el tratamiento de la EII
El impacto de los probióticos en la colitis ulcerosa (CU), la enfermedad de Crohn (EC) y la pouchitis ha sido objeto de varias revisiones sistemáticas y metaanálisis. Antes de discutir en vista de las conclusiones de estos estudios, es necesario abordar varias cuestiones. Primero, la combinación de diversas especies y cepas en un solo análisis sugiere que son homogéneas, lo cual no es así; segundo, las poblaciones de pacientes con CU o enfermedad de Crohn son notablemente heterogéneas, y tercero, cuando se revisa críticamente, la calidad metodológica lógica general de los metaanálisis y las revisiones sistemáticas sobre los probióticos en la EII y la pouchitis fue de baja a moderada. Sin embargo, las conclusiones de estas revisiones sistemáticas y narrativas han sido notablemente consistentes; poca evidencia de eficacia en la enfermedad de Crohn, datos modestos e inconsistentes sobre CU, y buen apoyo para el uso de probióticos en la pouchitis.
Autor/a: Milosz1
Fuente: Flickr / Creative Commons
Enfermedad de Crohn
Inducción de remisión
Para la inducción de la remisión en la EC, dos estudios abiertos mostraron una mejoría en las puntuaciones del Crohn Disease Activity Index. Sin embargo, tomados en conjunto, estos dos estudios incluyeron un total de sólo 14 pacientes; un estudio utilizó Lactobacillus rhamnosus GG y el otro una combinación de especies de Lactobacillus y Bifidobacterium. Sin embargo, un ensayo controlado con placebo que incluyó sólo 11 pacientes que inicialmente recibieron tratamiento simultáneo con antibióticos y esteroides durante una semana y luego fueron asignados al azar a un placebo o a Lactobacillus GG no mostró diferencias entre los grupos en el tiempo para la recaída de la enfermedad de Crohn. Sin embargo, sólo 5 de los 11 pacientes completaron el estudio[4].
Mantenimiento de la remisión
En el mantenimiento de la remisión de la enfermedad de Crohn, un estudio que incluía el uso de Lactobacillus rhamnosus GG en niños no mostró ningún beneficio en comparación con el placebo, y se terminó anticipadamente debido a la falta de eficacia y a la dificultad en el reclutamiento. En el estudio más grande y de mayor calidad hasta la fecha, Fedorak et al, estudiaron el impacto del probiótico VSL#3 en las tasas de recaída endoscópica a los 90 y 365 días después de la cirugía de la enfermedad de Crohn. Aunque no se observaron diferencias estadísticas en las tasas de recidiva endoscópica al día 90 (el punto final primario) entre los pacientes que recibieron VSL#3 y los pacientes que recibieron placebo, los niveles mucosos más bajos de citoquinas inflamatorias y una tasa de recidiva más baja entre los pacientes que recibieron VSL#3 durante todo el período de 365 días sugirieron que podría haber cierta eficacia.
En otro ensayo grande, bien diseñado y con un poder estadístico adecuado, Bourreille et al, asignaron al azar a 165 pacientes con enfermedad de Crohn que habían logrado una remisión con esteroides o salicilatos a la levadura probiótica Saccharomyces boulardii o al placebo durante 52 semanas; no se observaron diferencias en las tasas de recurrencia entre los dos grupos. Este hallazgo contrasta con estudios anteriores, mucho más pequeños, con este organismo, los cuales sugirieron beneficios.
Estos hallazgos en estos estudios recientes de alta calidad confirman los de los metaanálisis anteriores; a saber, que no hay beneficio aparente para los probióticos en el mantenimiento de la remisión en la enfermedad de Crohn basado en las tasas de recaída clínica y/o endoscópica. Otros estudios de organismos individuales, ya sea L rhamnosus GG, Lactobacillus johnsonii, o Escherichia coli Nissle 1917, no mostraron ningún impacto en las tasas de remisión[5].
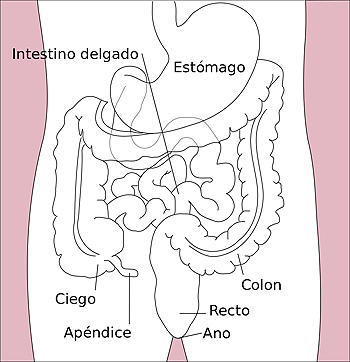
Esquema del sistema digestivo
Autor/a de la imagen: Kordas This SVG image was created by Medium69. Cette image SVG a été créée par Medium69. Please credit this : William Crochot - Image:Stomach_colon_rectum_diagram.svg
Fuente: Wikipedia
Colitis Ulcerosa
Inducción de remisión
Una revisión Cochrane de 2007 que evaluó el uso de los probióticos S boulardii y VSL#3 en la inducción de la remisión en la CU de leve a moderada incluyó cuatro estudios que involucró a un total de 244 pacientes, y concluyó que los probióticos, en combinación con la terapia convencional, no aumentaron las tasas de remisión pero sí proporcionaron un beneficio modesto en términos de reducción de la actividad de la enfermedad.
Dos estudios grandes subsecuentes sugirieron un efecto favorable para el VSL#3. Ambos estudios investigaron el probiótico como un complemento de la terapia estándar que comprende aminosalicilatos o bien tiopurinas. En el primero de estos estudios, el VSL#3 incrementó las tasas de remisión a las 12 semanas, definiéndose la remisión como la combinación de una reducción en la puntuación del Índice de Actividad de la Colitis Ulcerativa (UCDAI) de más del 50% y la curación de la mucosa. Sin embargo, la capacidad de generalizar a partir de estos resultados se vio limitada tanto por la corta duración del estudio como por una gran tasa de abandono del grupo de placebo.
El estudio realizado por Tursi et al no encontró diferencias en las tasas de remisión entre el VSL#3 y el placebo basándose en la evaluación global del médico y en las puntuaciones de la endoscopia, pero sí notó algunos efectos clínicos, como lo demuestran las reducciones en el sangrado rectal y las puntuaciones de frecuencia de las heces. Un estudio mucho más pequeño de 29 niños con CU recién diagnosticada en el que se añadió el VSL#3 al tratamiento estándar que comprende esteroides y ácido 5-aminosalicílico, informó de una tasa de remisión significativamente mayor del 93% para el tratamiento combinado en comparación con sólo el 36% para los que recibieron el tratamiento estándar más el placebo.
Un ensayo controlado aleatorio (ECA) japonés que utilizó una leche fermentada por bifidobacterias, que contenía cepas de Bifidobacterium y Lactobacillus acidophilus, también informó de una reducción significativa en las puntuaciones endoscópicas e histológicas en la CU en comparación con los pacientes que recibieron un placebo. Un estudio grande que aleatorizó a 100 pacientes con CU activa a ciprofloxacino o placebo por 1 semana seguido por E coli Nissle o placebo por 7 semanas como tratamientos adyuvantes encontró que menos pacientes, con el probiótico, lograron remisión clínica, y que el grupo de probióticos experimentó el mayor número de recaídas.
Aunque la mayoría de los estudios sobre el probiótico han administrado el agente activo por vía oral, también se ha estudiado la administración rectal. Un estudio que evaluó el uso de la cepa de E coli Nissle 1917, administrada como enema, en el tratamiento de la proctitis aguda o proctosigmoiditis no mostró beneficios en comparación con el placebo; en cambio, un estudio que comparó el placebo más la mesalacina con el Lactobacillus reuteri ATCC 55730 administrado como enema con mesalacina mostró mejoras en la gravedad de la enfermedad clínica, en los marcadores inflamatorios y en los hallazgos endoscópicos en el grupo de los probióticos.

Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
En la actualidad, por lo tanto, no hay pruebas suficientes para recomendar a favor o en contra del uso de probióticos, ya sea solos o en combinación con el tratamiento estándar para la inducción de la remisión en la CU[6].
Mantenimiento de la remisión
Las pruebas de varios ensayos controlados que utilizaron varios probióticos diferentes (E coli Nissle 1917, S boulardii, Bifidobacterium breve cepa Yakult y Bifidobacterium bifidum cepa Yakult) han sugerido una función para los probióticos en el mantenimiento de la remisión en los pacientes con CU de leve a moderada, en la línea de la mayoría de los estudios que muestran niveles similares de eficacia y seguridad a los regímenes estándar de mesalacinas. Sin embargo, otro estudio que utilizó la combinación de L acidophilus La-5 y Bifidobacterium animalis subespecie lactis BB-12 experimentó resultados menos favorables.
Tres ensayos clínicos usando E Coli Nissle 1917 mostraron que este organismo probiótico era equivalente a la mesalacina de baja dosis (1.2-1.5 g/d) en el mantenimiento de la remisión basada en las puntuaciones de la calidad de vida, la copia endoscópica o la histología. Aunque no hubo diferencias en el tiempo para la recaída entre los tratamientos, un estudio reportó tasas de recaída del 70% en ambos brazos, sugiriendo la inclusión de una población con CU más severa. En contraste, un ECA abierto que comparó el probiótico Lactobacillus GG solo, la mesalacina en una dosis de 2,4 g/d y la combinación de Lactobacillus GG y mesalacina no logró mostrar ninguna diferencia en las tasas de recaída o de eventos adversos entre los tres grupos durante un período de 12 meses basado en las puntuaciones del UCDAI.
Estudios pequeños en niños apoyan el uso de probióticos para el mantenimiento de la remisión en la CU. La adición de VSL#3 al tratamiento estándar disminuyó significativamente las tasas de recaída en comparación con el placebo (21.4% vs 73.3%) cuando se administró dentro del año de la inducción de la remisión en 29 niños con CU, mientras que un ensayo abierto con VSL#3 administrado como adición al tratamiento estándar informó de una tasa de remisión del 61% en 18 niños con CU.

Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
En conjunto, los estudios de probióticos en la inducción y/o mantenimiento de la remisión en la CU sugieren una tendencia hacia el beneficio clínico. Basándose en los datos disponibles, es imposible discernir si una especie, cepa o preparación probiótica específica es mejor que otras en la CU; se necesitan más ensayos clínicos grandes y de alta calidad para definir mejor la colocación general de los probióticos en el manejo de la CU y para delinear las cepas que son óptimas[7].
Pouchitis
Hasta el 60% de los pacientes con CU con una anastomosis anal de bolsa ileal (IPAA) desarrollan una pouchitis. Esa pouchitis puede ser tratada exitosamente con antibióticos, lo que sugiere fuertemente que el microbioma del reservorio juega un papel clave en el desarrollo de este proceso inflamatorio.
Inducción de remisión
Un estudio evaluó la repercusión de Lactobacillus GG en la inducción de la remisión de la pouchitis aguda y, aunque se demostró que la administración del probiótico alteraba la microbiota del reservorio, no hubo beneficios asociados en cuanto a los síntomas o los hallazgos endoscópicos en comparación con el placebo.
Mantenimiento de la remisión
Gionchetti et al demostraron de forma convincente que la terapia profiláctica con el probiótico VSL#3 era altamente eficaz en la prevención primaria de la pouchitis después de un IPAA. La misma formulación también demostró ser muy superior al placebo en la remisión en pacientes que habían desarrollado pouchitis y que habían sido tratados con éxito con antibióticos; se observó una remisión sostenida del 40% al 90% en los pacientes tratados con el cóctel probiótico, en comparación con sólo del 0% al 60% en los que recibieron placebo. Una revisión crítica de los estudios sobre probióticos en la pouchitis planteó una nota de cautela. Todos los estudios tenían limitaciones: tamaño pequeño de las poblaciones de estudio (15-40 pacientes), duración más corta del estudio (3-12 meses) y una falta de uniformidad en la dosificación del probiótico[8].
¿Qué son los prebióticos?
Los prebióticos son componentes alimentarios que son utilizados selectivamente por las bacterias intestinales, confiriéndoles un beneficio para la salud, sobre todo al estimular el crecimiento de las bifidobacterias. Los carbohidratos no digeribles conocidos como fructanos, incluidos los fructooligosacáridos (FOS) y la inulina y los galactanos, incluidos los galactooligosacáridos (GOS), están ampliamente aceptados como prebióticos. Estos carbohidratos se encuentran de forma natural en alimentos como las legumbres, los cereales, la fruta y la verdura. Los prebióticos también pueden ser aislados y producidos comercialmente para su uso como ingredientes funcionales y suplementos[9,10].

Autor/a: (No machine-readable source provided. Own work assumed (based on copyright claims).
Author No machine-readable author provided. Ionutzmovie assumed (based on copyright claims). (User: Atomicbre)
Fuente: Wikipedia
La estructura de los fructanos y galactanos explica su efecto bifidogénico (capacidad de estimular el crecimiento de las bifidobacterias), ya que estos hidratos de carbono contienen enlaces de unión que son degradados respectivamente por las enzimas b-fructosidasa (producida por bifidobacterias, lactobacilos y bacteroides) y b-galactosidasa (producida por bifidobacteria).
Existen varios estudios sobre los efectos beneficiosos de los prebióticos en el tratamiento de la EII, basándose en la inulina, FOS y los GOS. Los hongos y las algas marinas contienen productos potencialmente prebióticos como β–glucano y laminarina, que también se han sugerido como posibles prebióticos para el tratamiento de la EII[11].
Simbióticos
Los simbióticos, definidos como la combinación de un probiótico y un prebiótico, tienen por objeto aumentar la supervivencia y la actividad de los probióticos probados in vivo, promoviendo o potenciando así las propiedades beneficiosas de ambos productos. Los estudios in vitro han demostrado que los simbióticos ejercen efectos antiinflamatorios y algunos muestran propiedades antiproliferativas. La literatura sobre los simbióticos es difícil de interpretar porque a menudo resulta imposible diferenciar entre los beneficios atribuibles al prebiótico, al probiótico o a la interacción entre ellos. Además, la literatura sobre los simbióticos en la EII es escasa[12].
Bibliografía
1. Probióticos y prebióticos. Guía Mundial de la organización mundial de gastroenterología. Guarner F. Febrero 2017.
2. Coqueiro AY, Raizel R, Bonvini A, Tirapegui J, Rogero M. Probiotics for inflammatory bowel diseases: a promising adjuvant treatment . Int J Food Sci Nutr. 2019 Feb;70(1):20-29.
3. Guandalini S, Sansotta N. Probiotics in the treatment of inflammatory bowel disease. Adv Exp Med Biol. 2019; 1125:101-107
4. Hvas CL, Bendix M,2, Dige A, Dahlerup JF, Agnholt J. Current, experimental, and future treatments in inflammatory bowel disease: a clinical review. Immunopharmacol Immunotoxicol. 2018 Dec;40(6):446-460.
5. J. Alard, V. Peucelle, D. Boutillier, J. Breton, S. Kuylle, B. Pot, New probiotic strains for inflammatory bowel disease management identified by combining in vitro and in vivo approaches . Beneficial Microbes, 2018; 9(2): 317-331 .
6. Pradhan D, Mallappa R, Grover S.Comprehensive approaches for assessing the safety of probiotic bacteria. Food Control 108 (2020) 106872.
7. Azad A, Sarker M, Li T. Probiotic Species in the Modulation of Gut Microbiota: An Overview . Biomed Res Int. 2018 May 8;2018:9478630.
8. Derwa Y, Gracie, D.J. Systematic review with meta-analysis: the efficacy of probiotics in inflammatory bowel disease . Aliment Pharmacol Ther. 2017 Aug;46(4):389-400.
9. Lockyer S, Stanner S. Prebiotics – an added benefit of some fibre types . Nutrition Bulletin, 44, 74–91.
10. Rasmussen H, Hamaker R. Prebiotics and Inflammatory Bowel Disease . Gastroenterology Clinics of North America 46 (2017), pp 783–795.
11. Akram W, Garud G, Joshi R. Role of inulin as prebiotics on inflammatory bowel disease . Drug Discoveries & Therapeutics. 2019; 13(1):1-8.
12. Yoon JY. Nutritional approach as therapeutic manipulation in inflammatory bowel disease. Intest Res. 2019 Oct;17(4):463-475




