Dr. Federico Argüelles Arias. Dra. María Belvis Jiménez. Dra. María Fernanda Guerra Veloz.
Servicio de Aparato Digestivo. Hospital Universitario Virgen Macarena. Sevilla
1. Introducción
En 1998 se aprobó el primer biológico para la Enfermedad Inflamatoria Intestinal (EII), Infliximab (IFX)[1], y a partir de ahí se desarrollaron varias moléculas que, sin duda alguna, han mejorado la calidad de vida de los pacientes, aunque con un coste alto para los sistemas sanitarios[2]. Hay que recordar que no sólo se usan en la EII sino también en enfermedades reumáticas, la Artritis Reumatoide (AR) y la Espondilitis Anquilosante (EA), y en alguna enfermedad dermatológica como es la psoriasis. Es por esto, y por su eficacia, que los dos primeros anti-TNF desarrollados, Adalimumab (ADA) e IFX, ocupan los primeros puestos entre los medicamentos más usados en el mundo[3]. Debido a su elevado coste, la llegada de los biosimilares de estas moléculas siempre ha sido considerada una oportunidad de ahorro[4]. Así, en junio de 2013 la Agencia Europea del Medicamento (EMA) aprobó el primer biosimilar de IFX, CT-P13[5], comenzando su comercialización en España en 2015.
Como ya se ha comentado en anteriores artículos de esta misma revista[6,7], existen numerosos trabajos que avalan el uso del biosimilar CT-P13 en la EII. Por tanto, el objetivo de esta breve revisión no es volver a incidir en los mismos, sino actualizar las últimas novedades y contar nuestra experiencia.
2. Biosimilar: breve recordatorio

Dr. Federico Argüelles Arias
Autor/a: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Es importante recordar la definición de biosimilar, un medicamento biológico de origen biotecnológico (generalmente proteínas recombinantes) producido de acuerdo con las exigencias específicas establecidas por la Agencia Europea del Medicamento (EMA) y la Food and Drug Administration (FDA), en cuanto a calidad, eficacia y seguridad[8,9]. Comparte en esencia el mismo principio activo que el original y se administra por la misma vía a la misma dosis, aunque se pueden aceptar algunas diferencias si no tienen ningún efecto sobre la seguridad y la eficacia, por ejemplo, diferencias en la formulación del medicamento (excipientes), presentación (polvo para reconstituir versus solución lista para inyección) y dispositivo de administración (tipo de pluma de administración)[10].
Si el medicamento cuenta con estas propiedades y se demuestra así en algún ensayo clínico para alguna de sus indicaciones ya aprobadas en el caso del original, automáticamente, el biosimilar puede usarse con todas las indicaciones del original. Por esto, tras la aprobación por parte de la EMA del biosimilar de IFX, CT-P13, se generó mucha controversia entre los especialistas de digestivo, probablemente debido a que no teníamos experiencia con este tipo de medicamentos y no conocíamos la normativa de aprobación arriba referida. Así, se escribieron toda clase de comentarios y de artículos, incluso, posicionamientos de Sociedades Científicas, que ponían en duda la forma en la que la EMA había concedido la autorización de uso en la EII[11,12]. Poco a poco, estas dudas se han ido solventando con la experiencia y la evidencia científica y, así, se ha demostrado que CT-P13 es eficaz y seguro en pacientes con EII que no han recibido previamente biológico o IFX, y en aquellos a los que se les intercambia el fármaco original por el biosimilar, el denominado ‘switch’.
En este punto, también es necesario recordar que intercambio o switch es sustituir el fármaco original por el biosimilar, siempre con el consentimiento del paciente y del médico prescriptor, mientras que la sustitución se produce sin conocimiento del médico prescriptor y es algo que, hoy en día, no está permitido[10].
3. Últimos estudios de CT-P13
Muchos estudios se han publicado avalando el uso de CT-P13 en pacientes con EII, bien sean naive[13,14] a biológicos o tras el switch[15-18], pero son estudios a corto plazo, menores del año de seguimiento. Ya existe evidencia a más largo plazo (ver tabla 1) y creemos que esto es importante porque enfatiza la eficacia del fármaco y su seguridad más allá de un tiempo medio de seguimiento como puede ser un año.
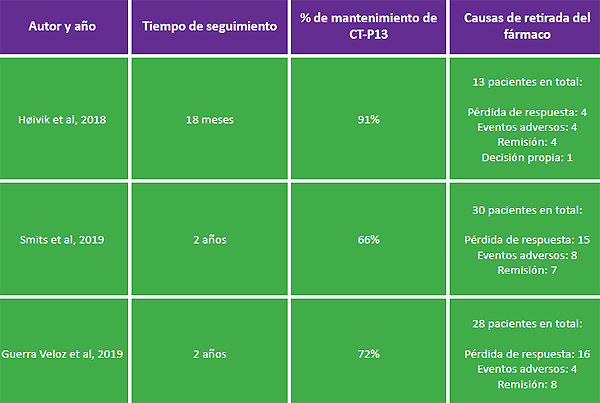
Tabla 1: Estudios observacionales con un período de seguimiento superior al año
Høivik y colaboradores[19] han publicado sus resultados a 18 meses de seguimiento. Incluyeron 143 pacientes, 99 con enfermedad de Crohn (EC) y 44 con colitis ulcerosa (CU). A los 18 meses tras el switch 130 (91%) mantenían el tratamiento con CT-P13. De los 13 que suspendieron el tratamiento, 2 lo hicieron por aparición de anticuerpos antifármaco, 2 por pérdida de respuesta, 4 por eventos adversos, 4 por remisión y uno por deseo expreso del paciente.
El grupo de Smits y colaboradores, que ya había publicado datos a semana 16[20] y al año de seguimiento[21], ha analizado los resultados a 2 años[22] en los pacientes con EII a los que se les realizó el intercambio. En este estudio se incluyeron 83 pacientes. A la semana 104, el 66% (53/83) de los pacientes continuaban con el tratamiento. Al analizar las razones para el cese del fármaco, éstas fueron en 7 casos la remisión de la enfermedad, en 8 casos eventos adversos y en 10 casos la pérdida de respuesta. Los anticuerpos contra el fármaco se detectaron en 5 pacientes antes del switch, y en otros 2 antes de la semana 52. Tras esta semana no se detectaron más anticuerpos. Otro resultado interesante del estudio es que los niveles de fármaco se mantuvieron estables durante todo el tiempo de seguimiento. De igual manera y de forma muy similar a este grupo de trabajo, nosotros hemos ido publicando datos de seguimiento a 6 meses[23], a 1 año[24] y finalmente a 2 años[25].
En este estudio se incluyeron un total de 64 pacientes con EC y 36 con CU. El 72% de los mismos permanecieron con CT-P13 al cabo de los 2 años. Las causas de retirada del fármaco fueron, no sólo pérdida de respuesta, sino también, eventos adversos y remisión mantenida. No se produjeron cambios importantes en los niveles de la PCR ni en los del fármaco y sólo dos pacientes desarrollaron anticuerpos. Como en los otros estudios la pérdida de respuesta a largo plazo fue baja, lo que enfatiza su eficacia. Sin embargo, hay que destacar que el porcentaje principal de retirada de la medicación por pérdida de respuesta se produjo en el primer año, y en nuestra experiencia en los primeros meses tras el intercambio. De tal manera, en el momento basal un 78% de los pacientes estaban en remisión y al año se produjo una caída al 69,9% de los casos, cifra que ya se mantuvo estable en los siguientes meses (a los 18 meses, un 69,9% y a los 2 años, un 68,5%).
Creemos, como veremos más adelante, que el efecto nocebo debe ser tenido en cuenta en este tipo de resultados. Probablemente, éste hace que pacientes poco convencidos del nuevo tratamiento refieran pérdida de eficacia subjetiva (no demostrable por parámetros analíticos) en los primeros meses tras el cambio, y que los que superan este ‘miedo’ al principio del estudio, permanezcan estables a largo plazo. Más adelante tratamos esta cuestión.
En todos estos estudios no había grupo con el que comparar y esta es una de las principales limitaciones de todos ellos. Por esto, y en espera de los resultados de algún ensayo clínico ya en marcha, hemos realizado un estudio[26] con el objetivo principal de comparar la eficacia global y la pérdida de eficacia de los pacientes en remisión en tratamiento con Infliximab original (Remicade®) frente a Infliximab biosimilar (CT-P13).
Para ello, llevamos a cabo un estudio observacional, comparativo de dos cohortes, en el que se incluyeron los pacientes con EII de nuestra Unidad tratados con Infliximab original y aquellos a los que se les realizó el intercambio por el fármaco biosimilar (CT-P13). Se incluyeron 98 pacientes (67 con EC y 31 con CU). La eficacia global para el original al año de tratamiento fue del 71% frente al 68,2% del grupo switch (P = 0.80) (figura 1).
![Figura 1: Resultados de la eficacia global a 1 año de tratamiento en dos cohortes de pacientes con EII; una tratada con IFX original y otra con IFX biosimilar. Gráfica modificada de Guerra Veloz y colaboradores[26] Figura 1: Resultados de la eficacia global a 1 año de tratamiento en dos cohortes de pacientes con EII; una tratada con IFX original y otra con IFX biosimilar. Gráfica modificada de Guerra Veloz y colaborades[26]](http://farmacosalud.com/wp-content/uploads/2019/09/figura-1-CT-P13-quinta-edición-especial-EII.jpg)
Figura 1: Resultados de la eficacia global a 1 año de tratamiento en dos cohortes de pacientes con EII; una tratada con IFX original y otra con IFX biosimilar. Gráfica modificada de Guerra Veloz y colaboradores[26]
La pérdida de respuesta en el grupo del original fue del 6,6% vs 14,5% para el biosimilar (P = 0,806). La tasa de eventos adversos fue del 9,2% en el grupo IFX original vs 11,2% para el biosimilar. Con estos resultados de nuevo, se objetiva la eficacia y seguridad del switch del original por el biosimilar. No obstante, aunque no se alcance significación estadística, sí que se aprecian diferencias entre ambos grupos, atribuibles a diferentes motivos: tiempo de exposición al anti-TNF (el grupo de switch llevaba 1 año más con IFX), estudio retrospectivo en la cohorte de IFX original, pero, sobre todo, al denominado efecto nocebo ya mencionado antes. Dicho efecto también es observado en el estudio de Chaparro et al[27].
Se trata de un estudio multicéntrico nacional, que analiza la eficacia de IFX en dos cohortes, una en la que se había realizado el switch y otra en la que los pacientes habían mantenido el fármaco original. Se incluyeron 467 pacientes, 199 (42%) en la cohorte switch y 277 (58%) en la no-switch.
La media de seguimiento fue superior en la cohorte switch (18 meses) frente a 23 meses en la no-switch. Los datos son llamativos porque en este estudio sí que se observa una mayor pérdida de respuesta en el grupo switch. Así, 38 pacientes de 199 sufrieron pérdida de respuesta en el grupo switch (con una tasa de recaída del 14% por paciente y año) frente a 24 de 277 en la cohorte no-switch (5% por paciente y año). Además, en el análisis multivariante el intercambio fue asociado a riesgo de recaída (HR=3,5; 95% IC=2-6). No obstante, los autores informan que estos resultados deben ser interpretados con cautela porque el empeoramiento clínico de los pacientes switch no se asoció a un empeoramiento en los marcadores analíticos inflamatorios, lo que hace pensar que el efecto nocebo pudo influir de forma importante en estos resultados.
Finalmente, no debemos olvidar que ya han sido publicados dos ensayos clínicos sobre el biosimilar CT-P13.
En el primero de ellos, el estudio SECURE[28], se analizan las concentraciones del biosimilar a la semana 16 tras el switch. Se incluyeron 120 pacientes (46 con CU y 42 con EC finalizaron el estudio) que estaban en remisión clínica y que llevaban más de 30 semanas con el tratamiento original. La concentración media del fármaco tras el switch no varió de forma significativa ni en la CU ni en la EC, habiéndose establecido previamente un margen de no inferioridad no superior al 15%. Este estudio se realizó en pacientes con enfermedad en remisión, mientras que el segundo ensayo clínico[29], muy esperado, es un estudio de no inferioridad, aleatorizado, multicéntrico, doble ciego y de fase 3 en pacientes con enfermedad de Crohn activa y que no habían respondido a los tratamientos no biológicos o no los toleraban.
El diseño del estudio es algo complejo, ya que se asignó a los pacientes aleatoriamente (1:1:1:1) la administración de CT-P13 seguido de CT-P13, CT-P13 seguido de IFX, IFX seguido de IFX, o IFX seguido de CT-P13, con el cambio de tratamiento (switch) en la semana 30. La no inferioridad quedó definida según la guía clínica de la FDA para este tipo de estudios[30]. Los pacientes recibieron 5 mg/kg de CT-P13 o de Infliximab original en las semanas 0, 2, 6, y luego cada 8 semanas hasta la semana 54. La variable principal de valoración fue la proporción de pacientes con una disminución de 70 puntos o más en el Crohn’s Disease Activity Index (CDAI) en la semana 6 respecto a la situación inicial.
Se estableció un margen de no inferioridad de -20% (CT-P13 era no inferior a IFX si el límite inferior del IC del 95% bilateral para la diferencia entre los tratamientos era superior a -20). Las variables de valoración secundarias de la eficacia fueron la respuesta CDAI-70 en la semana 14 y la remisión clínica (definida como un valor absoluto del CDAI < 150 puntos) en las semanas 6, 14, 30 y 54. Las tasas de respuesta CDAI-70 en la semana 6 fueron similares con CT-P13 (77 [69,4%, IC del 95%, 59,9–77,8] de 111) e IFX (81 [74,3%, IC del 95%, 65,1–82,2] de 109; diferencia −4,9% [IC del 95%, −16,9 a 7,3]), por lo que se estableció la no inferioridad. La remisión clínica a la semana 6 fue del 42,3% en el grupo CT-P13 y del 45% en el de IFX. De igual modo, a las semanas 14 y 30 no hubo diferencias en ambos grupos. Semana 14: CDAI-70 en el grupo CT-P13 86,5 vs 88,1% en el grupo IFX. Semana 30: CDAI-70 en el grupo CT-P13 76,6 vs 75,2% en el grupo IFX. Y las tasas de remisión clínica fueron 53,2 vs 55% y 55 vs 56,9% para el grupo CT-P13 vs IFX en las semanas 14 y 30, respectivamente.
Un problema del estudio ha sido no alcanzar potencia estadística suficiente para analizar resultados más allá de la semana 30, es decir, tras el switch. Así, aunque apenas hay diferencias en los grupos, no se aporta análisis estadístico. Las tasas de remisión clínica a la semana 54 fueron: en el grupo CT-P13–CT-P13 62,5%; en el grupo CT-P13–IFX 58,2%; en el grupo IFX–IFX 53,7%; y en el grupo IFX–CT-P13 del 60%. Finalmente, en cuanto a seguridad, comentar que a lo largo del período total del estudio, 147 (67%) pacientes presentaron como mínimo un acontecimiento adverso aparecido con el tratamiento, sin detectarse diferencias significativas en ningún grupo frente a otro: (36 [64%] en el grupo de CT-P13–CT-P13, 34 [62%] en el grupo de CT-P13–IFX, 37 [69%] en el grupo de IFX–IFX y 40 [73%] en el grupo de IFX–CT-P13). Al fin tenemos el esperado ensayo clínico que demuestra que CT-P13 no es inferior a IFX en pacientes con enfermedad de Crohn activa. Sin duda, un dato más para disipar dudas.
4. Efecto nocebo
Tras lo comentado anteriormente, creemos que merece la pena comentar qué es el efecto nocebo. Se define como un empeoramiento de los síntomas de una enfermedad por una expectativa negativa de un tratamiento prescrito, ya sea de forma consciente o inconsciente[31]. Sin duda alguna, las expectativas que genera el médico en el paciente y su forma de comunicar pueden hacer que la respuesta a un medicamento sea incluso más favorable de lo esperado, por un cierto efecto placebo. Bien al contrario, si el médico transmite dudas sobre el medicamento, incertidumbre e, incluso, el paciente siente inseguridad en su prescriptor, el efecto nocebo juega un papel fundamental en la probable menor respuesta que el medicamento tenga[32].
En la conocida encuesta[33] realizada a 1.059 pacientes europeos con EII sobre los biosimilares, sólo un 32% habían oído hablar de estos fármacos, y, de ellos, un 47% estaban preocupados sobre su seguridad y un 39% estaban preocupados por una menor eficacia. Además, los resultados de algunos estudios observacionales que ya hemos comentado[26,27] y otros, como, por ejemplo, el denominado estudio BIO-SWITCH[34] y el estudio DANBIO[35] en los que se observa un empeoramiento no justificado de los pacientes a los que se había realizado el switch (en torno a un 15% de los casos al año de seguimiento), el efecto nocebo se ha situado como un problema importante que reduce la eficacia del biosimilar y aumenta su coste.
En otro estudio[36] específicamente diseñado para cuantificar este efecto y realizado tanto en pacientes con EII como enfermedades reumatológicas, este efecto se cuantifica en torno a un 13% de los casos a los 6 meses.
Por todo esto, recientemente, se ha publicado un consenso de actuación[37] para minimizar este efecto. Aún con poca evidencia científica, el consenso reclama que la educación sobre los biosimilares tanto a pacientes como a prescriptores es fundamental y que una adecuada comunicación individual con el paciente y el convencimiento del prescriptor a la hora de realizar el switch son necesarios para conseguir evitar este efecto.
5. Conclusiones
El biosimilar de Infliximab, CT-P13, generó, en un principio, un amplio debate y mucha controversia, basada en el desconocimiento que existía de las normas regulatorias sobre este tipo de medicamentos. Actualmente los datos existentes concluyen que es eficaz, seguro y, además, es evidente que ha reducido los costes sanitarios. No obstante, esto no quiere decir que pueda aceptarse la sustitución automática ya que, como hemos comentado, el efecto nocebo, debe ser minimizado[38], por lo que abogamos siempre por la necesaria aceptación del prescriptor y del paciente para realizar el intercambio.
Bibliografía
1. European Medicines Agency. European public assessment reports - Infliximab. Available at: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/landing/epar_search.jsp&mid=WC0b01ac058001d124&source=homeMedSearch &keyword=Infliximab&category=human&isNewQuery=true. Accessed on January 23, 2017.
2. Di Sabatino A, Liberato L, Marchetti M, Biancheri P, Corazza GR. Optimal use and cost-effectiveness of biologic therapies in inflammatory bowel disease. Intern Emerg Med. 2011; 6 Suppl 1:17-27.
3. Expansion.com. Avalaible in: https://www.expansion.com/empresas/2017/08/08/5988c908e5fdea32328b4627.html. Accessed on July 2019.
4. Weise M, et al. Biosimilars: what clinicians should know. Blood. 2012; 120: 5111-7
5. European Medicines Agency. CHMP assessment report Remsima [EMA/CHMP/589317/2013]. London: EMA, 2013
6. Calvet Calvo X, Melcarne L. Infliximab biosimilar CT-P13. Últimos datos de switch en EII. Actualizaciones en Enfermedad Inflamatoria Intestinal. 4a Edición
7. Echarri A. SWITCH Infliximab–Biosimilar CT-P13. Eficacia y seguridad. Actualizaciones en Enfermedad Inflamatoria Intestinal. 3a Edición
8. European Medicines Agency. Procedural advice for users of the centralized procedure for similar biological medicinal products applications. London, UK: European Medicines Agency; 2011. EMA/940451/2011
9. US Food and Drug Administration. Guidance for industry: quality considerations in demonstrating biosimilarity to a reference protein product. [Accessed May 21, 2014]. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM291134.pdf. Published 2012.
10. European Medicines Agency- New guide on biosimilar medicines for healthcare professionals. [Accessed 21 January 2018]. Available from: http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2017/05/news_detail_002739.jsp&mid=WC0b01ac058004d5c1
11. Argüelles-Arias F, Barreiro-de-Acosta M, Carballo F, Hinojosa J, Tejerina T. Joint position statement by “Sociedad Española de Patología Digestiva” (Spanish Society of Gastroenterology) and “Sociedad Española de Farmacología” (Spanish Society of Pharmacology) on biosimilar therapy for inflammatory bowel disease. Rev Esp Enferm Dig. 2013; 105: 37-43.
12. Danese S, Gomollon F; Governing Board and Operational Board of ECCO. ECCO position statement: the use of biosimilar medicines in the treatment of inflammatory bowel disease (IBD). J Crohns Colitis. 2013; 7: 586-9.
13. Farkas K, Rutka M, Bálint A, Nagy F, Bor R, Milassin Á, et al. Efficacy of the new infliximab biosimilar CT-P13 induction therapy in Crohn's disease and ulcerative colitis - experiences from a single center. Expert Opin Biol Ther. 2015; 15: 1257-62.
14. Keil R, Wasserbauer M, Zádorová Z, Hajer J, Drastich P, Wohl P, et al. Clinical monitoring: infliximab biosimilar CT-P13 in the treatment of Crohn's disease and ulcerative colitis. Scand J Gastroenterol. 2016; 51: 1062-8.
15. Gecse KB, Lovász BD, Farkas K, Banai J, Bene L, Gasztonyi B, et al. Efficacy and Safety of the Biosimilar Infliximab CT-P13 Treatment in Inflammatory Bowel Diseases: A Prospective, Multicentre, Nationwide Cohort. J Crohns Colitis. 2016; 10: 133-40.
16. Bergqvist V, Kadivar M, Molin D, Angelison L, Hammarlund P, Olin M, et al. Switching from originator infliximab to the biosimilar CT-P13 in 313 patients with inflammatory bowel disease. Therap Adv Gastroenterol 2018; 11: 1756284818801244.
17. Fiorino G, Manetti N, Armuzzi A, Orlando A, Variola A, Bonovas S, et al. The PROSIT-BIO Cohort: A Prospective Observational Study of Patients with Inflammatory Bowel Disease Treated with Infliximab Biosimilar. Inflamm Bowel Dis. 2017; 23: 233-243.
18. Guerra Veloz MF, Vázquez Morón JM, Belvis Jiménez M, Pallarés Manrique H, Valdés Delgado T, Castro Laria L, et al. Switching from reference infliximab to CT-P13 in patients with inflammatory bowel disease: results of a multicenter study after 12 months. Rev Esp Enferm Dig. 2018; 110: 564-570.
19. Høivik ML, Buer LCT, Cvancarova M, Warren DJ, Bolstad N, Moum BA, et al. Switching from originator to biosimilar infliximab - real world data of a prospective 18 months follow-up of a single-centre IBD population. Scand J Gastroenterol 2018; 53: 692–699.
20. Smits LJ, Derikx LA, de Jong DJ, Boshuizen RS, van Esch AA, Drenth JP, et al. Clinical Outcomes Following a Switch from Remicade® to the Biosimilar CT-P13 in Inflammatory Bowel Disease Patients: A Prospective Observational Cohort Study. J Crohns Colitis. 2016; 10(11): 1287-1293.
21. Smits LJT, Grelack A, Derikx LAAP, de Jong DJ, van Esch AAJ, Boshuizen RS, et al. Long-Term Clinical Outcomes After Switching from Remicade(®) to Biosimilar CT-P13 in Inflammatory Bowel Disease. Dig Dis Sci. 2017; 62(11): 3117-3122.
22. Smits LJT, van Esch AAJ, Derikx LAAP, Boshuizen R, de Jong DJ, Drenth JPH, et al. Drug Survival and Immunogenicity After Switching From Remicade to Biosimilar CT-P13 in Inflammatory Bowel Disease Patients: Two-year Follow-up of a Prospective Observational Cohort Study. Inflamm Bowel Dis. 2019; 25: 172-179.
23. Argüelles-Arias F, Guerra Veloz MF, Perea Amarillo R, Vilches-Arenas A, Castro Laria L, Maldonado Pérez B, et al. Effectiveness and Safety of CT-P13 (Biosimilar Infliximab) in Patients with Inflammatory Bowel Disease in Real Life at 6 Months. Dig Dis Sci. 2017; 62: 1305-1312.
24. Argüelles-Arias F, Guerra Veloz MF, Perea Amarillo R, Vilches-Arenas A, Castro Laria L, Maldonado Pérez B, et al. Switching from reference infliximab to CT-P13 in patients with inflammatory bowel disease: 12 months results. Eur J Gastroenterol Hepatol. 2017; 29:1290-1295.
25. Guerra Veloz MF, Belvis Jiménez M, Valdes Delgado T, Castro Laria L, Maldonado Pérez B, Perea Amarillo R, et al. Long-term follow up after switching from original infliximab to an infliximab biosimilar: real-world data. Therap Adv Gastroenterol. 2019; 12: 1756284819858052.
26. Guerra Veloz MF, Argüelles-Arias F, Castro Laria L, Maldonado Pérez B, Benítez Roldan A, Perea Amarillo R, et al. Loss of efficacy and safety of the switch from infliximab original to infliximab biosimilar (CT-P13) in patients with inflammatory bowel disease. World J Gastroenterol. 2018; 24: 5288-5296.
27. Chaparro M, Garre A, Guerra Veloz MF, Vázquez JM, De Castro ML, Leo E, et al . Effectiveness and safety of the switch from Remicade to CT-P13 in patients with inflammatory bowel disease. J Crohns Colitis. 2019. [Epub ahead of print]
28. Strik AS, van de Vrie W, Bloemsaat-Minekus JPJ, et al. Serum concentrations after switching from originator infliximab to the biosimilar CT-P13 in patients with quiescent inflammatory bowel disease (SECURE): an open-label, multicentre, phase 4 noninferiority trial. Lancet Gastroenterol Hepatol 2018; 3: 404–12.
29. Ye BD, Pesegova M, Alexeeva O, Osipenko M, Lahat A, Dorofeyev A, et al. Efficacy and safety of biosimilar CT-P13 compared with originator infliximab in patients with active Crohn's disease: an international, randomised, double-blind, phase 3 non-inferiority study. Lancet. 2019; 393: 1699-1707.
30. US Food and Drug Administration. Non-inferiority clinical trials to establish effectiveness. Guidance for industry. November 2016. https: //www.fda.gov/downloads/Drugs/Guidance/UCM202140.pdf (accesed April 10, 2018)
31.Colloca L, Finniss D. Nocebo effects, patient-clinician communication, and therapeutic outcomes. JAMA 2012; 307: 567–8.
32. Webster RK, Rubin GJ. Influencing Side-Effects to Medicinal Treatments: A Systematic Review of Brief Psychological Interventions. Front Psychiatry. 2019; 9: 775.
33. Peyrin-Biroulet L, Lönnfors S, Roblin X, Danese S, Avedano L. Patient Perspectives on Biosimilars: A Survey by the European Federation of Crohn's and Ulcerative Colitis Associations. J Crohns Colitis. 2017; 11: 128-133.
34. Tweehuysen L, van den Bemt BJF, van Ingen IL, de Jong AJL, van der Laan WH,van den Hoogen FHJ, et al. Subjective Complaints as the Main Reason for Biosimilar Discontinuation After Open-Label Transition From Reference Infliximab to Biosimilar Infliximab. Arthritis Rheumatol. 2018; 70: 60-68.
35. Glintborg B, Sørensen IJ, Loft AG, Lindegaard H, Linauskas A, Hendricks O. A nationwide non-medical switch from originator
infliximab to biosimilar CT-P13 in 802 patients with inflammatory arthritis: 1-year clinical outcomes from the DANBIO registry. Ann Rheum Dis. 2017;76: 1426-1431.
36. Boone NW, Liu L, Romberg-Camps MJ, Duijsens L, Houwen C, van der Kuy PHM,et al. The nocebo effect challenges the non-medical infliximab switch in practice. Eur J Clin Pharmacol. 2018; 74: 655-661.
37. Pouillon L, Danese S, Hart A, Fiorino G, Argollo M, Selmi C, et al. Consensus report:clinical recommendations for the prevention and management of the nocebo effect in biosimilar-treated IBD patients. Aliment Pharmacol Ther. 2019; 49: 1181-1187.
38. Ebbers HC, Schellekens H. Are we ready to close the discussion on the interchangeability of biosimilars? Drug Discov Today. 2019 [Epub ahead of print]




