Redacción Farmacosalud.com
Roche ha anunciado nuevos datos de la primera parte del estudio de referencia FIREFISH, para identificar la dosis, que muestra que los bebés con atrofia muscular espinal tipo 1 (AME) alcanzaron hitos clave en la capacidad motora tras un año de tratamiento con la terapia en investigación Risdiplam[1]. Entre los bebés que recibieron la dosis seleccionada para la segunda parte confirmatoria del estudio (n=17), 7 (41.2%) pudieron sentarse sin apoyo durante al menos 5 segundos, evaluados por la Escala de Motricidad de Bayley de Desarrollo Infantil- Tercera edición (BSID-III). Además, 11 (64.7%) bebés pudieron sentarse (con o sin apoyo) mientras que 9 (52.9%) lograron un control de la cabeza en posición vertical después de 12 meses de tratamiento, según la evaluación a través de la sección 2 del Examen Neurológico Infantil de Hammersmith (HINE-2). Finalmente, 1 niño (5.9%) logró el objetivo clave de permanecer de pie (soportando el peso) en este seguimiento de 12 meses.
Los datos se han presentado en la 71ª Reunión Anual de la Academia Americana de Neurología (AAN), celebrada en Filadelfia (Pensilvania). Tal y como explica el investigador principal del estudio, el doctor Giovanni Baranello, del Carlos Besta Neurological Research Institute Foundation, Developmental Neurology Unit, de Milán (Italia), “las mejoras continuas en los hitos conseguidos en la capacidad motora y en el estado funcional que se han visto, hasta la fecha, en el estudio FIREFISH son significativas para esta población con AME tipo 1, donde la mayoría de los bebés comenzaron el tratamiento a los casi siete meses de edad. Estos resultados son esperanzadores y refuerzan aún más un enfoque de tratamiento que aumenta la supervivencia de las proteínas neuronales motoras, tanto en el sistema nervioso central como a nivel periférico”.

Autor/a de la imagen: E. Arandes / www.farmacosalud.com
Fuente: www.farmacosalud.com
La primera parte del FIREFISH también evaluó la función motora a través del Test de Trastornos Neuromusculares del Hospital Infantil de Filadelfia (CHOP-INTEND), una escala utilizada para los bebés con AME tipo 1[1]. Los resultados mostraron que 10 de los 17 bebés (58.8%) en el grupo con la dosis terapéutica obtuvieron una puntuación total de 40 puntos o más en la escala CHOP-INTEND[1]. El cambio medio desde el inicio hasta el mes 12 en CHOP-INTEND fue de 17.5 puntos. La puntuación máxima de CHOP-INTEND fue de 57 puntos después de 12 meses de tratamiento, aumentando un máximo de 49 puntos después de 8 meses[1].
Entre los 21 bebés incluidos en la primera parte del estudio FIREFISH, la duración media del tratamiento fue de 14.8 meses, con 19 niños tratados durante más de 12 meses[2]. Tres bebés experimentaron complicaciones graves debido a su enfermedad después de aproximadamente 1, 8 y 13 meses de tratamiento. Según el investigador, ninguno de estos casos ha sido relacionado con Risdiplam. Ningún bebé ha perdido la capacidad de tragar durante el estudio y ningún niño ha requerido una traqueotomía o ventilación permanente[2]. La supervivencia libre de eventos fue 18 de 21 (85.7%) en general y 15 de 17 (88.2%) en el grupo con la dosis terapéutica. Los eventos adversos más comunes incluyeron fiebre (pirexia; 52.4%), infecciones del tracto respiratorio superior (42.9%), diarrea (28.6%), vómitos (23.8%), tos (23.8%) neumonía (19.0%) y estreñimiento (19.0%)[2].
Estudio pivotal SUNFISH
Roche también ha presentado nuevos datos de la primera parte del estudio pivotal SUNFISH en personas de 2 a 25 años con AME tipo 2 ó 3. Esta primera parte del estudio se dirige a identificar la dosis terapéutica e incluye una población de pacientes especialmente amplia. El estado funcional de inicio variaba entre los pacientes, desde personas que no pueden sentarse hasta personas capaces de caminar. Se incluyeron pacientes sin escoliosis como con ella, incluso severa. Como se informó anteriormente, se observó un aumento medio sostenido desde el inicio en la proteína SMN, en sangre, de más de dos veces, después de 12 meses de tratamiento con Risdiplam.
Los eventos adversos más frecuentes en esta primera parte del estudio SUNFISH fueron fiebre (pirexia; 41%), tos (33%), vómitos (29%), infecciones del tracto respiratorio superior (26%), dolor de garganta persistente (dolor orofaríngeo; 22 %) y frío (nasofaringitis; 20%)[3]. El evento adverso grave más común que se dió en dos de los 51 pacientes expuestos a Risdiplam fue la neumonía[3]. Hasta la fecha, no se han encontrado resultados de seguridad relacionados con el tratamiento que conlleven la retirada de cualquier estudio[2,3].
Un análisis de eficacia exploratorio de la primera parte (n=51) del estudio SUNFISH evaluó la función motora utilizando la escala de Medida de la Función Motora -32 (MFM32). Esta escala está diseñada para detectar cambios en la función motora en un amplio rango de pacientes con AME, desde un tipo 2 débil hasta un tipo 3 fuerte y, por lo tanto, es más apropiada para la población incluida en el estudio SUNFISH. Un paciente se retiró del ensayo durante el periodo de extensión[3]. Entre los pacientes para los que se completó la escala MFM32 en todas las visitas hasta el mes 12 (n= 43), el 58% alcanzó una mejoría desde el inicio de al menos 3 puntos en la escala incluido el 71% entre los pacientes de 2 a 11 años de edad y 42% en los de 12 a 25 años[3]. Si bien la primera parte del estudio SUNFISH no fue diseñada ni impulsada para valorar la eficacia, el cambio desde la situación de base en la puntuación total de MFM32 es el objetivo principal de eficacia en la segunda parte (n= 180) del estudio que ya está en marcha.
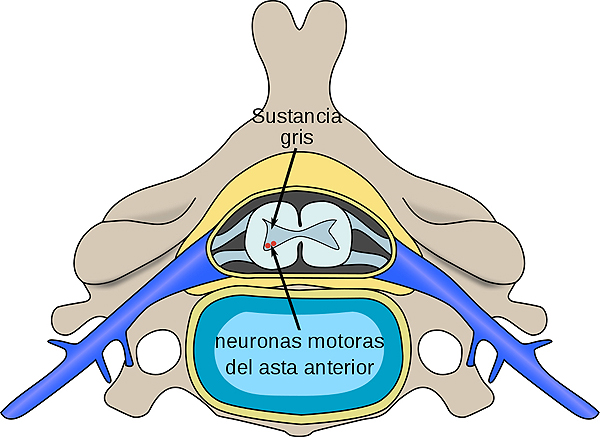
Localización, en la médula espinal, de neuronas afectadas por la atrofia muscular espinal
Autor/a: Cervical vertebra blank.svg: Fred the Oyster Polio spinal diagram.PNG: DO11.10 Polio spinal diagram es.png: Rαge Derived: Angelito7 - Cervical vertebra blank.svg Polio spinal diagram.PNG Polio spinal diagram es.png
Fuente: Wikipedia
Las segundas partes confirmatorias de dosis de los estudios SUNFISH y FIREFISH han completado ya el reclutamiento de pacientes, realizarán sus análisis de eficacia en el cuarto trimestre de 2019 y en el primer trimestre de 2020respectivamente.
Sobre la AME
La Atrofia Muscular Espinal (AME) es una enfermedad neuromuscular grave, hereditaria y progresiva que causa atrofia muscular devastadora y complicaciones relacionadas con la enfermedad[4]. Es la causa genética más común de mortalidad infantil y una de las enfermedades raras más frecuentes, que afecta aproximadamente a uno de cada 11.000 bebés[5]. La AME conduce a la pérdida progresiva de células nerviosas en la médula espinal que controlan el movimiento muscular[6]. Dependiendo del tipo de AME, la fuerza física de un individuo y su capacidad para caminar, comer o respirar pueden disminuir o perderse significativamente[7]. La AME está causada por una mutación en el gen de la neurona motora de supervivencia 1 (SMN1) que resulta en una deficiencia de la proteína SMN[6]. La proteína SMN se encuentra en todo el cuerpo y cada vez hay más evidencias que sugieren que la AME es un trastorno multisistémico y que la pérdida de la proteína SMN puede afectar muchos tejidos y células, lo que puede impedir el funcionamiento del cuerpo[8].
Risdiplam es un medicamento en investigación administrado por vía oral que se está estudiando en un amplio grupo de pacientes con AME, desde 1 mes hasta los 60 años de edad. Está diseñado para proporcionar incrementos sostenidos en la proteína SMN a nivel central y periférico a través de la dosificación diaria y se está evaluando por su potencial capacidad potencial para ayudar al gen SMN2 a producir una proteína SMN más funcional de manera sistémica[9].
Referencias
1. Baranello G et al. FIREFISH Part 1: 1-Year Results on Motor Function in Babies with Type 1 SMA. S25.003. Presented at 71st American Academy of Neurology Annual Meeting, Philadelphia, Pennsylvania, 4-10 May 2019.
2. Servais L et al. FIREFISH Part 1: Survival, Ventilation and Swallowing Ability in Babies with Type 1 SMA Receiving Risdiplam (RG7916). S25.008. Presented at 71st American Academy of Neurology Annual Meeting, Philadelphia, Pennsylvania, 4-10 May 2019.
3. Mercuri E. Update from SUNFISH Part 1: Safety, Tolerability and PK/PD from the Dose-Finding Study, Including Exploratory Efficacy Data in Patients with Type 2 or 3 Spinal Muscular Atrophy (SMA) Treated with Risdiplam (RG7916). S25.007. Presented at 71st American Academy of Neurology Annual Meeting, Philadelphia, Pennsylvania, 4-10 May 2019.
4. Farrar MA and Kiernan MC. The genetics of spinal muscular atrophy: progress and challenges. Neurotherapeutics. 2015; 12:290- 302.
5. Cure SMA. About SMA. 2018. Available from: http://www.curesma.org/sma/about-sma/. Accessed March 2019.
6. Kolb SJ and Kissel JT. Spinal muscular atrophy. Neurol Clin. 2015; 33:831-46
7. Spinal Muscular Atrophy UK. What is spinal muscular atrophy? Available from: http://www.smasupportuk.org.uk/what-is-spinal-muscular-atrophy. Accessed March 2019.
8. Hamilton G and Gillingwater TH. Spinal muscular atrophy: going beyond the motor neuron. Trends Mol Med. 2013; 19:40-50.
9. Ratni H et al. Discovery of risdiplam, a selective survival motor neuron-2 (SMN2) gene splicing modifier for the treatment of spinal muscular atrophy (SMA). J Med Chem. 2018; 61:6501-17.




