Dra. Elena del Alcázar / Dr. José Manuel Carrascosa
Introducción
El metotrexato (MTX) es el fármaco sistémico convencional más utilizado en la psoriasis. Las primeras referencias de su uso en esta enfermedad se remontan a los años 50[1] y fue en 1972 cuando la Food and Drug Administration (FDA) aprobó su indicación para el tratamiento de la psoriasis. En la actualidad continúa siendo un tratamiento de primera línea en las formas moderadas y graves, tanto en monoterapia como asociado con otros fármacos.
Mecanismo de acción
El MTX (C20H22N8O5) es un antimetabolito análogo del ácido fólico derivado por metilación de la ametopterina, su precursor. Es un inhibidor competitivo de la enzima dihidrofólico-reductasa que cataliza la reducción del ácido dihidrofólico-reductasa (FH2) en tetrahidrofólico (FH4). El MTX posee una triple acción antiinflamatoria, antiproliferativa e inmunosupresora.
Dosificación y vía de administración
Placas de psoriasis en el codo («Psoriasis». Publicado bajo la licencia CC BY-SA 3.0 vía Wikimedia Commons)
Autor/a de la imagen: User:Marnanel
Fuente: Wikipedia / Methoxyroxy~commonswiki
MTX está disponible para administración oral en comprimidos de 2.5 mg y para administración subcutánea o intramuscular en jeringuillas precargadas y en pluma precargada (autoinyector) en diferentes presentaciones que cubren un rango de dosis entre los 7.5 mg y los 30 mg. Las dosis administradas en psoriasis moderada-severa son dosis que van desde 7.5 mg a 20-25 mg[2]. Se administra en pauta semanal, un solo día o en tres tomas en dos días consecutivos para disminuir los efectos adversos gastrointestinales. La forma subcutánea puede reducir la toxicidad gastrointestinal[3,4] y es preferible utilizarla cuando existan riesgos de error en la pauta de administración, incumplimiento, intolerancia gastrointestinal o respuesta insuficiente a dosis plenas por vía oral[2].
Estrategia terapéutica
De forma histórica se ha utilizado la estrategia de administrar algunas ‘dosis de prueba’ con el objetivo de prevenir el potencial tóxico del fármaco y la posibilidad de aparición de reacciones idiosincrásicas. Sin embargo, esta actitud no se ha demostrado fundamentada en la evidencia. En la actualidad, la dosis recomendada de inicio es de 10-20 mg/semana si el paciente no presenta factores de riesgo, con una dosis terapéutica de 15 mg/semana para la mayoría de pacientes y máxima de 20-25mg/semana. El efecto terapéutico suele aparecer a los largo de las primeras 4-8 semanas, pero es recomendable esperar unas 12-16 semanas en pacientes con dosis plenas que no responden para considerar el fallo terapéutico[2].
Suplementación con folatos
La suplementación con folatos en los pacientes en tratamiento con MTX está justificada por una disminución de efectos adversos[4] sin impacto negativo en la respuesta terapéutica[5]. Se recomienda la administración de 5-15 mg de ácido fólico o de 15 mg/semana de ácido folínico, 28-48 horas tras la administración del fármaco. Sin embargo, no existe evidencia de que deba priorizarse el ácido fólico o el folínico, aunque el bajo coste del ácido fólico favorece su eficiencia frente al folínico[2].
Indicaciones
MTX está indicado para el tratamiento de la psoriasis en placa moderada-grave y la artropatía psoriásica. Aunque también se utiliza en otras formas de psoriasis, la evidencia sobre el uso de MTX es escasa en variantes como la eritrodérmica, la palmoplantar, la onicopatía psoriásica o la psoriasis pustulosa generalizada[6-8]. Además, su asociación a dosis bajas con los anti-TNF, especialmente con infliximab y adalimumab, es útil para reducir el desarrollo de anticuerpos anti-TNF y mantener así la eficacia del tratamiento biológico[9].
Contraindicaciones
El MTX es abortivo y teratógeno (categoría D de la FDA), por lo que está contraindicado en las embarazadas y durante la lactancia. En los varones se recomienda posponer el deseo de embarazo hasta 3 meses de la suspensión del mismo, debido al efecto del fármaco sobre las células en división como los espermatocitos. Otras contraindicaciones absolutas serían la presencia de anemia, leucopenia y trombocitopenia importantes, inmunodeficiencias, úlcera péptica, insuficiencia respiratoria y alcoholismo[10].
Eficacia en psoriasis
Placas de psoriasis en las palmas de las manos
(imagen modificada) Autor/a del original: US Military - http://history.amedd.army.mil/booksdocs/wwii/internalmedicinevolIII/chapter20figure100.jpg
Fuente: Wikipedia
Los datos de eficacia de MTX en psoriasis provienen en su mayoría de la experiencia clínica acumulada y de estudios retrospectivos. Hay algunos estudios prospectivos que comparan el MTX a dosis variables con otros fármacos como la ciclosporina[11,12] o algunos agentes biológicos (adalimumab, infliximab, briakinumab)[13-15], en los que se observó que la eficacia de MTX es inferior a la que consiguen tanto la ciclosporina como los biológicos. Por otro lado, un reciente meta-análisis, que incluye tres estudios con MTX oral, demuestra que el 45,2% (IC 95% 34,1-60,0) de los pacientes alcanzaron el PASI 75 a las 12 semanas con dosis de inicio de 5mg semanales llegando a dosis de 25 mg[16].
Respecto a la vía de administración, en algunos estudios en pacientes con artritis reumatoide se observó que la vía subcutánea fue superior a la oral[3,17]. En psoriasis no disponemos de estudios head-to-head, sin embargo, Warren et al. publicaron el estudio más importante con MTX subcutáneo (METOP) en psoriasis hasta la fecha actual[18]. Se trata de un ensayo clínico aleatorizado, a doble ciego, de MTX subcutáneo versus placebo en pacientes con psoriasis en placas moderada-grave (PASI ≥ 10). Durante las primeras 16 semanas los pacientes recibieron placebo (n = 29) o MTX subcutáneo (n = 91) a dosis de 17,5 mg/semana, aumentando a 22,5 mg/semana según respuesta clínica a la semana 8. Posteriormente, todos los pacientes recibieron MTX subcutáneo hasta la semana 52. A la semana 16, el 41% del grupo con MTX subcutáneo y el 10% del grupo placebo consiguieron un PASI75 (riesgo relativo: 3,93; IC 95%: 1,31- 11,81; p = 0,0026). Estos resultados con MTX subcutáneo a las 12-16 semanas son similares a los observados previamente con MTX oral, con un PASI75 en torno al 40%. No obstante, el estudio METOP mostró, de manera indirecta, que la vía subcutánea parece mostrar algunas ventajas respecto la vía oral. Así, se observó una eficacia más temprana (a la semana 8, el 27% de los pacientes alcanzaron el PASI 75 frente al 20% con MTX oral en otro estudio[13,18] y una respuesta superior a largo plazo (a la semana 52, el PASI 75 se alcanzó en el 45% con MTX subcutáneo en este estudio frente el 24% con MTX oral en otro estudio[15,18]).
Seguridad
La toxicidad por MTX es bien conocida, aunque como ocurre con la eficacia, la mayoría de datos provienen de estudios retrospectivos y práctica clínica habitual. Además, el hecho de que las dosis utilizadas en psoriasis sean bajas (<30mg/semanales), hace que la evidencia disponible de la seguridad del fármaco en esta población sea más escasa.
En una reciente revisión sistemática en la que se incluyeron 68 ensayos aleatorizados de MTX versus placebo en pacientes con psoriasis tratados a dosis bajas, se observó un incremento de los siguientes acontecimientos adversos (AA) en los pacientes con MTX: náuseas/vómitos, niveles elevados de transaminasas, aftas orales, leucopenia, trombopenia e infecciones, pero no se observó un riesgo aumentado de AA graves ni de muerte. La prescripción con folatos se asoció a un menor riesgo de efectos adversos y la vía oral se asoció a un mayor riesgo de dolor abdominal[4]. Estos AA son concordantes con los ya conocidos en la literatura y los que se suelen observar en la práctica habitual. Por otro lado, se observó que algunos de los AA fueron motivo de discontinuación del MTX como la elevación de las transaminasas, el dolor abdominal y las náuseas/vómitos.
En el estudio METOP con MTX subcutáneo, el fármaco fue bien tolerado y a lo largo de las 52 semanas discontinuaron el tratamiento un 12% por elevación de las transaminasas y sólo un 3% por motivos gastrointestinales[18].
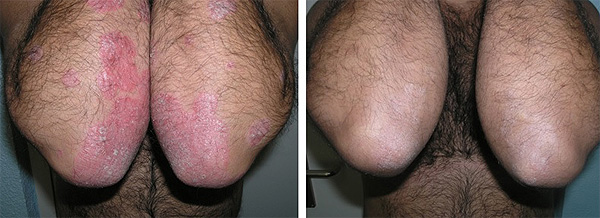
Paciente con psoriasis moderada-grave en tratamiento con MTX subcutáneo a dosis de 15 mg semanales. Pre (a la izq.) y post-tratamiento después de 12 semanas
Fuente: Drs. Del Alcázar y Carrascosa
La posible hepatotoxicidad crónica derivada del uso de MTX a largo plazo es el principal motivo que ha justificado históricamente el uso del tratamiento de forma intermitente o discontinuo con el fin de evitar la toxicidad acumulada. Sin embargo, datos recientes de la literatura sugieren que el MTX puede ser considerablemente menos hepatotóxico de lo que se asumió anteriormente y, en este sentido, si bien el MTX se asocia con un mayor riesgo de niveles elevados de transaminasas, el riesgo de eventos adversos hepáticos graves es bajo en la actualidad[19]. No obstante, sí que es importante destacar que el hecho de presentar ciertos factores de riesgo (consumo de alcohol, hepatopatía previa, obesos y/o diabéticos) conlleva un mayor riesgo de sufrir daño hepático. Por otro lado, si bien la biopsia hepática se ha propuesto históricamente como el test diagnóstico adecuado para evaluar el daño hepático, actualmente se recomienda el uso de técnicas no invasivas (procolágeno tipo III, scores con biomarcadores, elastrografía de transición) para la monitorización de la hepatotoxicidad.
Supervivencia del fármaco
Otero et al. observaron en un registro prospectivo con 85 pacientes tratados con MTX (el 84% recibieron MTX oral) una supervivencia del 63%, 50% y 15% al año, tres y cinco años, respectivamente. La supervivencia media fue de 1,8 años. Los motivos de discontinuación principales fueron los acontecimientos adversos (35%), seguidos de falta de eficacia (23%) y la combinación de ambos (13%). Aunque la supervivencia es baja (comparada con las terapias biológicas), el hecho de que el 15% de los pacientes tenga una supervivencia al fármaco de 5 años sugiere que para casi uno de cada seis pacientes este tratamiento económico es una terapia efectiva y bien tolerada[20].
En cuanto a la supervivencia de MTX subcutáneo, Vidal et al. publicaron una serie de 103 pacientes en la que el 81% de los pacientes continuaban con el tratamiento a los 6 meses de haberlo iniciado. La mitad de ellos habían realizado MTX oral previamente al subcutáneo, de los cuales el 76% realizaron ‘switch’ por falta de eficacia y 22% por AA. Casi el 90% de los pacientes que habían cambiado a la vía subcutánea por falta de eficacia continuaban con el tratamiento a las 24 semanas y sólo 2 pacientes de los 12 que habían realizado ‘switch’ por AA, también lo discontinuaron por el mismo motivo[21].
Conclusiones
• La eficacia, seguridad y bajo coste del MTX hacen de él un fármaco eficiente con un posicionamiento de primera línea en el tratamiento de la psoriasis moderada-grave.
• Es importante la selección correcta de los candidatos ideales. Hay que descartar las contraindicaciones y valorar los factores de riesgo que pueden presentar los pacientes para minimizar la posible hepatotoxicidad.
• La vía subcutánea puede aportar ventajas en la tolerancia y en la eficacia (demostradas en otras enfermedades inflamatorias), además de una mayor seguridad cuando puedan existir riesgos de errores de posología.
• La vía subcutánea podría considerarse como terapia de primera línea en la psoriasis, aunque faltan ensayos clínicos que comparen la eficacia del MTX vía oral frente al subcutáneo en esta enfermedad.
Referencias
1. Edmunson WF, Guy WB. Treatment of psoriasis with folic acid antagonists. AMA Arch Derm. 1958 Aug;78(2):200–3.
2. Carrascosa JM, de la Cueva P, Ara M, Puig L, Bordas X, Carretero G, et al. Metotrexato en psoriasis moderada-grave: revisión de la literatura y recomenaciones del experto. Actas Dermosifiliogr. 2016 Apr;107(3):194–206.
3. Bianchi G, Caporali R, Todoerti M, Mattana P. Methotrexate and Rheumatoid Arthritis: Current Evidence Regarding Subcutaneous Versus Oral Routes of Administration. Adv Ther. 2016;33(3):369–78.
4. Mazaud C, Fardet L. Relative risk of and determinants for adverse events of methotrexate prescribed at a low dose: a systematic review and meta-analysis of randomized placebo-controlled trials. Br J Dermatol. 2017;177(4):978–86.
5. Hughes R, Harries M, Chalmers RJ, Kirby B. Folic acid supplementation and methotrexate therapy for psoriasis. J Am Acad Dermatol. 2006 Aug;55(2):366–7.
6. Wald JM, Klufas DM, Strober BE. The Use of Methotrexate, Alone or in Combination With Other Therapies, for the Treatment of Palmoplantar Psoriasis. J Drugs Dermatol. 2015 Aug;14(8):888–92.
7. Pasch MC. Nail Psoriasis: A Review of Treatment Options. Drugs. 2016;76(6):675–705.
8. Hoegler KM, John AM, Handler MZ, Schwartz RA. Generalized pustular psoriasis: a review and update on treatment. J Eur Acad Dermatology Venereol. 2018;32(10):1645–51.
9. Garcês S, Demengeot J, Benito-Garcia E. The immunogenicity of anti-TNF therapy in immune-mediated inflammatory diseases: a systematic review of the literature with a meta-analysis. Ann Rheum Dis. 2013 Dec;72(12):1947–55.
10. Carretero G, Puig L, Dehesa L, Carrascosa JM, Ribera M, Sánchez-Regaña M, et al. Metotrexato: guía de uso en psoriasis. Actas Dermosifiliogr. 2010 Sep 1;101(7):600–13.
11. Heydendael VMR, Spuls PI, Opmeer BC, de Borgie CAJM, Reitsma JB, Goldschmidt WFM, et al. Methotrexate versus cyclosporine in moderate-to-severe chronic plaque psoriasis. N Engl J Med. 2003 Aug 14;349(7):658–65.
12. Flytström I, Stenberg B, Svensson A, Bergbrant I-M. Methotrexate vs. ciclosporin in psoriasis: effectiveness, quality of life and safety. A randomized controlled trial. Br J Dermatol. 2008 Jan 6;158(1):116–21.
13. Saurat JH, Stingl G, Dubertret L, Papp K, Langley RG, Ortonne JP, et al. Efficacy and safety results from the randomized controlled comparative study of adalimumab vs. methotrexate vs. placebo in patients with psoriasis (CHAMPION). Br J Dermatol. 2008;158(3):558–66.
14. Barker J, Hoffmann M, Wozel G, Ortonne J-P, Zheng H, van Hoogstraten H, et al. Efficacy and safety of infliximab vs. methotrexate in patients with moderate-to-severe plaque psoriasis: results of an open-label, active-controlled, randomized trial (RESTORE1). Br J Dermatol. 2011 Nov;165(5):1109–17.
15. Reich K, Langley RG, Papp KA, Ortonne J-P, Unnebrink K, Kaul M, et al. A 52-Week Trial Comparing Briakinumab with Methotrexate in Patients with Psoriasis. N Engl J Med. 2011 Oct 27;365(17):1586–96.
16. West J, Ogston S, Foerster J. Safety and efficacy of methotrexate in psoriasis: A meta-analysis of published trials. PLoS One. 2016;11(5):1–14.
17. Hazlewood GS, Thorne JC, Pope JE, Lin D, Tin D, Boire G, et al. The comparative effectiveness of oral versus subcutaneous methotrexate for the treatment of early rheumatoid arthritis. Ann Rheum Dis. 2015;1–6.
18. Warren RB, Mrowietz U, von Kiedrowski R, Niesmann J, Wilsmann-Theis D, Ghoreschi K, et al. An intensified dosing schedule of subcutaneous methotrexate in patients with moderate to severe plaque-type psoriasis (METOP): a 52 week, multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017;389(10068):528–37.
19. Conway R, Carey JJ. Risk of liver disease in methotrexate treated patients. 2017;
20. Kirby B. Drug survival of methotrexate in psoriasis. Br J Dermatol. 2017 Aug;177(2):345–6.
21. Vidal D, Salleras M, Romaní J, Ribera M, Gallardo F, Viñas M, et al. Adherence of self-administered subcutaneous methotrexate in patients with chronic plaque-type psoriasis. J Eur Acad Dermatology Venereol. 2015 Oct;30(11):n/a-n/a.




