Guillermo González Castilla
Las micosis cutáneas son enfermedades producidas por hongos, muy frecuentes en climas cálidos con alta humedad, que pueden afectar tanto a la piel como a las uñas, el cuero cabelludo, la ingle y la región genital, causando la aparición de diversos síntomas de acuerdo a la zona donde se encuentra la infección fúngica.
Las infecciones micóticas más frecuentes en España son la pitiriasis versicolor, sobre todo en las zonas costeras, y el herpes circinado o tiña corporal, en las zonas de interior. La pitiriasis versicolor o tiña versicolor es una infección micótica superficial causada por diferentes especies del género Malassezzia que consiste en máculas hiper o hipopigmentas en el tronco, generalmente asintomáticas, y que frecuentemente es recidivante.
Según explica el Dr. Javier Gutiérrez Valls, dermatólogo, “el germen productor de la pitiriasis versicolor es el hongo Malassezzia furfur, que se desarrolla extraordinariamente en medios húmedos y calurosos, condiciones ambientales muy habituales en países costeros”. También es frecuente en personas que practican deportes acuáticos, como la natación o el submarinismo, o aquellos que producen mucha sudoración.

Dr. Javier Gutiérrez Valls
Fuente: Dr. Gutiérrez Valls
Las tiñas corporales son más frecuentes en zonas rurales porque su principal foco de contagio son los animales de pelo como perros, conejos, gatos y caballos, aunque no son exclusivos del campo.
Los tratamientos más habituales dependen de factores como el tipo de hongo, la extensión de las lesiones en el momento del diagnóstico, la edad de la persona afectada o la existencia de enfermedades asociadas, entre otros. “En general -explica el Dr. Gutiérrez Valls-, se puede administrar un antimicótico tópico, en forma de crema, o bien por vía oral, en cápsulas, si se quiere conseguir una eficacia más rápida”.
Hasta hace poco, el tratamiento antimicótico oral convencional consistía en 100 mg de itraconazol, un principio activo derivado de triazol, muy efectivo frente a una gran variedad de infecciones causadas por levaduras y hongos.
Una nueva formulación, Itragerm® 50 mg
El arsenal terapéutico para las micosis ha experimentado un enorme avance gracias al lanzamiento en España de Itragerm® 50 mg[1], comercializado por ISDIN: una nueva formulación de itraconazol de 50 mg que aporta una mayor biodisponibilidad, una mayor fiabilidad y más comodidad en cuanto a su administración, con la mitad de dosis que la formulación de 100 mg.
Itragerm®, formulado con tecnología SUBA®, no tiene sólo la ventaja de proporcionar la mitad de la dosis de itriconazol convencional, sino que sus cápsulas de 50 mg tienen una mayor absorción[2], con un 80-90% de biodisponibilidad respecto a un 50% del itraconazol convencional, además de aportar más fiabilidad, dado que existe una menor variabilidad inter e intrapaciente, y más comodidad, gracias al menor tamaño de las cápsulas.
La absorción de este nuevo fármaco no se ve afectada por el pH gástrico, por lo que los pacientes que estaban tomando antiácidos podrán seguir haciéndolo, y puede administrarse con o sin ingesta de alimentos. La tecnología patentada SUBA® de liberación de fármacos es la que hace posible que Itragerm® 50 mg presente una mejora en la biodisponibilidad de itraconazol, sustancia conocida por su baja solubilidad.
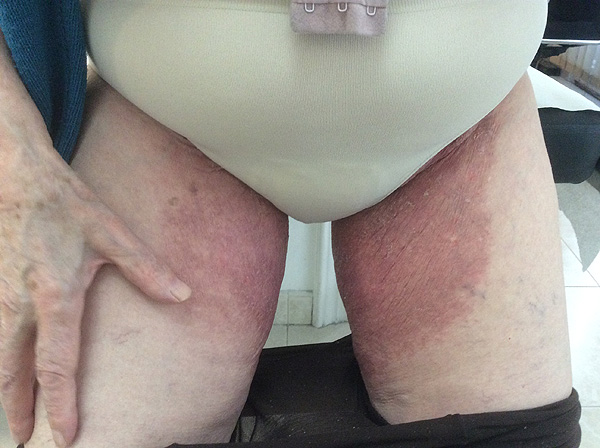
Un ejemplo de micosis
Fuente: Dr. Gutiérrez Valls
“Itragerm® está indicado para todos aquellos procesos cutáneos que sean producidos por hongos, sin exclusión, ya que aporta la gran virtud de que, con la mitad de dosis, se logra el mismo efecto que con el antiguo itraconazol”, destaca el Dr. Gutiérrez Valls. En concreto, se puede administrar (en los casos en los que el tratamiento externo no es efectivo o no es adecuado) para el tratamiento de infecciones fúngicas como dermatomicosis (tiña corporal, tiña inguinal, tiña del pie, tiña de la mano) y pitiriasis versicolor, así como de candidiasis y onicomicosis.
Ensayos clínicos: Nueva evidencia
En los últimos años, han aparecido estudios clínicos que refuerzan la eficacia de este nuevo fármaco. En 2017, se publicó un estudio[3] prospectivo sobre una cohorte de 57 pacientes, cuyo objetivo era evaluar los niveles séricos, la seguridad y la tolerabilidad de la nueva formulación de itraconazol 50 mg con tecnología SUBA utilizado como profilaxis antifúngica en pacientes sometidos a trasplante de células madre hematopoyéticas (TCMH) alogénico o en pacientes con neoplasia hematológica con riesgo intermedio o alto de infección fúngica invasora (IFI).
A 27 pacientes se les administró SUBA-itraconazol, mientras que a los otros 30 sujetos se les administró itraconazol líquido. Las concentraciones terapéuticas se alcanzaron significativamente más rápido en el grupo SUBA-itraconazol: mediana de 6 días (IC del 95%: 5-11) versus 14 días (IC del 95%: 12-21) en el grupo de itraconazol líquido (P <0,0001).
El estudio demostró que el uso de la formulación de SUBA-itraconazol se asocia con la obtención de manera más rápida de los niveles terapéuticos con una menor variabilidad entre pacientes en comparación con el itraconazol líquido convencional, utilizado como profilaxis de IFI en pacientes con TCMH alogénicos o con riesgo de IFI intermedio o alto.
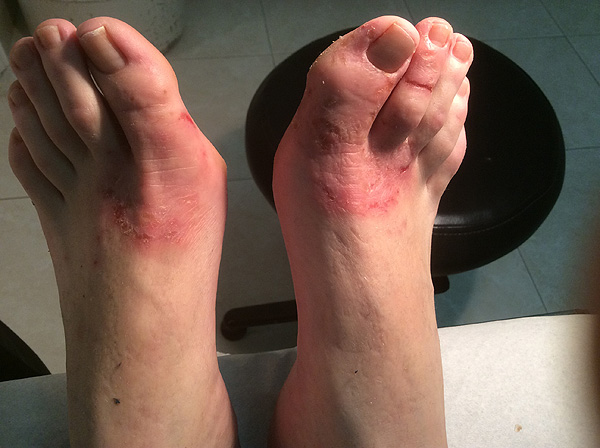
Un ejemplo de micosis
Fuente: Dr. Gutiérrez Valls
La nueva formulación supone también una mejora en la absorción del itraconazol. Itragerm® 50 mg se absorbe tanto en ayunas como con las comidas, de modo que la concentración plasmática del fármaco apenas varía dependiendo del momento en que el paciente tome la medicación. Esto pudo confirmarse en un estudio[4] en el que se evaluó la farmacocinética de SUBA-itraconazol de 50 mg en comparación con la formulación en cápsula de itraconazol convencional de 100 mg, tanto en condiciones de alimentación como en ayunas. Una sola cápsula de 50 mg de Itragerm® logró un grado similar de exposición a una sola cápsula de 100 mg de itraconazol, reduciendo el riesgo de alcanzar niveles de itraconazol poco seguros en aquellos pacientes que presentan una ratio de absorción elevado.
Según se recoge en un artículo publicado en la revista Ophthalmology Times[5], SUBA-itraconazol proporciona un beneficio espectacular en pacientes con síndrome del carcinoma nevoide de células basales (SCNCB) (síndrome de Gorlin), con un perfil de seguridad favorable.
Los datos provisionales de un estudio multicéntrico en Fase IIb, mencionados en este artículo, muestran que el impacto clínico de SUBA-Itraconazol estabiliza o reduce en gran medida la carga tumoral en pacientes con SCNCB, mientras que causa efectos secundarios mínimos y les permite evitar la cirugía desfiguradora. El mecanismo de acción de itraconazol como tratamiento para SCNCB implica la inhibición de la vía de Hedgehog (Hh). El descubrimiento de que itraconazol era un inhibidor de la vía de Hh fue una sorpresa, ya que se pensaba que la inhibición de la biosíntesis de esteroles fúngicos era su única actividad terapéutica.
Gracias a la formulación Itraconazole-SUBA, diseñada para mejorar la biodisponibilidad de medicamentos orales poco solubles, este fármaco ofrece niveles sanguíneos predecibles y consistentes con una dosis más baja que minimizaría los efectos secundarios y mejoraría la eficacia.

Autor/a de la imagen: Enric Arandes / www.farmacosalud.com
Fuente: E. Arandes / www.farmacosalud.com
Candidosis de decúbito tratado con itraconazole-SUBA
La candidosis por decúbito es una micosis superficial cutánea que afecta del 15 al 25% de los pacientes hospitalizados con movilidad restringida por más de 72 horas. Los factores de riesgo incluyen oclusión, maceración, inmunosupresión, diabetes, medicamentos, catéteres, entre otros. El tratamiento debe ser oportuno, dado que una diseminación sistémica puede ser mortal.
En un caso clínico reciente presentado en el XXII Congreso Ibero Latinoamericano de Dermatología (CILAD)[6], se trató a una paciente de 50 años, que padecía una micosis candidiásica, con itraconazol 50 mg/día con tecnología SUBA[7,8], durante 15 días. La paciente mostró una excelente respuesta al tratamiento, con una resolución completa de las lesiones y curación micológica.
Itraconazole-SUBA para la profilaxis antimicótica en pacientes con trasplante de pulmón
Por otro lado, la nueva formulación itraconazole-SUBA está asociada con una biodisponibilidad mejorada después del trasplante pulmonar. La utilidad de itraconazol de 100 mg para la profilaxis antimicótica en pacientes con trasplante de pulmón se ve obstaculizada debido a la escasa biodisponibilidad oral.
La nueva formulación utiliza la tecnología de administración de medicamentos SUBA, que implica una dispersión sólida de itraconazol en el polímero, mejorando sustancialmente la solubilidad a un pH más alto. Gracias a ello, se ha podido demostrar, en un estudio retrospectivo[9] realizado sobre una cohorte de pacientes con trasplante de pulmón entre enero de 2013 y octubre de 2016, que esta formulación aumenta la probabilidad de alcanzar niveles terapéuticos satisfactorios en sangre (>500 mcg/L).
Para el Dr. Gutiérrez Valls, “la eficacia de este nuevo fármaco es óptima desde las primeras tomas, con lo que le transmite al paciente la satisfacción de que estamos en el camino de la curación. La nueva formulación supone un verdadero adelanto, “principalmente porque hacía años que no había ninguna novedad administrada por vía oral para el tratamiento de las micosis y porque, además, permite obtener una eficacia similar e incluso superior con las mismas dosis que se empleaban tiempo atrás”.
En definitiva, Itragerm® 50 mg, gracias a su tecnología SUBA de liberación mejorada, resuelve los inconvenientes que hasta ahora presentaba el itraconazol convencional y abre un nuevo escenario en el tratamiento en micosis cutáneas.

Fuente: ISDIN
Ver ficha técnica[1]
Referencias
1. Ficha técnica. Disponible en http://www.aemps.gob.es/cima/pdfs/es/ft/77459/FT_77459.pdf
2. Mudge S, Hayes D, Ellis D. Single-dose Phase 1 studies to evaluate the more predictable pharmacokinetics of SUBA®-itraconazole, a novel capsule formulation, relative to a conventional itraconazole capsule formulation (poster). Australian Society infectious Diseases, 26-29 March, Adelaide (Australia).
3. Lindsay J, Sandaradura I, Wong K, Arthur C, Stevenson W, Kerridge I, et al. Serum levels, safety and tolerability of new formulation Itraconazole-SUBA prophylaxis in patients with haematological malignancy or undergoing allogeneic stem cell transplantation. J Antimicrob Chemother. 2017 Dec 1;72(12):3414-3419.
4. Mudge S, Hayes D, Ellis D. Single-dose Phase 1 studies to evaluate the more predictable pharmacokinetics of SUBA®-itraconazole, a novel capsule formulation, relative to a conventional itraconazole capsule formulation (poster). Australian Society infectious Diseases, 26-29 March, Adelaide (Australia).
5. New pathways to cancer therapy. By Cheryl Guttman Krader. Reviewed by Frank E. O’Donnell Jr. Ophthalmology Times. June 15, 2017 Vol. 42, Nº 10.
6. Ramírez HL, Vega SD, Moreno CG, Arenas R. Micosis superficial. Caso de candidosis de decúbito tratado con itraconazol SUBA. XXII CILAD – Congreso Ibero Latinoamericano de Dermatología. 14-17 Nov. 2018. São Paulo, Brasil.
7. Romero P, Arenas R, Poletti E, Márquez F, Adame C, Zavala X, et al. Candidiasis de decúbito. Estudio clínico. Estudio clínico y micológico en 30 casos. Dermatología CMQ. 2099;7(3):164-170.
8. Galimberti R, González M, Flores V, Kowalczuk A. Candidiasis cutánea de decúbito. Med Cutan Ibero Lat AM. 1995;23(8):383-386.
9. Tse T, Hopkins P, Chambers D. A New Formulation of Itraconazole (Lozanoc®) Is Associated with Improved Bioavailability After Lung Transplantation. The Journal of Heart and Lung Transplantation. April 2017. 36 (4): S411.




