Dr. Joaquín Ernesto Hinojosa del Val
El concepto de enfermedad perianal (EPA) incluye las anomalías anorrectales (fisura, fístula o absceso, repliegues cutáneos y maceración perianal) presentes en los pacientes con enfermedad de Crohn (EC) de cualquier otra localización[1]. La incidencia de los problemas anales en la EC varía enormemente según las series publicadas (20-80%). En una revisión realizada en nuestro país que incluyó a 2.391 pacientes con diagnóstico de EC y con un tiempo de evolución de su enfermedad de 12 años, el 24% desarrolló fístulas perianales (la mitad de ellas complejas), asociadas con frecuencia a abscesos y estenosis anal[2]. Alrededor de un 9% de los pacientes diagnosticados de EC debutan con patología anal o perianal, e incluso ésta puede preceder el inicio de los síntomas intestinales en varios años. La mayoría de los enfermos con EC presenta alguna anomalía perianal que suele ser asintomática hasta en el 70% de los casos[3].
Manifestaciones clínicas
La EPA se manifiesta como erosiones superficiales anales, repliegues cutáneos, fisura, absceso, fístula o estenosis anal. La lesión anal más frecuente son los repliegues cutáneos. La segunda lesión anal por orden de frecuencia son las fístulas. Suelen ser lesiones poco sintomáticas o completamente asintomáticas, de localización atípica, y es frecuente la multiplicidad de las mismas[4].

Dr. Joaquín Ernesto Hinojosa del Val
Fuente: Hospital de Manises
Las fístulas, la segunda manifestación en orden de frecuencia después de los pliegues cutáneos, suelen ser crónicas e indoloras, salvo que exista pus a tensión por un absceso anal subyacente. La mayoría de las fístulas suelen ser bajas y simples, aunque hay una proporción relativamente alta de fístulas complejas, siendo frecuente que existan varios orificios fistulosos externos no sólo en la región perianal sino también en zonas más alejadas como los glúteos, muslos o genitales. En las mujeres son también frecuentes las fístulas anovaginales o rectovaginales, sobre todo si hay afectación rectal. Se ha visto en estudios poblacionales que la frecuencia acumulada de aparición de las fístulas aumenta con el tiempo de evolución de la enfermedad de Crohn[5].
Diagnóstico
1. Exploración física
La exploración de la región anal en la consulta es una práctica indispensable que va a marcar las exploraciones ulteriores y el manejo del paciente.
La exploración anorrectal bajo anestesia (EBA) realizada por un cirujano colorrectal se considera el estándar de oro para diagnosticar y clasificar las fístulas perianales[4]. Siempre que exista dolor no filiado, sospecha de sepsis o discordancia con otras pruebas de imagen es necesario recurrir a la EBA por un cirujano experimentado[5].
2. Técnicas de imagen
De las diferentes técnicas de imagen disponibles, la resonancia de pelvis menor (RM) es la técnica de imagen más precisa para evaluar la enfermedad perianal, y debe ser la primera técnica a realizar para su caracterización[6]. Es fundamentalmente útil cuando se sospechan fístulas o colecciones en planos pélvicos altos. Se trata de una técnica no invasiva, no dolorosa para el enfermo, y que no lo somete a radiaciones ionizantes. Es capaz de explorar los planos altos de la pelvis y puede diferenciar entre actividad y fibrosis. La RM pélvica se usa frecuentemente para evaluar la respuesta de la EPA al tratamiento médico. El índice radiológico más comúnmente utilizado es el índice de Van Assche[7].
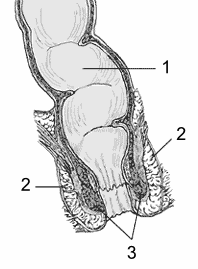
Diagrama del ano y el recto. 1: recto 2: esfínter exterior 3: esfínter interior.
Autor/a de la imagen: U.S. Government National Institutes of Health
http://digestive.niddk.nih.gov/ddiseases/pubs/fecalincontinence/images/anorectum.gif
Fuente: Wikipedia
En la actualidad la tomografía axial computerizada (TC) tiene un papel muy limitado en la evaluación de la enfermedad perianal [6]. La ecografía endoanal (EEA) es una alternativa útil a la RM para diagnosticar las fístulas perianales permitiendo una visualización detallada del complejo esfinteriano anal. La rentabilidad de esta exploración puede estar limitada por la presencia de una estenosis anal[6]. La EBA, la EEA y la RM tienen una precisión similar en el estudio de las fístulas anales. La combinación de más de una de esas técnicas puede constituir el enfoque más adecuado para pacientes con enfermedad de Crohn con fístula compleja o absceso[8].
La valoración de la actividad rectal mediante endoscopia es esencial para el posterior manejo de la EPA[4,5]. La presencia de proctitis es un factor predictivo de no curación de las fístulas y de altas tasas de proctectomía. En la práctica clínica la evaluación de las fístulas perianales combina la exploración física de la región anal y perianal, la realización de una endoscopia para evaluar recto y la RM pélvica para la descripción anatómica y de la actividad inflamatoria[4,8].
3. Clasificación
Dada la gran heterogeneidad de lesiones en la enfermedad de Crohn perianal, es aconsejable utilizar algún tipo de escala o clasificación que permita establecer de forma objetiva las lesiones que presenta el paciente, así como la evolución de las mismas y su respuesta al tratamiento. Una de las primeras clasificaciones fue la de Hugues-Cardiff[4,9], muy conocida por los cirujanos, pero no está validada, siendo difícil de aplicar en la práctica de rutina y siendo de interés limitado en términos de manejo del paciente. La revisión técnica de la American Gastroenterological Association (AGA)[10] publicada en 2003 propuso una clasificación más simple que ha sido ampliamente adoptada por su sencillez, identificando las fístulas como ‘simples’ (bajas, con orificio fistuloso externo único) o ‘complejas’ (alta, puede tener ≥1 orificio fistuloso, asociada a absceso perianal, fístula rectovaginal, estenosis anorrectal o enfermedad rectal activa). En la actualidad, el sistema más preciso anatómicamente y más útil clínicamente lo constituye la clasificación de Parks[11], que utiliza el esfínter anal interno y externo como referencia y considera cinco tipos de fístula: superficial, interesfinteriana, transesfinteriana, supraesfinteriana y extraesfinteriana. En resumen, no hay ninguna ideal pues a las anatómicas les falta el aspecto de la funcionalidad y viceversa. Por su sencillez y facilidad de uso, la de Parks y la de la AGA son las más ampliamente utilizadas.
4. Valoración de la gravedad
Establecida la clasificación de las lesiones, y previamente a la decisión sobre la estrategia terapéutica a seguir, hay que realizar una valoración de la gravedad de las mismas. De los diferentes índices de gravedad, PDAI (Perianal Disease Activity Index), índice de Present-Rutgeerts y el Anal Disease Activity Index (AGA), disponibles actualmente, el PDAI es el validado y debería ser el utilizado para evaluar la gravedad[12]. Este índice comprende cinco categorías, dos relacionadas con la calidad de vida (dolor/restricción de actividades y restricción de la actividad sexual) y tres con la gravedad de la enfermedad perianal (supuración, tipo de fístula perianal y grado de induración) Sin embargo, la aproximación más adecuada para evaluar la gravedad no debe limitarse al uso de índices clínicos, sino que precisa ser completada con técnica de imagen (utilizando el índice de van Assche).
Tratamiento médico
Puesto que las fístulas son, después de los repliegues cutáneos, las lesiones más frecuentes en el contexto de la EPA, y por las implicaciones tan importantes que tienen sobre la calidad de vida de los pacientes, vamos a referirnos al tratamiento de las mismas. Las fístulas pueden originarse en una fisura penetrante o en una glándula anal infectada y es frecuente que existan varios orificios fistulosos externos no sólo en la región perianal, sino en zonas más alejadas, como los glúteos, los muslos o los genitales. Estas fístulas son crónicas e indoloras, salvo que exista pus a tensión, y la mayor parte suelen ser bajas y simples, aunque hay una proporción relativamente alta de fístulas complejas[4,5]. Lo habitual es que exuden o rezumen a la presión una pequeña cantidad de pus. Siempre que se pueda, sobre todo si se trata de una fístula compleja, se procederá a la colocación de un sedal laxo entre el orificio externo e interno con la finalidad de asegurar un drenaje adecuado y disminuir la probabilidad de absceso y la aparición de nuevos trayectos fistulosos[9]. Como se ha referido anteriormente, la clasificación de Parks y la de la AGA, fáciles de usar, son más que suficientes para hacer una aproximación adecuada al tratamiento que precisa el paciente. En la TABLA 1 se indican las diferentes opciones de tratamiento médico evaluadas para el tratamiento de las fístulas perianales en pacientes con enfermedad de Crohn. Se indica, asimismo, su eficacia y si están apoyados en resultados de ensayos clínicos controlados.
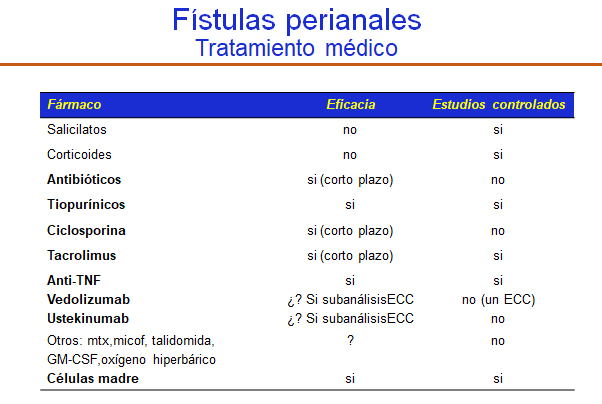
Tabla 1
Elaboración y fuente: Dr. Hinojosa
Los antibióticos, ciprofloxacino y metronidazol, se pautarán siempre al diagnóstico de la EPA o de un nuevo brote, como puente a un drenaje quirúrgico, si procede, y tratamiento médico inmunomodulador o biológico[13]. Los antibióticos sólo serán usados como tratamiento coadyuvante de las fístulas. En este escenario, combinados con anti-TNF (infliximab o adalimumab), mejoran la eficacia de la monoterapia con el fármaco biológico.
Las tiopurinas, azatioprina y su metabolito mercaptopurina, parecen mejorar los síntomas de la EPA a largo plazo y reducir el número de intervenciones perianales. Su uso se recomienda desde el principio, conjuntamente con antibióticos, en las fístulas perianales complejas y en las simples con proctitis asociada, aunque no parecen conllevar cierre de las fístulas perianales[14].
Los fármacos anti-TNF han revolucionado el tratamiento de la EPA[15]. Una revisión sistemática y un metaanálisis han puesto de relieve que son eficaces en el tratamiento de las fístulas. Infliximab (IFX) y adalimumab (ADA) han demostrado su utilidad en la inducción y mantenimiento de la remisión de la EPA, mientras que los datos sobre el certolizumab son escasos y no concluyentes[4,5,16-18]. Actualmente, los fármacos anti-TNF son el tratamiento médico de primera línea, tanto por los resultados obtenidos en ensayos clínicos como por los expuestos en estudios de práctica clínica.
El papel de los nuevos fármacos biológicos con un mecanismo de acción diferente, como ustekinumab y vedolizumab, en el tratamiento de la EPA está por definir [17,18]. Los resultados en práctica clínica sugieren que pueden ser útiles como tratamiento de rescate en determinados casos (fístulas complejas con fracaso a tratamiento combinado anti-TNF e inmunomoduladores con proctitis asociada).
Autor/a: qimono
Fuente: Pixabay / Creative Commons
Otros tratamientos médicos como micofenolato, talidomida, metotrexate y ciclosporina no disponen de suficiente evidencia como para recomendarlos en práctica clínica[5,13]. Aunque hay datos controvertidos respecto al papel del tacrolimus[19] en el tratamiento de las fístulas perianales, un ensayo clínico controlado sugiere que podría usarse en determinados casos refractarios a tratamientos de primera línea para inducir la remisión. Aunque el O2 hiperbárico puede ser útil como última opción en pacientes con EC perianal crónica refractaria a otros tratamientos o como complemento de la cirugía, deben de realizarse estudios controlados antes de recomendar esta opción de tratamiento en el manejo de la EPA[13].
La administración de células madre mesenquimales autólogas o heterólogas (CMM) en las fístulas perianales de la EC es una terapia que ha estado desarrollándose desde principios de los años 2000, cuando se publicaron los primeros estudios con células madre obtenidas de médula ósea y de tejido adiposo en las fístulas perianales de la EC, obteniendo resultados muy prometedores[20]. El primer ensayo clínico con la potencia adecuada, aleatorizado y controlado con placebo, se publicó en el año 2016. El tratamiento fue un éxito en el 50% de los pacientes tratados con CMM, frente al 34% en el grupo placebo. El beneficio del tratamiento se mantuvo en la semana 52 en el 56,3% de pacientes del grupo de CMM, frente al 38,6% de los pacientes en el grupo placebo[21]. Por tanto, el uso de terapias celulares en las fístulas perianales de la EC se perfila como un tratamiento atractivo y muy prometedor.
Tratamiento quirúrgico

Autor/a de la imagen: E. Arandes / www.farmacosalud.com
Fuente: Gentileza del Hospital Sagrat Cor de Barcelona
Siempre hay que tener presente que el tratamiento quirúrgico de las fístulas debe asociarse al tratamiento médico de la enfermedad perianal y luminal. Ambos tratamientos variarán en función de la complejidad de las fístulas, el curso evolutivo y la actividad del tramo intestinal afectado, especialmente el recto (descartar siempre la presencia de proctitis). Por otra parte, antes de realizar cualquier técnica quirúrgica sobre la fístula es requisito indispensable drenar los focos sépticos y colocar sedales, excepto en casos en que la fístula no sea productiva[4,5,22].
En general, en las fístulas simples lo más aconsejable es la fistulotomía si no hay proctitis y el sedal laxo si esta última está presente[23,24]. En las fístulas complejas, si no hay proctitis asociada, el colgajo de avance es el procedimiento más adecuado, mientras que si hay proctitis se recomienda la colocación de sedal laxo[23,24]. En el caso de fístulas rectovaginales, la presencia de proctitis, la altura de la fístula y la sintomatología van a influir en la decisión quirúrgica, pudiéndose utilizar desde un colgajo de avance mucoso en ausencia de proctitis, hasta un sedal o derivación con estoma en presencia de actividad rectal[23].
Se han descrito un gran número diferentes procedimientos quirúrgicos (los adhesivos tisulares o sellantes de fibrina, la colocación de un tapón de colágeno porcino, ablación del trayecto fistuloso con láser, inyección local de infliximab / adalimumab), pero ninguno tiene la suficiente evidencia como para hacer fuertes recomendaciones[4,13,24].
Bibliografía
1. Alós R, Maroto N. Tratamiento de la enfermedad perianal. En:Hinojosa J, Nos P. ed. Manual práctico . Conductas de actuación en la enfermedad inflamatoria intestinal. Madrid: Argon; 2014.
2. Chaparro M, Burgueño P, Vera I, Bermejo F, Marín-Jiménez I, Yela C et al. Epidemiological study of perianal fistulas in patients with Crohn´s disease. J Crohns Colitis 2012; 6 (Suppl 1): P235
3. Schwartz DA, Loftus EV, Jr., Tremaine WJ, Panaccione R, Harmsen WS, Zinsmeister AR, et al. The natural history of fistulizing Crohn's disease in Olmsted County, Minnesota. Gastroenterology. 2002;122(4):875-80.
4. Panés J, Rimola J. Perianal fistulizing Crohn´s disease: pathogenesis , diagnosis and therapy. Nat Rev Gastroenterol Hepatol 2017,Nov 14(11): 652-664
5. Gionchetti P, Dignass A, Danese S, Magro FJ, Rogler G, Lakatos PL et al. 3rd European evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 2: Surgical Management and Special Situations. J Crohns Colitis. 2017; 11 (2): 135–149
6. Panes J, Bouhnik W, Reinisch W, Stoker S.A, Taylor D.C, Baugmart S, Danese S, Halligan B, Marincek C, Matos L et al. Imaging techiques for assement of inflammatory bowel disease : Joint ECCO and ESGAR evidence-based consensus. J Crohns Colitis 2013: 7:556-85.
7. Van Assche G, Vanbeckevoort D, Bielen D, Coremans G, Aerden I, Norman M et al. Magnetic resonance imaging of the effects of infliximab on perianal fistulizing Crohn´s disease . Am J Gastroenterol 2003; 98:332-9.
8. Schwartz D.A, Wiersema M.J, Dudiak K.M, Fletcher J.G, Clain J.E, Tremaine WJ et al. A comparision of endoscopic ultrasound , magnetic resonance imaging, and exam under anesthesia for evaluation of Crohn´s perianal fistulas. Gastroenterology 2001;121:1064-72.
9. Gecse K, Bemelan W, Kamm M et al. A global consensus on the classification, diagnosis and multidisciplinary treatment of perianal fistulizing. Gut 2014;63:1381-92.
10. Sandborn WJ, Fazio VW, Feagan BG, Hanauer SB. American Gastroenterological Association Clinical Practice Committee. AGA technical review on perianal Crohn’s disease. Gastroenterology. 2003;125: 1508–1530
11. Parks AG, Gordon PH, Hardcastle JD. A classification of fistula in ano. Br J Surg. 1976; 63 (1): 1–12.
12. Irvine EJ. Usual therapy improves perianal Crohn’s disease as measured by a new disease activity index. 1995. J Clin Gastroenterol; 20 (1): 27–32
13. Bermejo F, Guerra I, Algaba A, López-Sanromán A. Pharmacological Approach to the Management of Crohn's Disease Patients with Perianal Disease. Drugs. 2018 Jan;78(1):1-18Crohn´s disease
14. Chande N, Tsoulis DJ, MacDonald JK. Azathioprine and 6-mercaptopurine for induction of remission in Crohn’s disease. Cochrane Database Syst Rev. 2013 Apr 30;(4):CD000545.
15. Present DH, Rutgeerts P, Targan S, Hanauer SB, Mayer L, van Hogezand RA, Podolsky DK, Sands BE, Braakman T, DeWoody KL, Schaible TF, van Deventer SJ. Infliximab for the treatment of fistulas in patients with Crohn’s disease. N Engl J Med 1999; 340: 1398-1405
16. Hinojosa J, Gomollón F, García S, Bastida G, Cabriada JL, Saro C, Ceballos D, Peñate M, Gassull MA; Spanish Scientific Group on Crohn's Disease and Ulcerative Colitis. Efficacy and safety of short-term adalimumab treatment in patients with active Crohn's disease who lost response or showed intolerance to infliximab: a prospective, open-label, multicentre trial. Aliment Pharmacol Ther. 2007 Feb 15;25(4):409-18.
17. Sands B, Gasink C, Jacobstein D, Gao L, Johanns J, Colombel JF, de Villiers WJ, Sandborn WJ. Fistula healing in pivotal studies of ustekinumab in Crohn’s disease. Gastroenterology. 2017;152(5):S185.92
18. Feagan BG, Schwartz D, Danese S, Rubin DT, Lissoos TW, Xu J, Lasch K. Efficacy of Vedolizumab in Fistulising Crohn's Disease: Exploratory Analyses of Data from GEMINI 2. Journal of Crohn's and Colitis, 2018, 621–626
19. McSharry K1, Dalzell AM, Leiper K, El-Matary W. Systematic review: the role of tacrolimus in the management of Crohn's disease. Aliment Pharmacol Ther. 2011 Dec;34(11-12):1282-94.
20. Garcia-Olmo D, García-Arranz M, Herreros D, Pascual I, Peiro C, rodríguez-Montes JA. A phase I clinical trial of the treatment of Crohn’s fistula by adipose mesenchymal stem cell transplantation. Dis Colon Rectum. 2005; 48: 1416–23
21. Panés J, García-Olmo D, Van Assche G, Colombel JF, Reinisch W, Baumgart DC, et al. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet 2016;388: 1281–90.
22. Gecse KB, Sebastian S, Hertogh Gd, Yassin NA, Kotze PG, Reinisch W et al. Results of the Fifth Scientific Workshop of the ECCO [II]: Clinical Aspects of Perianal Fistulising Crohn's Disease-the Unmet Needs. J Crohns Colitis. 2016; 10(7): 758-765
23. Lee MJ, Heywood N, Sagar PM, Brown SR, Fearnhead NS. Surgical management of fistulating perianal Crohn's disease: a UK survey. Colorectal Dis. 2017; 19(3): 266-273
24. Lee MJ, Heywood N, Sagar PM, Brown SR, Fearnhead NS; ACPGBI Perianal Crohn's Disease Group. Association of Coloproctology of Great Britain and Ireland consensus exercise on surgical management of fistulating perianal Crohn's disease. Colorectal Dis. 2017; 19(5):418-429





