Redacción Farmacosalud.com
Chicago (Estados Unidos) ha acogido a principios de este mes de junio el Congreso de la Sociedad Americana de Oncología Clínica (ASCO, por sus siglas en inglés). Estos son algunos de los avances presentados en la cita congresual:
Moxetumomab pasudotox en tricoleucemia
AstraZeneca y MedImmune presentan los resultados del ensayo clínico Fase III (‘1053’) que evaluaba moxetumomab pasudotox en 80 pacientes con tricoleucemia recidivante o resistente que se habían sometido a al menos dos líneas de terapia previas[1]. Moxetumomab pasudotox, una inmunotoxina recombinante anti-CD22 en fase de investigación, mostró una tasa de respuesta objetiva (TRO) del 75%, una tasa de respuesta completa (TRC) del 41% y una TRC duradera del 30% (criterio de valoración principal). La mayoría de los pacientes con una respuesta completa consiguieron además que dicha respuesta fuera duradera (73%; 24/33) y alcanzaron un estado negativo de enfermedad mínima residual (EMR) (82%; 27/33).
Robert J. Kreitman, MD, investigador senior, responsable de la sección de inmunoterapia clínica del Laboratorio de Biología Molecular del Centro para la Investigación del Cáncer del Instituto Nacional del Cáncer de EE.UU., subraya que “la tricoleucemia es un tipo de cáncer hematológico raro y crónico y para el que no existe un tratamiento estándar establecido para los pacientes con enfermedad recidivante o resistente que se hayan sometido a una terapia previa con análogos de purinas. Con muy pocos tratamientos disponibles, sigue existiendo una importante necesidad médica no cubierta para los pacientes con enfermedad recidivante o resistente. Las tasas de respuesta observadas en este ensayo, y la eliminación de las células cancerosas residuales que provocan la recaída en algunos pacientes, ponen de manifiesto el posible impacto que este nuevo potencial tratamiento podría tener en los pacientes y en el manejo de esta enfermedad”.

(Imagen modificada) Autor/a del original: healthinfoguru
Fuente: morguefile.com
Atezolizumab en CPNM y cáncer de vejiga
Por su parte, la compañía Roche presenta resultados positivos del estudio fase III IMpower150 con Atezolizumab (Tecentriq®) y Bevacizumab (Avastin®) más carboplatino y paclitaxel (quimioterapia) para el tratamiento inicial (primera línea) en pacientes con cáncer de pulmón no microcítico (CPNM) que no han recibido quimioterapia. Este análisis intermedio mostró que dicha combinación más la quimioterapia logró incrementar la supervivencia en comparación con Bevacizumab más carboplatino y paclitaxel (media de supervivencia global [SG] = 19,2 frente a 14,7 meses; Hazard Ratio [HR] = 0,78; IC del 95%: 0,64-0,96; p = 0.016) en el grupo de pacientes ‘wild-type’ con intención de tratar (IT- WT), un objetivo co-primario del estudio[2].
Se observó un beneficio en la SG en todos los subgrupos seleccionados previamente con biomarcadores, que incluían pacientes con mutaciones EGFR y ALK-positivo que habían recibido una terapia dirigida, y aquellos con niveles variables de expresión de PD-L1 o con expresión negativa de PD-L1. Los pacientes con metástasis hepáticas tratados con la combinación con Tecentriq® también alcanzaron este beneficio en la supervivencia. El perfil de seguridad de la combinación de Tecentriq® y Avastin® más carboplatino y paclitaxel coincide con el ya observado en estudios previos con los fármacos por separado, y no se identificaron nuevos eventos con dicha combinación.
La inmunoterapia Tecentriq® (atezolizumab), además, ha obtenido resultados positivos en el tratamiento del cáncer urotelial tanto en fases avanzadas (estudio IMvigor210) como en etapas más tempranas con enfermedad localizada (estudio Abacus). El estudio IMvigor 210 ha confirmado que los beneficios de la inmunoterapia se mantienen en el tiempo en el tratamiento del cáncer de vejiga localmente avanzado o metastásico, un tipo histológico que representa el 90% de los tumores urotetiales, con un pronóstico ominoso tras fracaso de la quimioterapia y que durante varias décadas no ha incorporado avances destacables. Este estudio clínico incluyó dos cohortes de pacientes: La cohorte 1, con 119 pacientes y una mediana de seguimiento de 29 meses, que no habían recibido tratamiento previo y no eran candidatos a una quimioterapia basada en cisplatino; y la cohorte 2 con 310 pacientes que habían progresado tras un tratamiento con platino. Los pacientes de la primera cohorte obtuvieron una tasa de respuesta objetiva (reducción del tamaño del tumor) del 24% y los de la segunda lograron una respuesta del 16%.
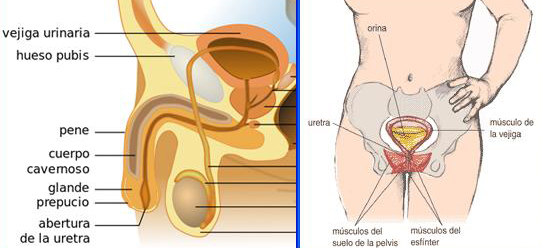
Imagen de la izquierda: La vejiga y el aparato reproductor masculino
Autor/a de la imagen: Male_anatomy.png: alt.sex FAQ Male_anatomy_all.svg: Tsaitgaist (talk) Spanish version: Angelito7 (talk) – Male_anatomy_all.svg
Fuente: Wikipedia
Imagen de la derecha: Componentes del sistema de control de la vejiga ilustrado en la mujer
Fuente: http://kidney.niddk.nih.gov/spanish/pubs/medicine/index.htm / User: Dodo
Difusión: Wikipedia
En cuanto al uso de inmunoterapia en solitario para cáncer de vejiga en fases iniciales antes de la cirugía (neoadyuvancia), el estudio ABACUS ha evaluado el potencial de atezolizumab en 68 pacientes con cáncer de vejiga localizado candidatos a cirugía y que se consideraron no aptos para recibir quimioterapia previa a la cirugía. El estudio mostró una tasa de respuesta patológica completa (desaparición del tumor) del 29% en la población global del estudio. La fatiga de grado 3-4, que fue el efecto adverso relacionado con el fármaco más frecuentes, se dio en un 4% de los pacientes.
Atezolizumab + quimioterapia en cáncer de pulmón escamoso avanzado
Asimismo, se han presentado los resultados del estudio fase III IMpower131, en que la inmunoterapia Tecentriq® (Atezolizumab) más quimioterapia (carboplatino y Abraxane®) redujeron el riesgo de progresión de la enfermedad o muerte (Supervivencia Libre de Progresión, SLP) en un 29% comparado con quimioterapia sola como tratamiento inicial de pacientes con cáncer de pulmón no microcítico escamoso en fase avanzada (mediana de SLP=6.3 vs. 5.6 meses; hazard ratio [HR]=0.71, 95% CI: 0.60, 0.85, p=0.0001)[3].
La tasa de SLP a los doce meses fue el doble para aquellos pacientes que recibieron la combinación con Atezolizumab (24,7%) comparado con aquellos que recibieron solo quimioterapia (12%). No se observó un beneficio estadísticamente significativo de Supervivencia Global (SG) y el estudio seguirá llevándose a cabo tal como estaba previsto. El perfil de seguridad de la combinación de Tecentriq® más quimioterapia fue consistente con los perfiles de seguridad de cada uno de los medicamentos cuando se utilizan individualmente, y no se han identificado nuevos eventos con la combinación de ambos medicamentos.
Fuente: Archivo
Alectinib en cáncer de pulmón CPNM avanzado ALK positivo
Roche, además, comunica que los datos de seguimiento del estudio fase III ALEX han mostrado que la terapia con Alectinib (Alecensa®) como tratamiento inicial redujo significativamente el riesgo de progresión de enfermedad o muerte (Supervivencia Libre de Progresión, SLP) en un 57% (Hazard Ratio [HR] = 0,43; IC del 95%: 0,32-0,58) en comparación con crizotinib, tras dos años de seguimiento en pacientes con cáncer de pulmón no microcítico (CPNM) avanzado ALK positivo, según lo evaluado por el investigador[4].
La media de SLP para los pacientes que recibieron Alectinib fue más del triple frente a los que habían sido tratados con crizotinib (34.8 meses [IC 95%: 17.7 meses-NE) versus 10.9 meses [IC 95%: 9.1-12.9 meses)], respectivamente, según lo evaluado por el investigador. El perfil de seguridad para Alectinb fue consistente con el ya observado en estudios previos.
Pexidartinib en tumor tenosinovial de células gigantes
Por otro lado, Daiichi Sankyo comunica que el estudio ENLIVEN de fase 3 mostró una tasa de respuesta global (ORR, por sus siglas en inglés) estadísticamente significativa del 39 por ciento en la semana 25 basada en la revisión central de las exploraciones de imagen por resonancia magnética usando los Criterios de Evaluación de la Respuesta en Tumores Sólidos, versión 1.1 (el objetivo primario) para los pacientes tratados con pexidartinib oral en comparación con ninguna respuesta tumoral entre los pacientes que recibieron placebo (P<0.0001). Los pacientes inscritos en el ensayo fueron aquellos con tumor tenosinovial de células gigantes (TGCT, por sus siglas en inglés) para los cuales la cirugía estaría asociada con un potencial empeoramiento de la función o morbilidad severa. Después de una mediana de seis meses de seguimiento (17 meses, el seguimiento más largo), ninguno de los pacientes en el estudio ENLIVEN había progresado.
"Las opciones actuales de tratamiento para la TGCT se limitan en gran medida a la cirugía para extirpar la mayor parte posible del tumor. A pesar de que la intervención quirúrgica sea óptima, la tasa de recurrencia de la TGCT difusa es alta y la enfermedad podría avanzar hasta el punto en que la cirugía ya no es una opción", explica William D. Tap, MD, investigador principal del estudio y jefe del Servicio de Oncología Médica del Sarcoma en el Memorial Sloan Kettering Cancer Center en la ciudad de Nueva York. "El pexidartinib puede ofrecer una opción de tratamiento relevante para pacientes con TGCT, que está asociado con morbilidad severa o limitaciones funcionales, y para los cuales no se recomienda cirugía", agrega.
Autor/a de la imagen: E. Arandes / www.farmacosalud.com
Fuente: Gentileza del Hospital Sagrat Cor de Barcelona (ARCHIVO)
DS-8201 en cáncer de mama, gástrico y otros cánceres sólidos HER2
La misma compañía anuncia los datos de seguridad y eficacia del estudio en fase 1 a largo plazo para DS-8201, un medicamento inmuno-conjugado dirigido al receptor HER2 (ADC, por sus siglas en inglés) en investigación, en 241 pacientes muy pretratados con cáncer de mama, gástrico y otros cánceres sólidos que expresan HER2 y que recibieron dosis de expansión recomendadas de 5,4 mg/kg o 6,4 mg/kg. Los resultados preliminares actualizados en un análisis de subgrupos de 34 pacientes con cáncer de mama metastásico con baja expresión HER2 altamente pretratados (definido como tumores IHC 2+/ISH- o IHC 1+/ISH-) mostraron que DS-8201 demostró una tasa de respuesta global confirmada de 50 por ciento (17/34 pacientes) y una tasa de control de la enfermedad de 85,3 por ciento (29/34 pacientes). Las estimaciones preliminares de la duración media de la respuesta han alcanzado los 11 meses (IC del 95%: NA) y la mediana de la supervivencia libre de progresión ha alcanzado los 12,9 meses (IC del 95%: NA).
Por otra parte, se han presentado resultados preliminares actualizados de dos análisis de subgrupos adicionales además de los dos subgrupos de tumor mamario. En el subgrupo de 44 pacientes con cáncer gástrico o adenocarcinoma de la unión gastroesofágica que expresan HER2 (definido como cáncer gástrico o adenocarcinoma de la unión gastroesofágica IHC 3+ o IHC 2+/ISH-) previamente tratados con trastuzumab y quimioterapia, DS-8201 demostró una tasa de respuesta global confirmada de 43,2 por ciento (19/44 pacientes) y una tasa de control de la enfermedad de 79,5 por ciento (35/44 pacientes). Las estimaciones preliminares de la mediana de duración de la respuesta han alcanzado los siete meses (IC del 95%: NA) y la mediana de supervivencia libre de progresión ha alcanzado los 5,6 meses (IC del 95%: 3,0; 8,3).
En un análisis preliminar actualizado en 31 pacientes evaluables con otros tumores sólidos que expresan HER2, como el cáncer colorrectal y el cáncer de pulmón de células no pequeñas, DS-8201 demostró una tasa de respuesta global confirmada de 38,7 por ciento (12/31 pacientes) y una tasa de control de la enfermedad de 83,9 por ciento (26/31 pacientes). Las estimaciones preliminares de la mediana de la duración de la respuesta han alcanzado los 12,9 meses (IC del 95%: 2,8; 12,9) y la mediana de la supervivencia libre de progresión ha alcanzado los 12,1 meses (IC del 95%: 2,7; 14,1).

Acción en un laboratorio
Fuente: www.farmacosalud.com / IMAGEN DE ARCHIVO
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
U3-1402 en pacientes con cáncer de mama HER3
Daiichi Sankyo, en paralelo, informa sobre datos preliminares de un estudio en curso de fase 1/2 con U3-1402 en fase de investigación en pacientes con cáncer de mama metastásico altamente pretratadas con HER3-positivo. Los resultados preliminares en 32 pacientes evaluables de eficacia demostraron que U3-1402 demostró una tasa de respuesta global confirmada del 47% (15/32 pacientes) y una tasa de control de la enfermedad del 94% (30/32 pacientes).
"Hay una necesidad clínica de tratamientos adicionales para el cáncer de mama metastásico, especialmente para los tumores que expresan HER3, que se asocia con un mal pronóstico y para los que no hay terapias específicas disponibles en la actualidad", comenta Takahiro Kogawa, MD, PhD, National Cancer Center Hospital East en Japón, e investigador del estudio. "Estos resultados preliminares sugieren que el U3-1402 podría ser un nuevo enfoque potencial de tratamiento para los tumores de mama metastásicos que expresan HER3, y el estudio avanzará para determinar el régimen de dosis más adecuado para una evaluación clínica posterior", añade este especialista.
Lurbinectedina en cáncer de pulmón microcítico recurrente
Y PharmaMar (MSE:PHM) aporta nuevos datos sobre la cohorte de pacientes con cáncer de pulmón microcítico que forma parte del ensayo basket de fase II con lurbinectedina como agente único. El ensayo multicéntrico de fase II estudia la seguridad y eficacia de lurbinectedina en diferentes tumores sólidos, entre ellos cáncer de pulmón microcítico recurrente, tras haber recibido un tratamiento previo de quimioterapia. Tras observarse cinco respuestas en los primeros 15 pacientes en esta indicación, se amplió el estudio a 100. El objetivo primario del estudio es medir la tasa global de respuesta, evaluándose otros objetivos secundarios como la duración de respuesta, la supervivencia libre de progresión, la supervivencia global y el perfil de seguridad.
Se han presentado los resultados de 61 pacientes analizados de los 72 pacientes reclutados hasta el momento, en el abstract “Efficacy and safety of lurbinectedin (PM1183, Zepsyre®) in small-cell lung cancer (SCLC): results from a phase 2 study” (abstract #8570). La tasa global de respuesta fue del 39.3%. También se registró una mediana de duración de respuesta de 6,2 meses, y de una mediana de supervivencia global de 12 meses. En cuanto al perfil de seguridad, el efecto adverso más común fue la mielosupresión: el 39% de los pacientes registraron neutropenia en grados 3/4, y solo el 9% neutropenia febril.
Referencias
1. Kreitman, R, Dearden C, Zinzani P, Delgado J et al. Moxetumomab Pasudotox in Heavily Pretreated Patients with Relapsed/Refractory Hairy Cell Leukemia: Results of a Pivotal International Study. Oral presentation at: American Society of Clinical Oncology 2018; June 2018; Chicago, IL. Abstract #7004
2. Socinski M et al. Overall Survival (OS) analysis of IMpower150, a randomized Ph 3 study of atezolizumab (atezo) + chemotherapy (chemo) ± bevacizumab (bev) vs chemo + bev in 1L non squamous (NSQ) NSCLC. To be presented at: ASCO Annual Meeting; 2018 Jun 1-5; Chicago, IL, USA. Abstract #9002
3. Jotte R et al. IMpower131: primary PFS and safety analysis of a randomized phase III study of atezolizumab + carboplatin + paclitaxel or nab-paclitaxel vs carboplatin + nab-paclitaxel as 1L therapy in advanced squamous NSCLC. Presented at: ASCO Annual Meeting; 2018 Jun 1-5; Chicago, IL, USA. Abstract #LBA9000.
4. Cambridge R et al. Updated efficacy and safety data from the global phase III ALEX study of alectinib (ALC) vs crizotinib (CZ) in untreated advanced ALK+ NSCLC. To be presented at: ASCO Annual Meeting; 2018 Jun 1-5; Chicago, IL, USA. Abstract #9043.




