Redacción Farmacosalud.com
Investigadores de la Universidad Rovira i Virgili (URV, en Tarragona) y de la Universidad de Australia Meridional han desarrollado un biosensor óptico que permite detectar posibles complicaciones en úlceras diabéticas de los pies, úlceras por presión o úlceras venosas de las piernas, es decir, en heridas crónicas. “El sensor detecta un biomarcador que se encuentra en el líquido de la herida y que puede correlacionarse con el estado de la cicatrización de ésta. La toma de la muestra del líquido que supura la herida, realizada en las condiciones higiénicas correctas, no supondría ningún problema para el paciente ni tendría efectos secundarios. El biosensor no está nunca en contacto directo con la lesión”, explica la doctora Elisabet Xifré, investigadora de la Universidad Rovira i Virgili que ha participado en la creación del innovador dispositivo.

Los investigadores Elisabet Xifré y Lluís Marsal, ante el aparato de espectroscopia de reflectancia interferométrica que han utilizado para desarrollar el sensor, un método óptico que permite detectar niveles de señal ínfimos
Fuente: URV
El biosensor óptico permite detectar de manera rápida y fiable la presencia del biomarcador TNF-α, un importante marcador biológico presente alrededor de las heridas crónicas. La detección y cuantificación del TNF-α es muy importante, ya que su sobreproducción se asocia a la inflamación persistente y la destrucción de tejido. El TNF-α es una citoquina proinflamatoria -regula el mecanismo de la inflamación- que, además de tener un papel importante en los procesos de inmunidad e inflamación, se correlaciona con el estado de cicatrización de las heridas. Su detección y cuantificación indica la evolución de tales lesiones y permite ver el progreso del tratamiento.
Objetivo: obtener un diagnóstico rápido
El objetivo de los investigadores era desarrollar nuevos sensores cuyos métodos de detección mejoraran en algunos aspectos los métodos ya existentes, es decir, se propusieron que los nuevos sensores requirieran un menor procesado de las muestras biológicas y permitieran “obtener un diagnóstico rápido, evitando cultivos y otros procesos que alargan el tiempo de obtención de resultados. Para los dos grupos de investigación que hemos colaborado en este biosensor, la motivación era desarrollar nuevos métodos de detección que cumplieran estas dos características”, expone Xifré. Las heridas crónicas tipo úlceras diabéticas de los pies, úlceras por presión o úlceras venosas de las piernas tienen incidencia en la vida diaria de “una parte de la población mundial (especialmente adultos mayores de 60 años)”, al tiempo que constituyen “un coste bastante alto para la sanidad pública, por lo que desarrollar un sistema que permita evaluar su evolución tiene una repercusión en el bienestar” de estos enfermos, señala la experta.
El trabajo[1] sobre el biosensor óptico se ha realizado en colaboración entre el grupo de investigación del Instituto Future Industries, de la Universidad de Australia Meridional, dirigido por el profesor Nicolas H. Voelcker, y el grupo de investigación NePhoS (Sistemas Nanoelectrónicos y Fotónicos), del Departamento de Ingeniería Electrónica, Eléctrica y Automática de la URV, dirigido por el profesor Lluís Marsal. La colaboración entre estos dos grupos de investigación, esencial para el desarrollo del biosensor, ha incluido una estancia de tres meses del estudiante de doctorado de la Universidad de Australia Meridional, Gayathri Rajeev, en los laboratorios de la Universidad Rovira i Virgili, bajo la supervisión de las investigadoras del grupo NePhoS Beatriz Prieto y la propia doctora Xifré.
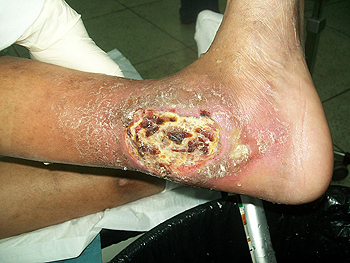
Úlcera en un pie diabético
Autor/a de la imagen: Bobjgalindo
Fuente: Wikimedia Commons
Un ahorro en costes y una mayor comodidad para el paciente
Por ahora el sensor sólo se utiliza en un ámbito experimental, pero una vez desarrollado íntegramente el paciente podría usarlo en casa, donde obtendría unos datos que enviaría telemáticamente al centro de salud para que hiciesen el análisis del estado de su lesión. Analizar de este modo el proceso de evolución de la herida evitaría el desplazamiento del enfermo, supondría llevar a cabo una vigilancia más frecuente de la evolución de la lesión, e implicaría además una disminución de los costes, dado que se reduciría el número de visitas al centro de salud. Se trata de pacientes que a menudo son crónicos, como los diabéticos, y en muchos casos las evoluciones de estas heridas son muy largas.
Así pues, la posibilidad de ir más allá del actual modelo experimental y elaborar un biosensor manejable, de muy reducido tamaño, adaptable para el uso doméstico “supondría un avance para el diagnóstico de la evolución de la herida y permitiría un análisis más frecuente del efecto de la medicación empleada, pero el paso del ámbito experimental al doméstico requeriría una inversión importante, ya que habría que adaptar los equipos que utilizamos en el laboratorio a un equipo más compacto que fuera sencillo de utilizar para el usuario”, apunta la investigadora.
Según Xifré, “es difícil cuantificar el precio que podría tener el sensor en una etapa futura, en la que se aplicara a nivel del paciente. Muchas veces se calcula el precio pensando en la inversión que supone toda la etapa de desarrollo, investigación y puesta en marcha del sistema, lo cual suele ser importante, pero también se debería tener en cuenta el ahorro que supondría en visitas médicas y en la comodidad que implicaría para el paciente por no tener que desplazarse, además de que éste tendría un control más frecuente de la evolución de su herida”.
Un dispositivo altamente sensible que no detecta falsamente otros elementos
El nuevo biosensor se ha diseñado con un material altamente penetrable, la alúmina nanoporosa, con nanoporos de 50 nanómetros de tamaño, la superficie de los cuales es modificada químicamente con el objetivo de que quede unida selectivamente al biomarcador TNF-α que se quiere detectar. Los nanoporos aumentan la superficie efectiva de detección. Por ese motivo, este sensor es altamente sensible, de forma que, en este caso, no detecta falsamente otros elementos que pudieran encontrarse en los líquidos de las heridas.
La unión del biomarcador TNF-α con la superficie de los nanoporos genera un cambio en la respuesta óptica, que se cuantifica mediante una técnica llamada espectroscopia de reflectancia interferométrica, un método óptico que permite hallar niveles de señal ínfimos y obtener así un sensor de alta sensibilidad que no requiere elementos adicionales como, por ejemplo, marcadores fluorescentes. Este estudio establece las bases para desarrollar biosensores basados en nanomateriales como herramientas para el diagnóstico y la vigilancia de la evolución curativa de las lesiones crónicas.
La investigadora Elisabet Xifré explica los resultados de la investigación (con subtítulos en castellano)
El novedoso dispositivo, además, podría tener aplicación en otros ámbitos de la medicina, tal y como certifica la especialista: “El biosensor que hemos presentado detecta el biomarcador TNF-alfa, pero la superficie de la alúmina nanoporosa se puede modificar con otros elementos y detectar selectivamente otro tipo de moléculas o sustancias. Algunas de las principales ventajas de la alúmina nanoporosa son precisamente la facilidad para modificar funcionalmente su superficie, su gran estabilidad física y la existencia de sus nanoporos, que aumentan la superficie efectiva de detección, lo que se traduce en una mayor sensibilidad del biosensor”.
Referencias
1. Rajeev, G.; Cifro-Perez, @E.; Prieto Simon, B.; Cowin, A. J.; Marsal, L. F.; Voelcker, N. H. A “Label-Free Optical Biosensor Based on Nanoporous Anodic Alumina for Tumour Necrosis Factor-Alpha Detection in Chronic Wounds”. Sensors Actuators, B Chem. 2018, 257, 116–123. https://doi.org/10.1016/j.snb.2017.10.156




