Redacción Farmacosalud.com
En la mayoría de los casos, el cáncer de próstata se cura extirpando el tumor con cirugía y/o con radioterapia. Sin embargo, hay un 20% de pacientes que necesitarán tratamiento para eliminar células tumorales pero, inevitablemente, deja de funcionar después de dos o tres años y el cáncer progresa. En este estadio de la enfermedad, ya no hay cura. Un equipo liderado por el investigador ICREA en el Instituto de Investigación Biomédica (IRB Barcelona), Xavier Salvatella, ha descubierto un nuevo frente por donde atacar las células tumorales de próstata que han desarrollado resistencia al medicamento. El trabajo se publica en la revista ‘Structure’, del grupo Cell, y abre nuevas vías terapéuticas contra una enfermedad que provoca, sólo en Europa, 75.000 muertes al año (fuente: European Science Hub, 2015).
Las células tumorales de próstata necesitan que la proteína receptora de andrógenos esté muy activa para sobrevivir y proliferar. El fármaco que se usa para eliminar las células tumorales interfiere, de hecho, con esta proteína. El fármaco actúa uniéndose a una región concreta del receptor de andrógenos e inhabilita la proteína. "Con el tiempo la proteína acumula alteraciones, muta, y llega un momento en que es inútil enviar fármacos a aquella región, porque de hecho, la proteína se desprende de esa parte", describe.
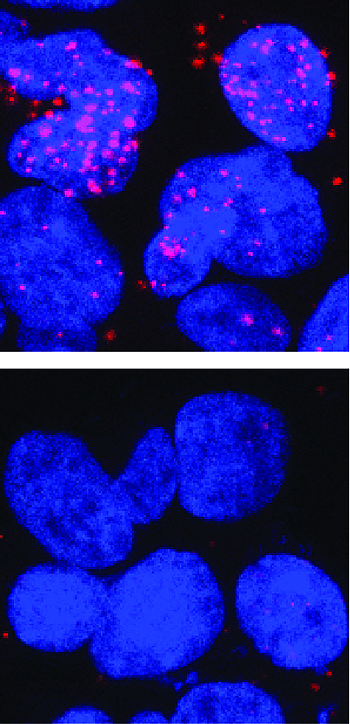
En la imagen superior, se muestran en rojo las interacciones entre la proteína receptor de andrógenos (AR) y la proteína TFIIF, nueva diana terapéutica para el tratamiento del cáncer de próstata avanzado. En la imagen inferior, no se registran interacciones tras eliminar la región del AR donde se une TFIIF
Autora de la imagen: Paula Martínez-Cristóbal, IRB Barcelona
Fuente: IRB Barcelona
‘Enganche’ de la proteína TFIIF
En el Laboratorio en Biofísica Molecular dirigido por Salvatella estudian en detalle la estructura tridimensional y los movimientos atómicos del receptor de andrógenos para encontrar nuevos puntos de anclaje. Se sabe de hace tiempo que la proteína tiene una región pequeña, de sólo 20 aminoácidos, que es clave para la supervivencia de las células tumorales. Ahora, el trabajo describe por primera vez que esta región -habitualmente sin estructura y por tanto a priori descartada para enviar fármacos- toma una estructura en forma de hélice. Al ganar esta hélice -que no se entiende aún cómo se produce-, otra proteína, llamada TFIIF, se engancha. El estudio evidencia que dicha interacción promueve la actividad del receptor de andrógenos y, consiguientemente, aseguraría la supervivencia y multiplicación de las células tumorales.
Así, aparte de la región de 20 aminoácidos que ya antes se conocía como posible diana terapéutica, el equipo del IRB Barcelona añade la proteína TFIIF. "El hecho de que sea una proteína plegada con una estructura mejor definida, hace más fácil buscar fármacos que interfieran con ella. Creemos que para las células tumorales de próstata que han alcanzado el estadio resistente, esta interacción podría ser su último recurso para sobrevivir y proliferar ", explica Salvatella. "Hemos comprobado en células in vitro que si eliminamos la región, la proteína TFIIF no se pega al receptor de andrógenos. Y si la interacción falla, el receptor de andrógenos es menos funcional, que es lo que se busca ", describe Elzbieta Maria Szulc, estudiante de doctorado "la Caixa "en el IRB Barcelona y coprimera autora del trabajo con Eva de Mol, ex-becaria "la Caixa" en el mismo laboratorio, que inició esta línea de investigación.
Los científicos están buscando fármacos que interfieran con TFIIF, en colaboración con un grupo de expertos en simulaciones computacionales. “Si después estos fármacos tendrán un efecto beneficioso en células aún no lo sabemos, pero hay datos que nos hacen ser optimistas ", declara Salvatella. En este trabajo han colaborado el laboratorio de Ángel R. Nebreda y el Laboratorio de Bioinformática Experimental, ambos del IRB Barcelona, y la Universidad de Barcelona. El estudio ha recibido financiación del Consejo Europeo de Investigación (ERC en sus siglas en inglés), la Fundación "la Caixa", el programa Marie Curie de la Unión Europea y el Ministerio de Economía y Competitividad a través de fondos FEDER.
Artículo de referencia:
Eva De Mol, Elzbieta Szulc, Claudio Di Sanza, Paula Martínez-Cristóbal, Carlos W. Bertoncini, R. Bryn Fenwick, Marta Frigolé-Vivas, Marianela Masín, Irene Hunter, Víctor Buzón, Isabelle Brun-Heath, Jesús García, Gianni De Fabritiis, Eva Estébanez-Perpiñá, Iain J. McEwan, Ángel R. Nebreda, and Xavier Salvatella. Regulation of androgen receptor activity by transient interactions of its transactivation domain with general transcription regulators. Structure (2017) https://doi.org/10.1016/j.str.2017.11.007




